姜黄素抑制CD44+结肠癌细胞增殖的体外实验研究①
郗雪艳 付 飞 樊 旭 杜伯雨
(湖北医药学院基础医学院,十堰 442000)
①本文为国家自然科学基金应急管理项目(81650019)和湖北省科技厅面上项目(2017CFB551,2017CFB462)。
②通讯作者,E-mail:du.boyu@hotmail.com。
作者简介:郗雪艳,女,博士,副研究员,主要从事肿瘤免疫方面研究,E-mail:xixueyan2001@126.com。
据我国2011年流行病学调查结果显示,结肠癌在恶性肿瘤发病率和死亡率中均排第五位,分别为23.03/10 万和11.11/10万[1]。由于传统术后化疗药物毒副作用大、靶性不强、疗效差且易产生耐药性,术后复发和转移是结肠癌治疗失败的主要原因。因此寻找特异性靶点并克服结肠癌的耐药性是结肠癌治疗中亟待解决的问题之一,对降低结肠癌的发病率并提升病人的生存质量至关重要。越来越多的证据表明,结肠癌组织中可能存在数量稀少的结肠癌肿瘤干细胞(Cancer stem cells,CSC)[2-4],其具有自我更新、增殖和分化的潜能,在结肠癌的发生、发展、复发和转移中起重要作用。结肠癌组织中肿瘤干细胞标记物CD133和CD44均高表达,O′Brien等[5]最早在2007年发现人结肠癌手术切除标本中,分离得到的细胞有20%左右是CD133+细胞,并且这种细胞具有干细胞特征,能够在小鼠体内,产生新的肿瘤细胞。由结肠癌组织分离得到的单一CD44+肿瘤细胞在体外即可形成肿瘤球,并且在裸鼠体内接种100个CD44+细胞即可成瘤[6],说明CD44+结肠癌细胞具有很强的肿瘤干细胞特征。
姜黄素(Curcumin)是一种从姜黄根茎中提取的生物活性物质,属酸性多酚类化合物,具有抗炎、抗氧化、抗菌等药理作用[7]。近年来,由于其抗肿瘤活性强,抗肿瘤谱广、毒副作用小等特点,已被广泛应用到多种肿瘤治疗的研究中,其在结肠癌治疗中的作用尤为引人关注。研究表明,姜黄素对结肠癌细胞具有细胞毒作用[8,9],可导致肿瘤干细胞标记物CD44和CD166表达下调,干细胞成球数量明显减少[10],并且姜黄素衍生物GO-Y030可抑制结肠癌肿瘤干细胞的活性和增殖效应,抑制结肠癌细胞移植瘤生长[11],提示姜黄素对结肠癌肿瘤干细胞具有抑制作用。
本研究中,我们着重探讨姜黄素对CD44+结肠癌细胞的影响。我们首先证明姜黄素可抑制结肠癌细胞HCT116和HT-29细胞的增殖,然后通过Real-time PCR和流式细胞术实验证明姜黄素处理的结肠癌细胞CD44表达下调,最后磁珠分选出CD44+的结肠癌细胞,证明姜黄素可抑制CD44+细胞的增殖。本文结果为探讨姜黄素作为结肠癌治疗辅助性药物的可能行提供依据。
1 材料与方法
1.1材料 姜黄素,McCoy′s 5A 基础培养基和MTT购自Sigma-Aldrich公司;胎牛血清购自Gibco公司;FITC标记的CD44抗体购自Ebioscience公司;CD44分选磁珠及磁珠分选专用缓冲液购自Miltenyi公司;Triozol购自Invitrogen公司;逆转录酶购自Promega公司;SYBR Green购自ToBoYo公司;PCR引物由生工公司合成。
1.2方法
1.2.1细胞培养 结肠癌细胞系HCT116和HT-29购自中国医学科学院基础医学研究所。细胞生长在含10%胎牛血清和1%青链霉素的McCoy′s 5A完全培养基中,含5%CO2的37℃培养箱中培养。
1.2.2细胞增殖实验 0.25%胰酶+0.02% EDTA消化HCT116和HT-29细胞后,用完全培养基制备成单个细胞悬液,调整细胞浓度为1×105个/ml。向96孔板中每孔加入100 μl细胞悬液,37℃过夜培养。然后加入不同剂量的姜黄素处理24 h,每孔加入10 μl MTT作用4 h,最后加入150 μl二甲基亚砜溶解甲臢颗粒,490 nm处读取吸光度值。细胞存活率=(实验组平均OD值-空白对照组平均OD值)/(对照组平均OD值-空白对照组平均OD值)×100%。
1.2.3Real-time PCR 通过 Real-time PCR检测对照组和实验组细胞中CD44 mRNA 的表达水平。不同浓度姜黄素处理细胞 24 h后,提取各组细胞总 RNA,MMLV反转录成cDNA,再以 cDNA 为模板,通过 PCR 扩增CD44,内参为GAPDH。CD44正向引物为:5′-GGCACCCGCTATGTCCAGAA-3′;CD44反向引物为5′-CCTCCTGAAGTGCTGCTCCT-3′;GAPDH正向引物为:5′-AGCTCACTGGCATGGC-CTTC-3′;GAPDH反向引物为5′-CGCCTGCTTCACCACCTTCT-3′。之后对溶解曲线进行分析,确保只有单一产物被扩增,然后使用Bio-rad CFX mana-ger3.1软件进行基因表达分析。
1.2.4流式细胞术 离心收集不同剂量姜黄素和5-氟脲嘧啶(5-FU)处理24 h后的HCT116和HT-29细胞,PBS洗细胞2次后,以100 μl PBS重悬细胞,加入1 μl FITC标记的 CD44抗体,4℃避光作用30 min 后,应用Beckman公司CytExpert流式细胞仪检测细胞表面CD44表达情况。
1.2.5磁珠分选 CD44+结肠癌细胞分选采用Miltenyi公司的阳性分选磁珠,所有分选过程采用Miltenyi公司专用的缓冲液(130-091-221)。收集细胞悬液后,加入缓冲液1 ml,300 g离心5 min,弃上清,将细胞沉淀重悬于80 μl缓冲液中,加入CD44+分选磁珠20 μl,4℃孵育30 min,期间反复混匀数次,然后加入缓冲液1 ml重悬细胞,300 g离心5 min,弃上清,同样操作重复洗细胞2次,沉淀重悬于500 μl缓冲液中,将上述细胞悬液加入分选柱中,收集滴落的细胞液,此为阴性分选的细胞,待细胞悬液滴入完毕后,将分选柱从磁力架上移下,向分选柱中加入500 μl洗液,以活塞推动细胞,收集细胞,此为阳性分选的细胞。分选完毕的细胞以流式细胞术进行鉴定。
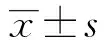
2 结果
2.1姜黄素抑制结肠癌细胞增殖 不同剂量姜黄素作用于结肠癌HCT116和HT-29细胞24 h后,应用MTT方法检测姜黄素对两种结肠癌细胞增殖的影响,结果如图1所示,姜黄素可抑制HCT116和HT-29细胞增殖,并呈现剂量依赖性关系。
2.2姜黄素可致结肠癌细胞CD44 mRNA表达下调 不同剂量的姜黄素处理结肠癌细胞24 h后,应用Real-time PCR检测结肠癌细胞干细胞标记物CD44的表达水平,以GAPDH作为内参,结果如图2所示,不同剂量的姜黄素处理结肠癌细胞后,干细胞标记物CD44的表达水平在HCT116和HT-29两种结肠癌细胞系中均呈现剂量依赖性下降。
2.3姜黄素可致结肠癌细胞表面CD44表达下降 分别应用姜黄素和5-FU处理结肠癌细胞HCT116和HT-29,流式细胞术检测结肠癌细胞表面CD44表达的水平,结果如图3所示,随着姜黄素剂量增加,结肠癌细胞HCT116和HT-29表面CD44表达水平逐渐下降;而不同浓度的结肠癌广谱化疗药物5-FU虽然可以有效的杀伤结肠癌细胞,但并不能引起CD44表达下调。

图1 姜黄素抑制结肠癌细胞系HCT116和HT-29增殖Fig.1 Proliferation inhibition effect of curcumin against colon cancer cells,HCT116 and HT-29

图2 姜黄素处理后的结肠癌细胞系CD44的表达下调Fig.2 Downregulation of CD44 expression in colon cancer cells treated with curcuminNote: *.P<0.05.
2.4姜黄素抑制CD44+的结肠癌干细胞的增殖 应用磁珠分选法分离结肠癌细胞系HCT116和HT-29中CD44+和CD44-细胞,加入不同剂量姜黄素和5-FU处理24 h后,检测细胞增殖情况,结果如图4所示,不同剂量的姜黄素对CD44+细胞的增殖抑制作用明显强于其对CD44-细胞的作用,而不同剂量的5-FU对CD44+和CD44-结肠癌细胞的增殖抑制作用在两种细胞之间并未有明显差别,提示姜黄素可特异性抑制CD44+结肠癌细胞的增殖。

图3 姜黄素处理后的结肠癌细胞CD44表达下降Fig.3 Downregulation of CD44 in colon cancer cell after treated by curcumin
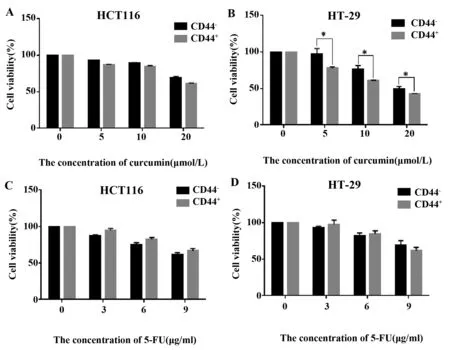
图4 姜黄素可以抑制CD44+结肠癌细胞的增殖Fig.4 Proliferation inhibition effects of curcumin against CD44+ colon cancer cellsNote: *.P<0.05.
3 讨论
作为我国发病率和死亡率较高的恶性肿瘤,结肠癌当前仍以手术治疗为主,辅以放疗和化疗。但随化疗时间的延长,结肠癌细胞会逐渐产生多药耐药性,导致化疗失败。越来越多的研究发现,耐药性的产生与肿瘤组织中存有少量的肿瘤干细胞有关[12-14]。因此特异性地消灭肿瘤干细胞,使肿瘤细胞失去分化潜能似乎成为肿瘤治疗的又一个希望[15]。
近年来,姜黄素对肿瘤干细胞的作用引人关注,姜黄素可导致肿瘤干细胞标记物CD44和CD166表达下调,干细胞成球数量明显减少[8]。本研究中,我们着重探讨姜黄素对CD44+细胞的影响。本研究结果首先提示姜黄素可抑制结肠癌细胞HCT116和HT-29细胞增殖,应用姜黄素处理后的结肠癌细胞,其结肠癌特异性干细胞表面标记物 CD44在两株结肠癌细胞中均有不同程度下调。同时流式细胞术分析结果提示姜黄素处理的结肠癌细胞表面CD44表达水平随姜黄素剂量增加而下调,而添加5-FU的结肠癌细胞表面并未有明显的CD44表达下调。此外,应用磁珠分选获得CD44+和CD44-的结肠癌细胞后,加入不同剂量的姜黄素处理细胞,结果证明姜黄素可特异性抑制CD44+结肠癌细胞增殖。由于CD44+结肠癌细胞已被认为具有很强的肿瘤干细胞特征[6,16,17],综合以上结果,提示姜黄素可通过抑制结肠癌肿瘤干细胞增殖达到治疗结肠癌的目的。
大量研究表明,姜黄素可以通过直接或间接影响肿瘤干细胞自我更新通路干预肿瘤干细胞生长,例如 Wnt/β-catenin,Hedgehog 和Notch通路[18-20],但其如何调控结肠癌干细胞CD44的表达尚不明确,有待进一步研究。而姜黄素作为一种植物来源的药物,又表现出对结肠癌肿瘤干细胞的抑制效果,未来或可成为治疗结肠癌、抑制结肠癌干细胞生长、防止结肠癌复发的一个重要靶向药物。
参考文献:
[1] Chen W,Zheng R,Zeng H,etal.Annual report on status of cancer in China,2011[J].Chin J Cancer Res,2015,27(1):2-12.
[2] Farhana L,Antaki F,Anees MR,etal.Role of cancer stem cells in racial disparity in colorectal cancer[J].Cancer Med,2016,5(6):1268-1278.
[3] Dalerba P,Dylla SJ,Park IK,etal.Phenotypic characterization of human colorectal cancer stem cells[J].Proc Natl Acad Sci U S A,2007,104(24):10158-1063.
[4] 程家平,黎 江,苏 弦,等.Oct4B1在结直肠癌干细胞中的表达及意义[J].中国免疫学杂志,2016,32(6):794-797.
Cheng JP,Li J,Su X,etal.Expression and significance of Oct4B1 in colorectal cancer stem cells[J].Chin J Immunol,2016,32 (6):794-797.
[5] O′Brien CA,Pollett A,Gallinger S,etal.A human colon cancer cell capable of initiating tumour growth in immunodeficient mice[J].Nature,2007,445(7123):106-110.
[6] Du L,Wang H,He L,etal.CD44 is of functional importance for colorectal cancer stem cells[J].Clin Cancer Res,2008,14(21):6751-6760.
[7] Zang S,Liu T,Shi J,etal.Curcumin:a promising agent targeting cancer stem cells[J].Anticancer Agents Med Chem,2014,14(6):787-792.
[8] Chen H,Zhang ZS,Zhang YL,etal.Curcumin inhibits cell proliferation by interfering with the cell cycle and inducing apoptosis in colon carcinoma cells[J].Anticancer Res,1999,19(5A):3675-3680.
[9] 文坤明,冷 敏,程家平,等.姜黄素通过抑制STAT3通路调控人结肠癌耐奥沙利铂细胞株的耐药性[J].中国免疫学杂志,2015,31(8):1056-1059.
Wen KM,Leng M,Cheng JP,etal.Curcumin reversal multidrug resistance through downregulation of STAT3 signaling in colon cancer cell lines resistant to oxaliplatin[J].Chin J Immunol,2015,31 (8):1056-1059.
[10] Yu Y,Kanwar SS,Patel BB,etal.Elimination of colon cancer stem-like cells by the combination of curcumin and FOLFOX[J].Transl Oncol,2009,2(4):321-328.
[11] Lin L,Liu Y,Li H,etal.Targeting colon cancer stem cells using a new curcumin analogue,GO-Y030[J].Br J Cancer,2011,105(2):212-20.
[12] Sordillo PP,Helson L.Curcumin and cancer stem cells:curcumin has asymmetrical effects on cancer and normal stem cells[J].Anticancer Res,2015,35(2):599-614.
[13] Mukherjee S,Mazumdar M,Chakraborty S,etal.Curcumin inhibits breast cancer stem cell migration by amplifying the E-cadherin/beta-catenin negative feedback loop[J].Stem Cell Res Ther,2014,5(5):116.
[14] Buhrmann C,Kraehe P,Lueders C,etal.Curcumin suppresses crosstalk between colon cancer stem cells and stromal fibroblasts in the tumor microenvironment:potential role of EMT[J].PLoS One,2014,9(9):e107514.
[15] 黄 雪,郑媛媛,李富荣.免疫细胞靶向治疗结肠癌肿瘤干细胞[J].中国免疫学杂志,2017,33(1):156-160.
Huang X,Zheng YY,Li FR,etal.Targeting treatment of colon cancer stem cells by using immune cells[J].Chin J Immunol,2017,33 (1):156-160.
[16] Su YJ,Lai HM,Chang YW,etal.Direct reprogramming of stem cell properties in colon cancer cells by CD44[J].EMBO J,2011,30(15):3186-3199.
[17] Yan Y,Zuo X,Wei D.Concise review:emerging role of CD44 in cancer stem cells:a promising biomarker and therapeutic target[J].Stem Cells Transl Med,2015,4(9):1033-1043.
[18] Batsaikhan BE,Yoshikawa K,Kurita N,etal.Cyclopamine decreased the expression of Sonic Hedgehog and its downstream genes in colon cancer stem cells[J].Anticancer Res,2014,34(11):6339-6344.
[19] Srinivasan T,Walters J,Bu P,etal.NOTCH signaling regulates asymmetric cell fate of fast- and slow-cycling colon cancer-initiating cells[J].Cancer Res,2016,76(11):3411-3421.
[20] Wang D,Kong X,Li Y,etal.Curcumin inhibits bladder cancer stem cells by suppressing Sonic Hedgehog pathway[J].Biochem Biophys Res Commun,2017,493(1):521-527.

