Gli2对高糖条件下肾小管上皮细胞凋亡及ROS水平影响
张灵灵 郭利芹 徐 可
(新乡市中心医院肾内科,新乡 453000)
糖尿病是一种严重危害人类生命健康的疾病,在世界范围内的发病率极高,糖尿病引起的并发症是导致其死亡的重要原因,糖尿病肾病是最为常见的糖尿病并发症之一,其主要病理变化为肾小管萎缩和间质纤维化,而肾小管上皮细胞异常凋亡是造成肾小管萎缩和间质纤维化的重要原因[1,2]。大量的研究显示,糖尿病患者肾脏组织中常常存在大量的活性氧(Reactive oxygen species,ROS),影响组织内的氧化平衡,造成氧化损伤,进一步损害肾组织,研究高糖环境下的肾小管上皮细胞凋亡和氧化损伤是探讨糖尿病肾病发病机制的重要部分[3,4]。
胶质瘤相关癌基因2(Glioma associated oncog-ene homolog 2,Gli2)是Sonic hedgehog(Shh)信号通路的关键基因,能够调控下游靶基因的激活和转录过程,在细胞凋亡过程中具有重要作用[5]。研究表明,Shh信号通路与糖尿病的发生有关,其在糖尿病肾病组织中表达下调,Gli2作为Shh信号通路的关键调控基因,在高糖作用后的肾小管上皮细胞中的表达水平也下降[6]。为了明确Gli2在糖尿病肾病发病中的作用,本研究通过细胞转染的方法过表达肾小管上皮细胞中的Gli2水平,探讨Gli2在肾小管上皮细胞凋亡和氧化损伤中的作用。
1 材料与方法
1.1材料 肾小管上皮细胞NRK-52E购自上海研域生物科技有限公司;Lipofectamine2000购自美国Thermo公司;Gli2过表达载体(pcDNA3-Gli2)由新乡医学院实验室构建保存;兔抗Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)一抗、兔抗Gli2一抗、兔抗活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved cysteinyl aspartate specific proteinase 3,Cleaved Caspase-3)一抗、兔抗Ptch相关跨膜蛋白Smoothened(Smo)一抗、兔抗β 肌动蛋白(β-actin)一抗均购自美国Santa公司;Gli2、β-actin引物购自南京金斯瑞;反转录试剂盒、 Real-time RT-PCR试剂盒均购自大连TaKaRa公司;二喹啉甲酸(Bicinchoninic acid,BCA)蛋白浓度检测试剂盒购自美国pierce公司;ROS含量检测试剂盒购自上海前尘生物科技有限公司;超氧化物歧化酶(Superoxide dismutase,SOD)含量检测试剂盒购自碧云天生物技术研究所。
1.2方法
1.2.1细胞培养及转染 肾小管上皮细胞NRK-52E在含有10%胎牛血清的DMEM中培养,当细胞密度达到60%时,用Lipofectamine2000把pcDNA3-Gli2和对照pcDNA3空载体转染到NRK-52E细胞中,并且依次命名为pcDNA3-Gli2组和pcDNA3组,以不做转染的细胞为对照组。转染后48 h后,收集各组细胞,用RT-PCR和Western blot检测转染后细胞中Gli2水平。
1.2.2Real-time RT-PCR检测Gli2水平 取1.2.1中的各组细胞,提取细胞中的RNA,用紫外分光光度计测定OD260/OD280≥1.8。用反转录试剂盒合成cDNA后,进行Real-time RT-PCR检测。扩增程序为:95℃ 30 s、95℃ 5 s、58℃ 40 s,共40个循环,65℃到95℃溶解曲线,以β-actin为内参,2-ΔΔCt法统计分析基因水平。Gli2上游引物为5′-GTGGGTTAGGGATGGACTGAGG-3′,下游引物5′-GTTTTTGGTGGTAAAGTGGGTGG-3′。β-actin上游引物为5′-GTTGCGTTACACCCTTTCTTGAC-3′,下游引物5′-CTCGGCCACATTGTGAACTTTG-3′。
1.2.3Western blot检测Gli2水平 取1.2.1中的各组细胞,提取细胞总蛋白,用BCA定量检测试剂盒检测蛋白浓度,蛋白变性后,用60 V的初始电压电泳后,观察溴酚蓝进入到浓缩胶的底部后,把电压加大为100 V继续电泳。1.5 mA/cm2转膜90 min。5%脱脂奶粉封闭,加入1∶1 000稀释的一抗在4℃过夜反应,与1∶2 000稀释后的二抗在室温孵育90 min,显色后,凝胶成像系统拍照,用Image-pro-plus 5处理图片,以β-actin为内参,分析目的蛋白水平。
1.2.4细胞处理 取肾小管上皮细胞NRK-52E,按照1.2.1中进行转染后,在实验0 h时把对照组细胞分别用高糖培养液(含有30 mmol/L的葡萄糖、不含血清的DMEM)和低糖培养液(含有5.6 mmol/L的葡萄糖、不含血清的DMEM)培养,将pcDNA3-Gli2组细胞用高糖培养液培养,48 h后用于后续实验检测。将转染pcDNA3-Gli2后的细胞用高糖培养液培养记为pcDNA3-Gli2+高糖,将不做转染的细胞用高糖和低糖培养液分别记为对照+高糖和对照+低糖。
1.2.5流式细胞术检测凋亡 取1.2.4中处理的各组细胞,收集含有106个细胞,用500 μl的结合缓冲液悬浮细胞,加入5 μl的碘化丙啶(Propidium iodide,PI)和10 μl的膜联蛋白 V-FITC(Annexin V-FITC),室温,避光反应10 min。在1 h内用流式细胞仪检测细胞凋亡水平。
1.2.6ROS、SOD含量检测 取1.2.4中处理的各组细胞,收集细胞。用二氯二氢荧光素二乙酸酯(Dichlorodihydrofluorescein diacetate,DCFH-DA)探针法检测细胞中的ROS水平,步骤参照试剂盒,用荧光强度表示ROS水平。同时收集细胞,用黄嘌呤氧化酶法检测SOD含量,步骤参照试剂盒。
1.2.7Western blot检测细胞中Bax、Cleaved Caspase-3、Smo水平 取1.2.4中处理的各组细胞,收集细胞,提取细胞总蛋白,按照1.2.3中检测各组细胞中Bax、Cleaved Caspase-3、Smo水平。
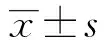
2 结果
2.1细胞转染后Gli2表达水平 如图1和表1所示,对照、pcDNA3、pcDNA3-Gli2细胞中Gli2 mRNA水平为:0.85±0.07、0.82±0.11、3.26±0.24,蛋白水平为:0.16±0.04、0.18±0.01、0.82±0.09。pcDNA3-Gli2细胞中Gli2 mRNA和蛋白水平明显高于对照细胞,差异具有统计学意义(P<0.01)。pcDNA3细胞中Gli2 mRNA和蛋白水平与对照细胞相比差异没有统计学意义(P>0.05)。pcDNA3-Gli2转染后可以明显提高肾小管上皮细胞中Gli2基因和蛋白水平。
2.2细胞凋亡检测 如图2和表2所示,对照+低糖、对照+高糖、pcDNA3-Gli2+高糖细胞凋亡率依次为:(9.26±0.95)%、(23.54±3.26)%、(18.05±1.36)%。对照+高糖细胞凋亡率明显高于对照+低糖细胞,差异具有统计学意义(P<0.01)。pcDNA3-Gli2+高糖细胞凋亡率明显低于对照+高糖细胞,差异具有统计学意义(P<0.05)。高糖诱导肾小管上皮细胞凋亡,而Gli2可以减少高糖对肾小管上皮细胞凋亡的诱导作用。

图1 Western blot检测细胞中Gli2蛋白水平Fig.1 Gli2 protein level in cells detected by Western blot
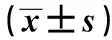


GroupsGli2 mRNAGli2 proteinControl 0.85±0.070.16±0.04pcDNA30.82±0.111)0.18±0.011)pcDNA3-Gli23.26±0.242)0.82±0.092)F236.513129.429P<0.01<0.01
Note:Compared with the control,1)P>0.05;compared with the control,tmRNA=16.697,tprotein=11.607,2)P<0.01.
2.3细胞中ROS、SOD水平检测结果 如表3所示,以荧光强度表示ROS水平,对照+低糖、对照+高糖、pcDNA3-Gli2+高糖细胞荧光强度依次为:(5.36±0.58)×103AU、(10.69±1.63)×103AU、(7.50±0.95)×103AU,SOD水平为:(16.39±1.41)×103U/L、(7.85±0.83)×103U/L、(12.69±1.14)×103 U/L。对照+高糖细胞ROS水平明显高于对照+低糖细胞,而SOD水平明显低于对照+低糖细胞,差异具有统计学意义(P<0.01)。pcDNA3-Gli2+高糖细胞ROS水平明显低于对照+高糖细胞, 而SOD水平明显高于对照+高糖细胞,差异具有统计学意义(P<0.05)。高糖诱导肾小管上皮细胞氧化损伤,而Gli2可以减少高糖对肾小管上皮细胞的氧化损伤。
2.4细胞中Bax、Cleaved Caspase-3、Smo水平检测 如图3和表4所示,对照+低糖、对照+高糖、pcDNA3-Gli2+高糖细胞Bax水平依次为:0.32±0.04、1.14±0.12、0.58±0.08,Smo水平为:0.48±0.06、0.19±0.03、0.34±0.02,Cleaved Caspase-3水平为:0.15±0.02、1.03±0.09、0.64±0.07。对照+高糖细胞Bax、Cleaved Caspase-3水平明显高于对照+低糖细胞,而Smo水平明显低于对照+低糖细胞,差异具有统计学意义(P<0.01)。pcDNA3-Gli2+高糖细胞Bax、Cleaved Caspase-3水平明显低于对照+高糖细胞,而Smo水平明显高于对照+高糖细胞,差异具有统计学意义(P<0.01)。高糖作用后能够降低肾小管上皮细胞Smo水平,升高Bax、Cleaved Caspase-3水平,而Gli2可以部分拮抗高糖对Bax、Cleaved Caspase-3、Smo水平的影响。

图2 流式细胞术检测细胞凋亡Fig.2 Apoptosis was detected by flow cytometry
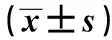


GroupsApoptosis rate(%)Control+low glucose9.26±0.95Control +high glucose23.54±3.261)pcDNA3-Gli2+high glucose17.85±1.262)F35.458P<0.01
Note:Compared with the control+low glucose,t=7.284,1)P<0.01;compared with control +high glucose,t=2.820,2)P<0.05.
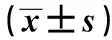


GroupsROS(×103 AU)SOD(×103 U/L)Control+low glucose5.36±0.5816.39±1.41Control +high glucose10.69±1.631)7.85±0.831)pcDNA3-Gli2+high glucose7.50±0.952)12.69±1.142)F16.62041.511P<0.01<0.01
Note:Compared with the control+low glucose,tROS=5.336,tSOD=9.041,1)P<0.01;compared with control+high glucose,tROS=2.929,tSOD=5.945,2)P<0.05.

图3 Western blot检测Bax、Cleaved Caspase-3、Smo水平Fig.3 Level of Bax,Cleaved Caspase-3,Smo detected by Western blot
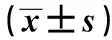
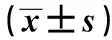

GroupsBaxSmoCleavedCaspase-3Control+low glucose0.32±0.040.48±0.060.15±0.02Control +high glucose1.14±0.121)0.19±0.031)1.03±0.091)pcDNA3-Gli2+high glucose0.58±0.082)0.34±0.022)0.64±0.072)F70.55438.633130.590P<0.01<0.01<0.01
Note:Compared with the control+low glucose,tBax=11.228,tSmo=7.488,tCaspase-3=16.532,1)P<0.01;compared with control+high glucose,tBax=6.725,tSmo=7.206,tCaspase-3=5.925,2)P<0.01.
3 讨论
Shh信号通路在脑组织、胃肠道、皮肤、肺组织等器官中均有表达,并且参与胚胎发育和组织器官生成,Shh信号通路是存在于脊椎动物中的Hedgehog的同源基因,Shh信号通路是进化较为保守,在早期的毛囊发育、牙齿形态发生、肢体发育、器官发育等均有重要作用,Shh信号通路由转录因子Gli、Ptch相关跨膜蛋白Smoothened(Smo)、Shh蛋白配体、靶基因、跨膜蛋白受体Patch(Ptch)等组成,当细胞中的Shh和Ptch相结合后,使Ptch对Smo的抑制作用被解除,Smo受到甾醇类的影响持续活化,影响Gli2的转录,从而影响下游靶基因的转录,调控细胞的生长、凋亡等一系列过程,而Gli2反过来又可以影响Smo的表达水平[7-12]。糖尿病肾病作为一种慢性病已经严重影响了人类的生命健康,而肾小管上皮细胞受损是糖尿病肾病发生的重要原因[13]。Shh作为调控细胞生物学特性的信号通路,不仅参与肿瘤、糖尿病心肌病、脑缺血再灌注等疾病的发生,还与糖尿病肾病的发生有关[14,15]。研究显示,Gli2在糖尿病肾病肾组织中表达水平减弱,并且在肾小管上皮细胞中也有表达,下调Shh表达可以抑制高糖诱导的肾小管上皮细胞凋亡[16]。
糖尿病肾病发病机制除了与肾小管上皮细胞凋亡有关以外,氧化应激也参与其中,高血糖环境下,肾小管上皮细胞的糖负荷加重,导致肾小管对氧的消耗能力加快,这就容易引起肾小管缺氧,进而导致肾组织发生氧化应激,损伤肾小管上皮细胞[17]。ROS水平与组织内的氧化平衡有关,在正常情况下,适量的ROS在细胞内信号转导过程中发挥作用,而当细胞内的ROS水平异常升高时,氧自由基的清除剂SOD不能及时将过量的ROS清除,导致细胞膜上的脂质发生过氧化,引起细胞膜通透性的改变,进而引起氧化损伤,诱导细胞凋亡发生;另外,细胞内适量的ROS可以发挥信号传导的作用,当细胞内ROS水平过量升高后,引起细胞内信号传递发生紊乱,促进细胞凋亡发生[18,19]。
本研究结果显示,高糖作用后的肾小管上皮细胞凋亡增加,细胞中ROS水平升高,SOD水平下降,细胞中Smo水平也下降,而Gli2过表达后的肾小管上皮细胞经高糖培养后,凋亡减少,ROS水平也降低,Smo水平升高,Gli2可以降低高糖对肾小管上皮细胞氧化损伤,减少细胞凋亡。Gli2作为Shh信号通路的关键基因,与Shh同样可以影响糖尿病肾病肾组织损伤,减少肾小管上皮细胞凋亡。
细胞凋亡是一个复杂的过程,是一系列基因共同调控的作用,也是凋亡蛋白和抗凋亡蛋白共同作用的结果,是细胞主动发生的程序性死亡,是机体维持内环境稳定的重要组成部分[20]。Caspase蛋白家族和Bcl-2蛋白家族是目前研究的与细胞凋亡关系最为密切的两大蛋白家族,其中Caspase级联反应能够诱导细胞凋亡的发生,Caspase-3作为凋亡执行因子,其活化后成为Cleaved Caspase-3是细胞凋亡不可逆的标志,Bax是Bcl-2蛋白家族的成员之一,是一种促凋亡蛋白,其表达水平升高后发挥促进细胞凋亡的作用[21]。研究显示,Cleaved Caspase-3、Bax在糖尿病肾病大鼠模型肾组织中水平均升高,并且二者在肾小管上皮细胞凋亡过程中发挥促进作用[22]。本研究结果显示,高糖诱导肾小管上皮细胞Cleaved Caspase-3、Bax水平升高,而Gli2可以降低细胞中Cleaved Caspase-3、Bax水平,说明Gli2作用机制与Cleaved Caspase-3、Bax有关。
总之,Gli2能够降低高糖诱导的肾小管上皮细胞氧化损伤和细胞凋亡,降低细胞中Cleaved Caspase-3、Bax水平,在糖尿病肾病肾组织损伤中发挥保护作用。本研究明确了Gli2在高糖环境下肾小管上皮细胞凋亡中的作用,其作用机制仍需要在后续研究中继续探讨,由于本实验只选用了一种肾小管上皮细胞,后续会在多株细胞中进行相关验证。
参考文献:
[1] 王道周,裘志成,杨 艳,等.姜黄素对2型糖尿病肾病大鼠保护作用及机制研究[J].中国免疫学杂志,2017,33(4):588-592.
Wang DZ,Qiu ZC,Yang Y,etal.Protective effect of curcumin on type 2 diabetic nephropathy rats and mechanism research [J].Chin J Immun,2017,33(4):588-592.
[2] Nishikawa T,Brownlee M,Araki E.Mitochondrial reactive oxygen species in the pathogenesis of early diabetic nephropathy[J].J Diabetes Invest,2015,6(2):137-139.
[3] Lv S,Cheng J,Sun A,etal.Mesenchymal stem cells transplantation ameliorates glomerular injury in streptozotocin-induced diabetic nephropathy in rats via inhibiting oxidative stress[J].Diabetes Res Clin Pract,2014,104(1):143-154.
[4] Bondeva T,Wolf G.Reactive oxygen species in diabetic nephropathy:friend or foe?[J].Nephrol Dialysis Transplant,2014,29(11):1998-2003.
[5] Furmanski AL,Barbarulo A,Solanki A,etal.The transcriptional activator Gli2 modulates T-cell receptor signalling through attenuation of AP-1 and NFκB activity[J].J Cell Sci,2015,128(11):2085-2095.
[6] Kang HM,Ahn SH,Choi P,etal.Defective fatty acid oxidation in renal tubular epithelial cells has a key role in kidney fibrosis development[J].Nat Med,2015,21(1):37-46.
[7] Zhao H,Feng J,Seidel K,etal.Secretion of shh by a neurovascular bundle niche supports mesenchymal stem cell homeostasis in the adult mouse incisor[J].Cell Stem Cell,2014,14(2):160-173.
[8] Tong CK,Fuentealba LC,Shah JK,etal.A dorsal SHH-dependent domain in the V-SVZ produces large numbers of oligodendroglial lineage cells in the postnatal brain[J].Stem Cell Rep,2015,5(4):461-470.
[9] Zhan M,Sun X,Liu J,etal.Usp7 promotes medulloblastoma cell survival and metastasis by activating Shh pathway[J].Biochem Biophys Res Commun,2017,484(2):429-434.
[10] 王宝祥,戴若莲,李焰生.SHH 对 MCAO 模型大鼠血管新生的影响及作用机制[J].山东医药,2015,55(14):1-4.
Wang BX,Dai RL,Li YS.Effect and mechanism of SHH on neovascularization of model rats with middle cerebral artery occlusion[J].Shandong Med J,2015,55(14):1-4.
[11] Grzelak CA,Sigglekow ND,McCaughan GW.GLI2 as a marker of hedgehog-responsive cells[J].Hepatology,2015,61(5):1770-1770.
[12] Sun Z,Zhang T,Hong H,etal.miR-202 suppresses proliferation and induces apoptosis of osteosarcoma cells by downregulating Gli2[J].Mol Cell Biochem,2014,397(1-2):277-283.
[13] Lee HJ,Lee DY,Mariappan MM,etal.Hydrogen sulfide inhibits high glucose-induced NADPH oxidase 4 expression and matrix increase by recruiting inducible nitric oxide synthase in kidney proximal tubular epithelial cells[J].J Biological Chem,2017,292(14):5665-5675.
[14] 贺昱霖,刘佳琪,刘 群,等.Sonic hedgehog 信号通路与食管癌放射抗拒的相关性研究[J].中国病理生理杂志,2017,33(6):1043-1047.
He YL,Liu JQ,Liu Q,etal.Relationship between Sonic hedgehog signaling pathways and radioresistance of esophageal cancer[J].Chin J Pathophys,2017,33(6):1043-1047.
[15] 侯世会,李 艺,官 涛,等.Sonic hedgehog 蛋白在糖尿病肾脏病肾间质纤维化中的表达及临床意义[J].临床肾脏病杂志,2017,17(5):276-281.
Hou SH,Li Y,Guan T,etal.Expression and clinical significance of Sonic hedgehog in renal interstitial fibrosis of diabetic nephropathy[J].J Clin Nephrol,2017,17(5):276-281.
[16] Zhao D,Jia J,Shao H.miR-30e targets GLIPR-2 to modulate diabetic nephropathy:in vitro and in vivo experiments[J].J Mol End Ocrinol,2017,59(2):181-190.
[17] Zhang X,Zhao Y,Chu Q,etal.Zinc modulates high glucose-induced apoptosis by suppressing oxidative stress in renal tubular epithelial cells[J].Biological Trace Element Res,2014,158(2):259-267.
[18] Zhang X,Liang D,Lian X,etal.Berberine activates Nrf2 nuclear translocation and inhibits apoptosis induced by high glucose in renal tubular epithelial cells through a phosphatidylinositol 3-kinase/Akt-dependent mechanism[J].Apoptosis,2016,21(6):721-736.
[19] 余 理,党西强,何小解,等.尿酸上调肾小管上皮细胞还原型烟酰胺腺嘌呤二核苷酸磷酸酶蛋白水平对肾小管上皮细胞凋亡的影响[J].中华实用儿科临床杂志,2011,26(17):1328-1330.
Yu L,Dang XQ,He XJ,etal.Effect of nicotinamide adenine dinucleotidephosphate enzyme protein levels increased uric acid on apoptosis of renal tubular epithelial cells of rats[J].Chin J Appl Clin Pediatr,2011,26(17):1328-1330.
[20] 刘 雪,陈丽香,周晓辉.炎症小体和细胞死亡通路相互关系的研究进展[J].中国免疫学杂志,2016,32(5):739-743.
Liu X,Chen LX,Zhou XH.Research progress on the relationship between inflammatory corpuscles and cell death pathways [J].Chin J Immun,2016,32(5):739-743.
[21] Wang GH,Lan R,Zhen XD,etal.An-Gong-Niu-Huang Wan protects against cerebral ischemia induced apoptosis in rats:up-regulation of Bcl-2 and down-regulation of Bax and Caspase-3[J].J Ethnopharmacol,2014,154(1):156-162.
[22] Brezniceanu ML,Lau CJ,Godin N,etal.Reactive oxygen species promote caspase-12 expression and tubular apoptosis in diabetic nephropathy[J].J Am Society Nephrol,2010,21(6):943-954.

