北冰红山葡萄转色至冰冻期总酚含量变化规律研究
丁鑫,孟祥敏,贺阳,许志新,初百吉,文连奎
(吉林农业大学食品科学与工程学院,吉林长春130118)
北冰红山葡萄(Vitis amurensis Rupr)是以“左优红”为母本,“86-24-53”为父本通过杂交而成的山葡萄新品种[1]。北冰红具有较好的抗寒、抗病特性,所酿冰酒口感滑润,酒香醇厚,因此成为冰葡萄酒酿造的主要品种[2-4]。
多酚是具有苯环并结合多个羟基化学结构的一类化合物,植物叶片、花瓣和果实的不同颜色都与多酚物质相关[5],研究表明,多酚类化合物具有降血脂、清除自由基、防止衰老和肿瘤、抗动脉硬化等保健功能[6-9],对葡萄浆果和葡萄酒的质量有较大影响[10-11]。北冰红属于杂交新品种,对其酚类物质变化规律的研究尚未见报道。
目前,测定葡萄中总酚含量的方法大多采用福林-酚比色法[12-15]。由于不同植物的多酚含量与种类不尽相同,因此若用福林-酚比色法测定不同植物中的总酚含量时,需对其条件进行改进。本文采用福林-酚比色法对检测条件进行优化后,测定北冰红果实转色至冰冻期多酚物质的含量,研究其发育过程中总酚含量的变化趋势,为提高北冰红冰葡萄酒的酒质提供一定依据。
1 材料与方法
1.1 材料与试剂
北冰红山葡萄:于2016年采于通化市柳河县葡萄酒研发中心葡萄基地;福林-酚试剂:国药集团化学试剂有限公司;甲醇(分析纯):北京化工厂;没食子酸(分析纯):天津市科密欧化学试剂有限公司;无水碳酸钠(分析纯):西陇化工股份有限公司。
1.2 仪器与设备
T6新世纪紫外-可见分光光度计:北京普析通用仪器有限责任公司;LXJ-IIB低速大容量多管离心机:上海安亭科学仪器厂;电热恒温水浴锅:常州普天仪器制造有限公司;FA-2004电子天平:上海精天电子仪器有限公司。
1.3 方法
1.3.1 样品的采摘
自2016年8月17日开始每5天采样一次,直至9月30日,此后每10天采样一次,到11月30日结束。每次剪取葡萄果实100粒左右,分装于保鲜袋中,-18℃保藏。试验前室温解冻。
1.3.2 样品的制备及溶液配制
取解冻后北冰红去籽,破碎,取破碎后的北冰红果实(20.00±0.50)g放入250 mL容量瓶中,加入一定量95%甲醇,60 kHz超声波提取30 min,95%甲醇定容至250 mL,6000 r/min 4℃冷冻离心15 min,取上清液保存备用。
0.1 mg/mL没食子酸标准溶液:准确称取(0.0010±0.0005)g C7H6O5·H2O,蒸馏水定容至100 mL。
1.3.3 碳酸钠与福林酚试剂用量的确定
碳酸钠用量的确定:取7份1 mL没食子酸标准溶液于25 mL的具塞试管中,分别加入1 mL的福林-酚试剂,混匀静置 30 s 分别加入 0.5、1.0、2.0、3.0、4.0、5.0、6.0 mL 12%Na2CO3溶液,蒸馏水定容至 25 mL,常温避光反应2 h,765 nm测量吸光度,确定最大吸光度对应的福林-酚试剂与Na2CO3溶液的体积比。
福林-酚用量的确定:取7份1 mL没食子酸标准溶液于 25 mL 具塞试管中,分别加入 1.5、2.0、2.5、3.0、3.5、4.0、4.5 mL福林-酚试剂,混匀静置30 s后分别加入 3.0、4.0、5.0、6.0、7.0、8.0、9.0 mL 的 12%Na2CO3溶液,蒸馏水定容至25 mL,常温避光反应2 h后,765 nm测量吸光度,确定福林-酚试剂与反应液的体积比。
1.3.4 最佳反应温度的确定
取7份1 mL样品液于25 mL具塞试管中,分别加入4 mL福林-酚试剂,混匀静置30 s,加入8 mL 12%Na2CO3溶液,蒸馏水定容至 25 mL,分别在 12、16、20、24、28、32、36 ℃的温度下避光反应 2 h,765 nm 测量吸光度,确定最佳的反应温度。
1.3.5 最佳显色时间的确定
取7份1mL样品液于25 mL具塞试管中,分别加入4 mL福林-酚试剂,混匀静置30 s,加入8 mL 12%Na2CO3溶液,蒸馏水定容至25 mL,最佳反应温度下分别避光反应 1、2、3、4、5、6、7 h,765 nm 测量吸光度,确定最佳的显色时间。
1.3.6 标准曲线的建立
移取 0、0.25、0.5、0.75、1.0、1.25、1.5 mL 没食子酸标准溶液于25 mL具塞试管中,分别加入4 mL福林-酚试剂,混匀静置30 s,加入8 mL 12%Na2CO3溶液,蒸馏水定容至25 mL,20℃避光反应4 h,以0样为空白,765 nm测量吸光度,以没食子酸标准溶液浓度(μg/mL)为横坐标,吸光度为纵坐标建立标准曲线。
1.3.7 样品总多酚含量的测定
移取1 mL样品液于25 mL具塞试管中,加入4 mL福林-酚试剂,混匀静置30 s,加入8 mL 12%Na2CO3溶液,蒸馏水定容至25 mL,20℃避光反应4 h,根据标准曲线回归方程计算样品液中总多酚含量。
1.3.8 分析方法的评价
精密度试验:取5份相同处理的样品溶液100 μL于25 mL具塞试管中,按照总酚含量测定的最佳条件,测定吸光度,计算相对偏差,评价精密度。
重复性试验:取5份20 g同一日期取样的葡萄果实,参照样品制备方法,平行制备5份样品溶液,按照总酚含量测定的最佳条件,测定吸光度,计算平均多酚的含量。
稳定性试验:取5份同一处理的样品溶液100 μL于25 mL具塞试管中,按照总酚含量测定的最佳条件,于 20 ℃条件下继续放置 0.5、1.0、1.5、2.0、2.5 h 后在765 nm处测定吸光值,计算相对偏差,评价稳定性。
加标回收试验:取5份同一处理的样品溶液100 μL于25 mL具塞试管中,分别加入不同体积浓度为 0.1 mg/mL 的没食子酸标准溶液 0、0.1、0.2、0.3、0.4、0.5 mL,混匀后加入福林-酚试剂4 mL,混匀静置30 s后加入12%Na2CO3溶液8 mL,蒸馏水定容至25 mL,于20℃避光反应4 h测量吸光度,计算没食子酸的回收率,计算相对偏差,评价精密度和可靠性。
2 结果分析
2.1 显色剂用量的确定
2.1.1 12%Na2CO3用量的确定
福林-酚比色法中Na2CO3溶液是反应体系的缓冲液,Na2CO3溶液用量的多少在很大程度上影响多酚物质的显色效果,用量不足则使多酚物质显色不完全,吸光度偏低。12%Na2CO3对显色效果的影响如图1所示。
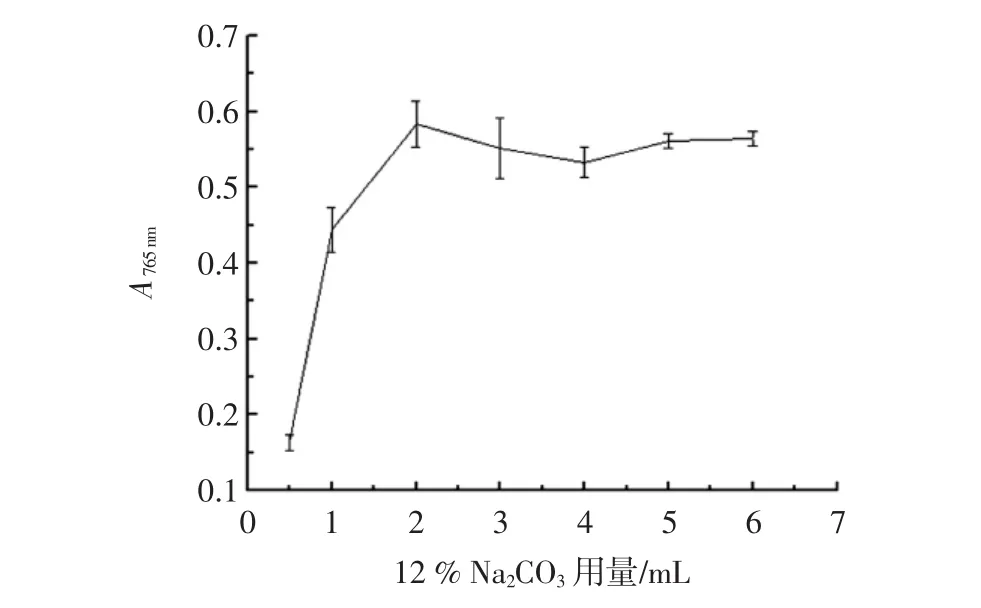
图1 12%Na2CO3用量对没食子酸标准溶液显色效果的影响Fig.1 Effect of 12%Na2CO3on the color effect of the standard solution of the gallic acid
由图1可见,吸光度随着12%Na2CO3用量的增加而增加,12%Na2CO3用量增加到2.0 mL时,吸光度最大,此时12%Na2CO3溶液的用量与福林-酚试剂的用量的体积比为2∶1,继续增加12%Na2CO3的用量,吸光度略有下降最终趋于平缓,所以可以认为当12%Na2CO3溶液的用量与福林-酚试剂的用量体积比为2∶1时,显色比较完全。
2.1.2 福林-酚试剂用量的确定
碱性溶液中,北冰红山葡萄中的多酚类化合物被福林酚试剂中的钨钼酸定量氧化,自身被还原生成蓝色化合物,底物显色的完全与否与福林-酚试剂的用量有直接关系,若用量不足,会导致显色不完全。福林-酚试剂对反应显色效果的影响如图2所示。
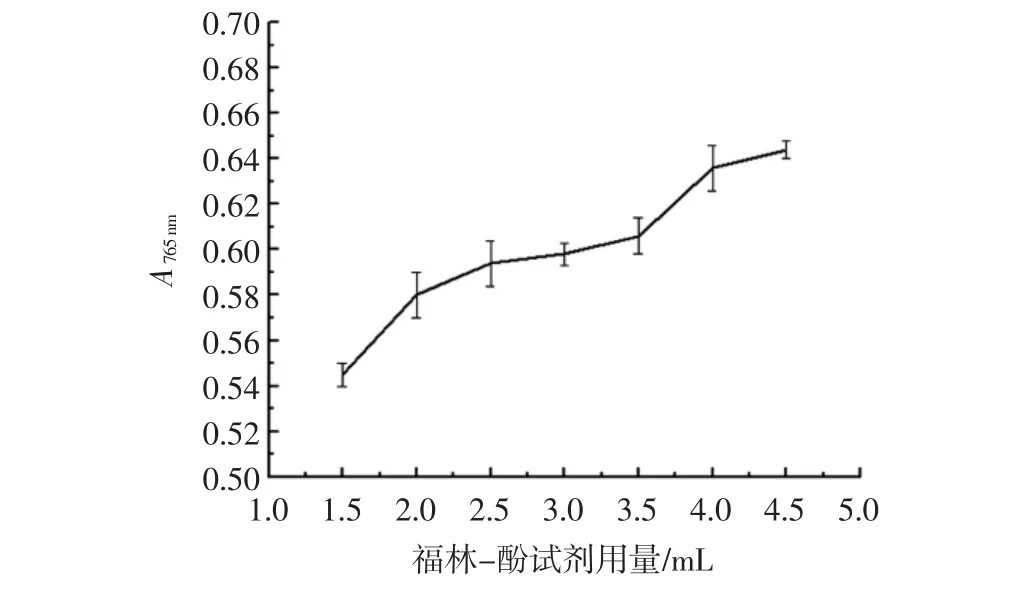
图2 福林-酚试剂用量对没食子酸标准溶液显色效果的影响Fig.2 Effect of Folin-phenol on the color effect of the standard solution of the gallic acid
由图2可见,吸光度随福林-酚试剂用量的增加而增加,当用量增加到4 mL时吸光度趋于平稳,因此当福林-酚与反应液的体积比为4∶1时,显色较为完全。
2.2 显色温度的确定
温度极易影响多酚物质自身结构,多酚物质在较高的温度体系里极易分解,若温度较低,也会影响酚类物质与福林-酚试剂的反应情况,并且不同物质所含的多酚种类和数量不一样,所以应针对样品确定相应的显色温度。温度对显色效果的影响如图3所示。
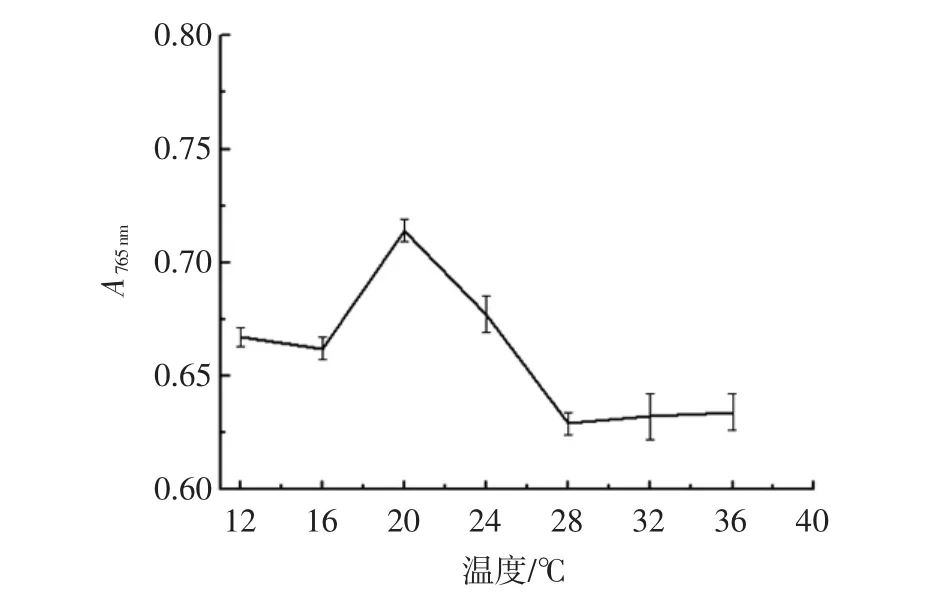
图3 反应温度对样品显色效果的影响Fig.3 The influence of reaction temperature on the color efficiency for specimen
由图3可见,在较低的温度条件下,吸光度较小,说明此时反应缓慢,低温抑制了酚类物质与福林-酚试剂的反应,随着反应温度的增加,吸光度不断增加,说明此时该反应不再受温度的抑制,当温度为20℃时,吸光度最大,当温度大于20℃时,吸光度逐渐降低,说明此时多酚物质受温度的影响已经分解。因此该反应的最佳温度为20℃。
2.3 显色时间的确定
多酚物质的显色需要一定时间,多酚物质反应是否完全与反应时间有直接关系,反应时间对显色程度的影响如图4示。
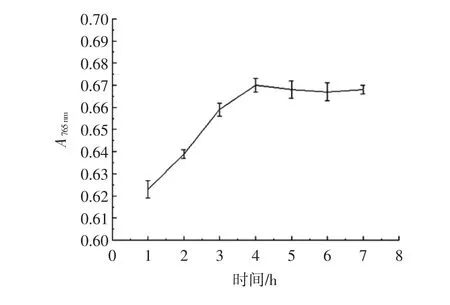
图4 反应时间对样品显色效果的影响Fig.4 The influence of reaction time on the color efficiency for specimen
由图4可见,在4 h以内显色不完全,随时间增加,吸光度明显增加,4 h时达到最大,4小时后随时间的增加吸光度趋于平稳,在误差范围内差异不显著,即可以认为反应时间为4 h时,显色完全。
2.4 标准曲线的建立及样品的测定
总多酚测定的标准曲线如图5所示。
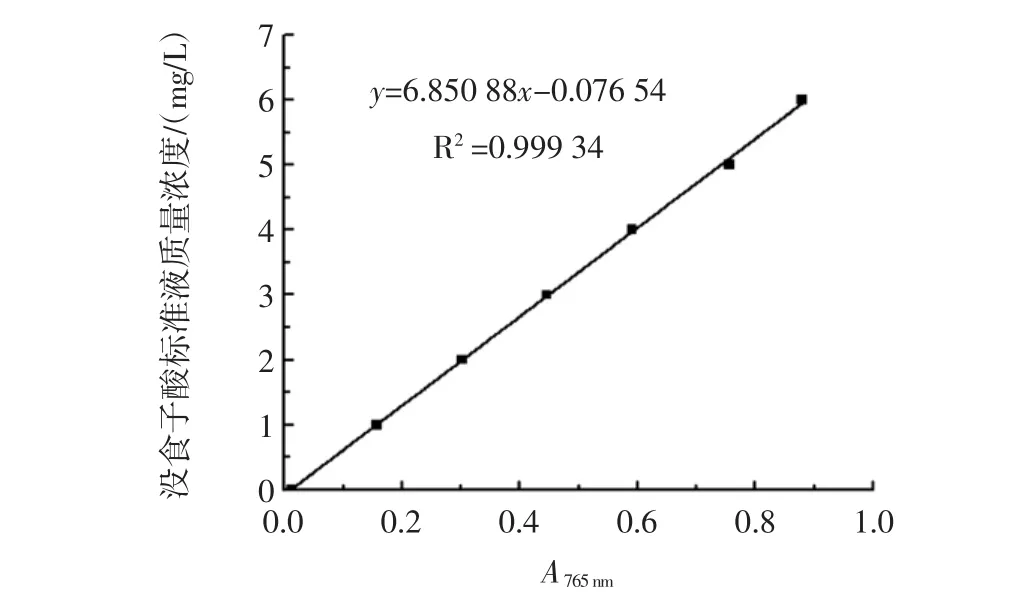
图5 北冰红总多酚测定的标准曲线Fig.5 Standard curve for the total polyphenol determination of Vitis amurensis Rupr(Beibinghong)
线性关系为y=6.850x-0.076,R2=0.9994,线性良好。式中:y为没食子酸标准液的浓度,单位为mg/L,x为吸光度。在测量样品中多酚含量时,在相同的反应条件下测定样品的吸光度,通过公式算出样品溶液中多酚的浓度,计算样品中多酚含量。
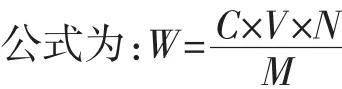
式中:W为北冰红葡萄样品中总多酚的含量,mg/g;C为没食子酸标准液的浓度,mg/L;V为提取液体积,mL;N反应液体积,mL;M为每次处理样品的质量,g。
按标准曲线的测定方法分别测定不同日期的北冰红溶液(1.0 mL),通过公式计算出没食子酸标准液的浓度,分别计算出样品北冰红葡萄中的多酚含量,其变化规律见图6。

图6 北冰红转色至冰冻时期总酚含量的变化趋势Fig.6 Variation tendency of total phenols content of Vitis amurensis Rupr(Beibinghong)coloring and frost period
由图6可见,总酚含量在2016年8月17日时为0.437 mg/g,随后呈现逐步上升的趋势,在10月21日多酚含量达到最高(1.622 mg/g),然后逐渐降低,11月30日采摘日时总酚含量降至1.105 mg/g。整体来说,在北冰红转色至冰冻期,总酚含量呈现先增后降的趋势,在成熟末期总酚含量达到最高。出现这种现象的原因可能是在转色至成熟期,北冰红山葡萄不断生长,酚类物质的合成速率大于其分解速率,因此总酚含量逐渐增加。而成熟至冰冻期,北冰红山葡萄停止生长,无生命体征,但是依然进行呼吸作用等活动,导致酚类物质的分解速率大于合成速率,因此总酚含量逐渐降低。而李阿英等[16]研究发现,在葡萄整个生长发育过程中白藜芦醇含量呈先逐渐增长达到峰值后逐渐下降的趋势,并且王美丽等[17]研究发现,在不同葡萄浆果成熟过程中,没食子酸、儿茶素、丁香酸等酚类物质的变化规律都不相同。因此其总酚的变化规律也不一定是单一的逐渐增加或降低,所以影响北冰红总酚含量变化的因素有很多种,还有待进一步研究。
2.5 分析方法的评价
2.5.1 精密度试验
精密度试验结果见表1,通过表1可知,该方法精密度良好。

表1 精密度试验Table 1 Precision experiment
2.5.2 重复性试验
重复性试验见表2。
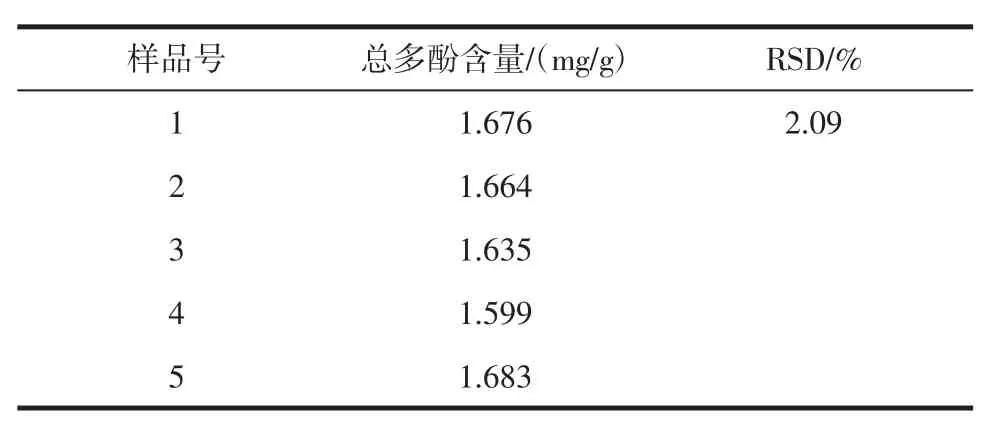
表2 重复性试验Table 2 Repetitive experiment
2.5.3 稳定性试验
稳定性试验见表3。
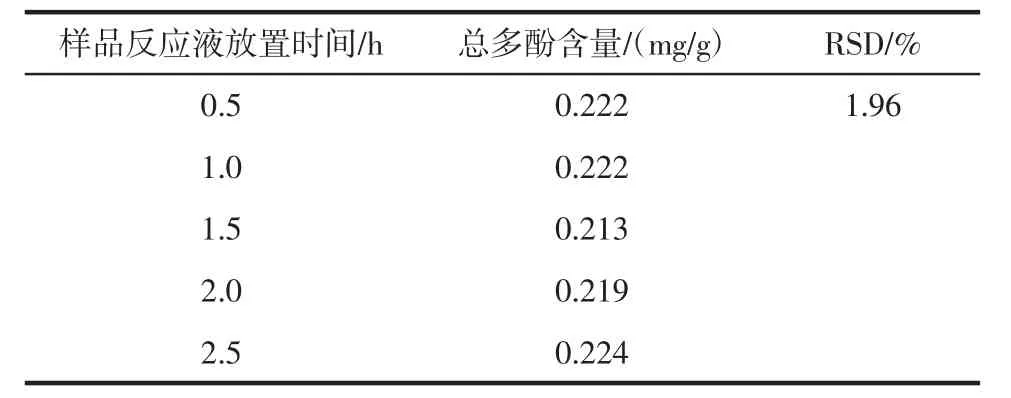
表3 稳定性试验Table 3 Stability experiment
由表3可知,该分析方法稳定性良好。
2.5.4 加标回收试验
加标回收试验见表4。

表4 加标回收试验Table 4 Average spiked recovery of total polyphenols experiment
从表4可以看出各组的加标回收率都在99%以上,RSD为1.03%,则说明该分析方法准确可靠,可用于北冰红葡萄果实总多酚含量的测定。
3 结论
福林-酚比色法测定北冰红葡萄总酚含量的最佳条件为:样品∶福林-酚试剂∶12%(质量比)Na2CO3溶液=1∶4∶8(体积比),温度 20℃,反应 4 h,测定方法的平均回收率为99.91%,RSD为1.03%。该方法适合北冰红葡萄样品总多酚含量的测定。
用福林-酚比色法分别测定不同时期的北冰红山葡萄果实中的总酚含量,可知随着葡萄果实的发育,总多酚的含量逐渐增加,直至10月21日(1.622 mg/g)左右达到最大,从10月21日至11月30日总多酚的含量逐渐降低,但降幅不明显。
[1] 宋润刚,路文鹏,沈育杰,等.酿酒葡萄新品种‘北冰红’[J].园艺学报2008,35(7):1085
[2] 王华,张莉,丁吉星,等.山葡萄‘北冰红’起泡葡萄酒研发与评价[J].生产与科技经验2015,41(7):93-98
[3]邵威平,冰酒生产工艺及其品质影响因素[J].酿酒,2004,31(2):73-74
[4]李志江,刘彬,戴凌燕,等.冰酒的研究现状与发展趋势[J].酿酒,2006,33(4):48-50
[5]LANGCAKE P,PRYCE R J.The production of resveratrol by Vitis vinifera and other members of the vitaceae as a response to infection or injury[J].Physiological Plant Pathology,1976,9(1):77-86
[6]BARREIRA C,ISABEL C F,BEATRIZ P O,et al.Antioxidant activities of the extracts from chestnut flower,leaf,skins and fruit[J].Food Chemistry,2008,107(3):1106-1113
[7]BARAARA S H,AMANAA N C,DANIEL J,et al.Beneficial effects of fruit extracts on neuronal function and behavior in a rodent model of accelerated aging[J].Neurobiology of Aging,2007,28(8):1187-1194
[8]LETICIA X,ROSA M,VALERIO-ALFARO G,et al.Antioxidant activity,phenolic compounds and anthocyanins content of eighteen strains of Mexican maize[J].Food Science and Technology,2009,42(6):1187-1192
[9]JESUS N S,EVALDO M S,ADELINE L,et al.Antioxidant capacity of four polyphenol-rich Amazonian plant extracts:a correlation study using chemical and biological in vitro assays[J].Food Chemistry,2008,106(1):331-339
[10]赵权,王军,段长青.山葡萄果实发育过程中花色苷和非花色苷酚成分及其含量的变化[J].植物生理学通讯,2010,46(1):80-86
[11]李小龙,刘美迎,张会宁.山西乡宁地区2个红色酿酒葡萄果实生长发育过程中几类多酚物质变化分析[J].西北农业学报,2016,25(4):580-587
[12]MEDINA-REMON A,BARRIONUEVO-GONZALEZ A,ZAMORA-ROS R,et al.Rapid Folin-Ciocalteu method using microtiter 96-well plate cartridges for solid phase extraction to assess urinary total phenolic compounds,as a biomarker of total polyphenols intake[J].Anal Chim Acta,2009,634(1):54-60
[13]李巨秀,王柏玉.福林-酚比色法测定桑椹中总多酚[J].食品科学,2009,30(18):292-295
[14]YOUDEN W J,STEINER E H.Official methods of analysis of the association of official analytical chemists[M].12th ed.Washington D C:Association of Official Analytical Chemists,1975:164-165
[15]王毓宁,李鹏霞,胡花丽.Folin-酚法测定水蜜桃果酒中总多酚[J].酿酒,2012,39(5):60-62
[16]李阿英,王西成,刘丹.4个鲜食葡萄品种生长发育过程中各器官白藜芦醇含量的变化[J].果树学报,2014,31(6):1079-1085
[17]王美丽,吴鲁阳,张振文.HPLC法测定不同葡萄品种成熟过程中单体酚的变化[J].西北农林科技大学学报,2007,35(4):134-138

