日粮添加苯甲酸和精油对断奶仔猪生长性能、养分消化率、血液指标及粪便有害气体含量的影响
徐剑波,曹璀文
(1.南京工业大学,江苏南京 211800;2.江苏常州经济开发区行政审批局,江苏常州 213025)
近年来,公众越来越关注抗生素在动物上的应用,如抗生素滥用引起耐药性和药物残留,对人类健康同样是一种风险。科研人员一直在努力尝试开发抗生素的替代品,其中植物提取物以被证明是替代抗生素的天然物质之一(毛红霞等,2010)。植物提取物产生的次生代谢产物,如皂甙和单宁具有抗菌作用(王静,2014)。植物精油对动物的有益作用包括提高采食量,促进肠道消化酶的分泌,激活免疫系统及抑制病原菌等(Wenk,2003)。Cho等(2006)已证明日粮中添加0.03%植物精油可以达到与抗生素同样的抑菌作用,提高氮的消化率,降低粪便氨气排放。许多植物所含的挥发性成分具有独特的香味和抗菌作用,曾被人们用于香料抑制细菌生长(Hirasa和Takemasa,1998)。但精油成分的抗菌作用具有选择性,根据其成分变化而变化(Demetzos等,1997)。有相关研究尝试降低日粮蛋白水平,研究氮和氨气的排泄量,但这种方法对生长育肥猪有效,对断奶仔猪并无显著效果,因为断奶仔猪的粪尿排泄量非常少(van Zeeland等,2000)。目前关于精油和有机酸在断奶仔猪上的应用研究报道较少。因此,本试验在日粮中添加苯甲酸和精油研究其对断奶仔猪生长性能、养分利用率、血液指标及粪便有害气体含量的影响,为断奶仔猪日粮中降低或替代抗生素提供理论依据。
1 材料与方法
1.1 试验日粮及分组 选择健康、体重一致的(21±1)d杜洛克×长白×大白断奶仔猪(5.87±0.47)kg 900头,随机分为 5组,每组 6个重复,每个重复30头猪。试验设计5种日粮,对照组饲喂基础日粮,处理1、2、3和4组分别在基础日粮中添加45 mg/kg泰乐菌素、0.1%精油、0.3%苯甲酸和0.05%精油+22.5 mg/kg泰乐菌素。试验分1~14 d和15~42 d两阶段进行,基础日粮组成及营养水平见表1。
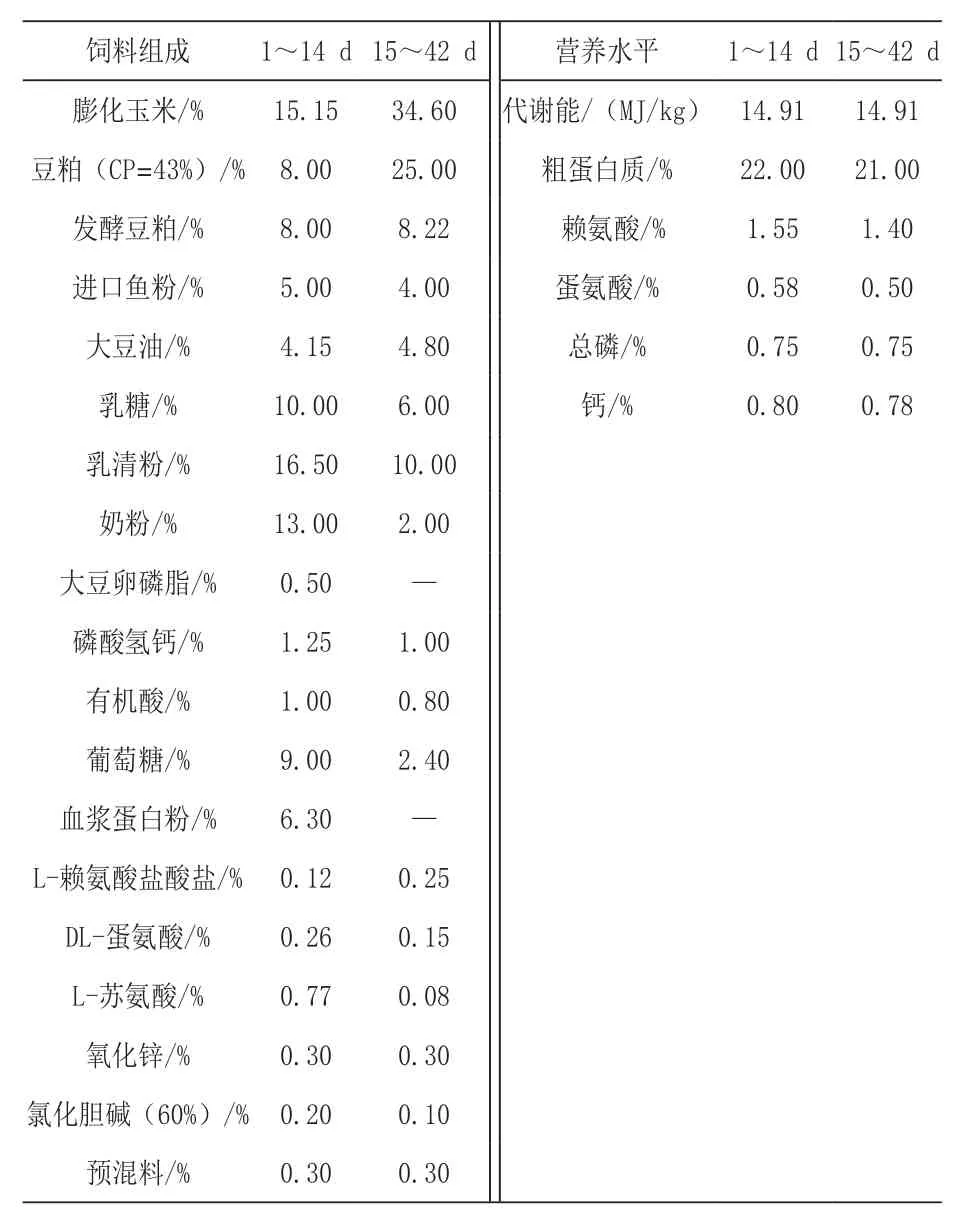
表1 基础日粮组成及营养水平
1.2 饲养管理 断奶仔猪大圈饲喂,每圈30头,猪只自由饮水和采食,室温控制在(32±1)℃,之后每周降低1℃,直至温度控制在26℃,采用自然光照和人工光照相结合,光照时间为16 h(30 lx)。试验时间为42 d。
1.3 测定指标
1.3.1 生长性能 试验期间每天观察仔猪的健康状态,每周按重复统计采食量,在试验当天、14 d和42 d清晨对试验猪只按重复进行称重,记录期末体重,计算各组猪只1~14、15~42 d及1~42 d平均日采食量、平均日增重和增重耗料比。每天观察仔猪的腹泻情况,记录腹泻猪只头数,参考Sherman等(1983)研究方法对仔猪粪便进行评分。
1.3.2 养分消化率 在试验第14、28和42天收集仔猪粪样,在收集粪样前日粮中添加0.2%三氧化二铬作为指示剂,参考Landero等(2011)的研究方法测定干物质、氮和总能的表观消化率。
1.3.3 血液指标 在试验当天、14、28 d和42 d每个重复随机选择5头猪,颈静脉采血,收集于抗凝管中,收集血细胞,采用全自动血细胞分析仪(ADVIA 2120,Bayer)测定红细胞、白细胞及淋巴细胞的数量。血清总IgG含量采用南京建成生物工程研究所的试剂盒进行测定。
1.3.4 粪中有害气体及细菌含量 参考Upadhaya等(2016)研究方法测定粪中氨气和硫醇化物的含量。
1.4 数据统计与分析 采用SPSS(19.0版)单因子方差分析进行分析,各组均值采用Tukey’s多重比较进行差异显著性检验,以P<0.05作为差异显著性标准。
2 结果与分析
2.1 日粮添加苯甲酸和精油对断奶仔猪生长性能的影响 由表2可知,处理3组对断奶仔猪1~14 d平均日增重的影响显著高于对照组和处理2组(P<0.05),但对照组与处理1组、处理2组、和处理4组对断奶仔猪平均日增重无显著影响(P>0.05)。各组对断奶仔猪平均日采食量和饲料报酬的影响均无显著差异(P>0.05)。
2.2 日粮添加苯甲酸和精油对断奶仔猪营养物质消化率的影响 由表3可知,处理3组断奶仔猪14 d干物质和氮的消化率显著高于对照组和处理2组(P<0.05),其中处理3组干物质和氮的消化率最高,对照组干物质和氮的消化率最低。处理1组、处理3组和处理4组较对照组和处理2组总能消化率显著提高(P<0.05)。处理3组较其他各组显著提高了断奶仔猪28 d干物质和总能消化率(P<0.05),较对照组、处理1组和处理3组显著提高了氮的消化率(P<0.05)。与处理3组和处理4组相比,处理2组断奶仔猪42 d干物质消化率显著降低(P<0.05),各组断奶仔猪42 d氮和总能消化率无显著差异(P>0.05)。
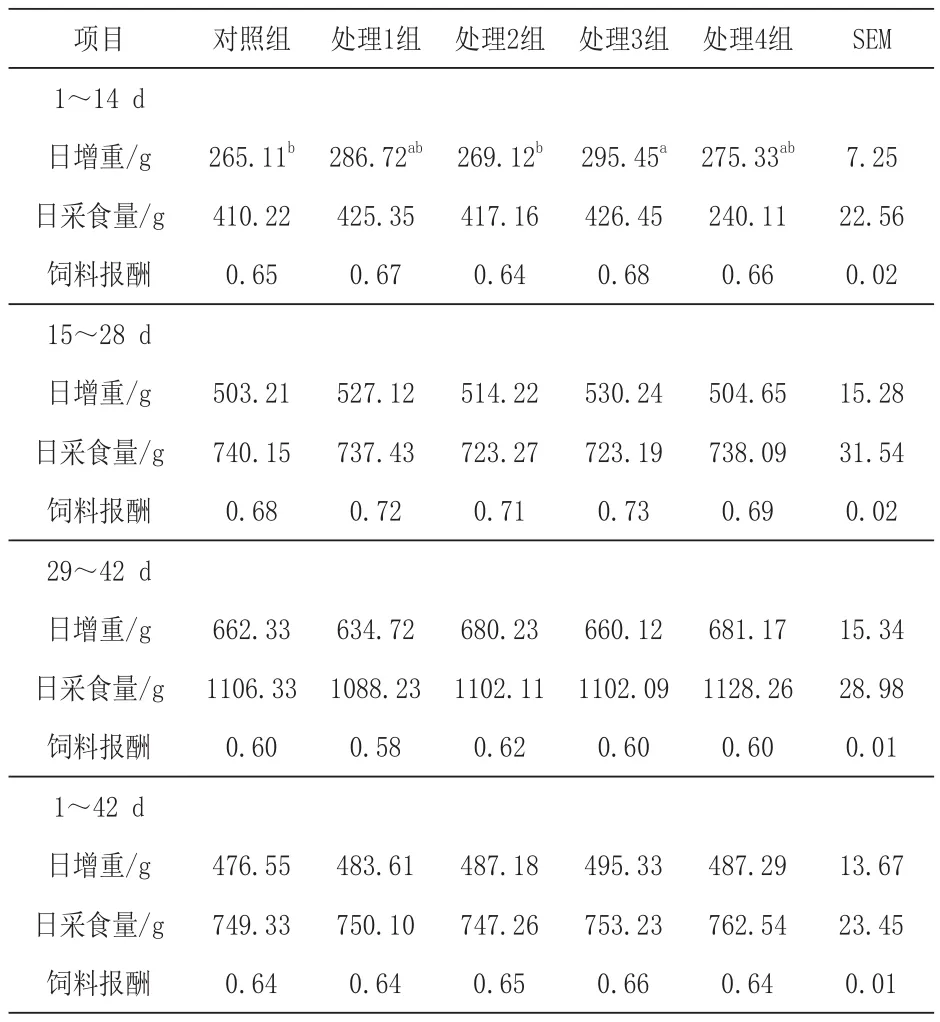
表2 日粮添加苯甲酸和精油对断奶仔猪生长性能的影响
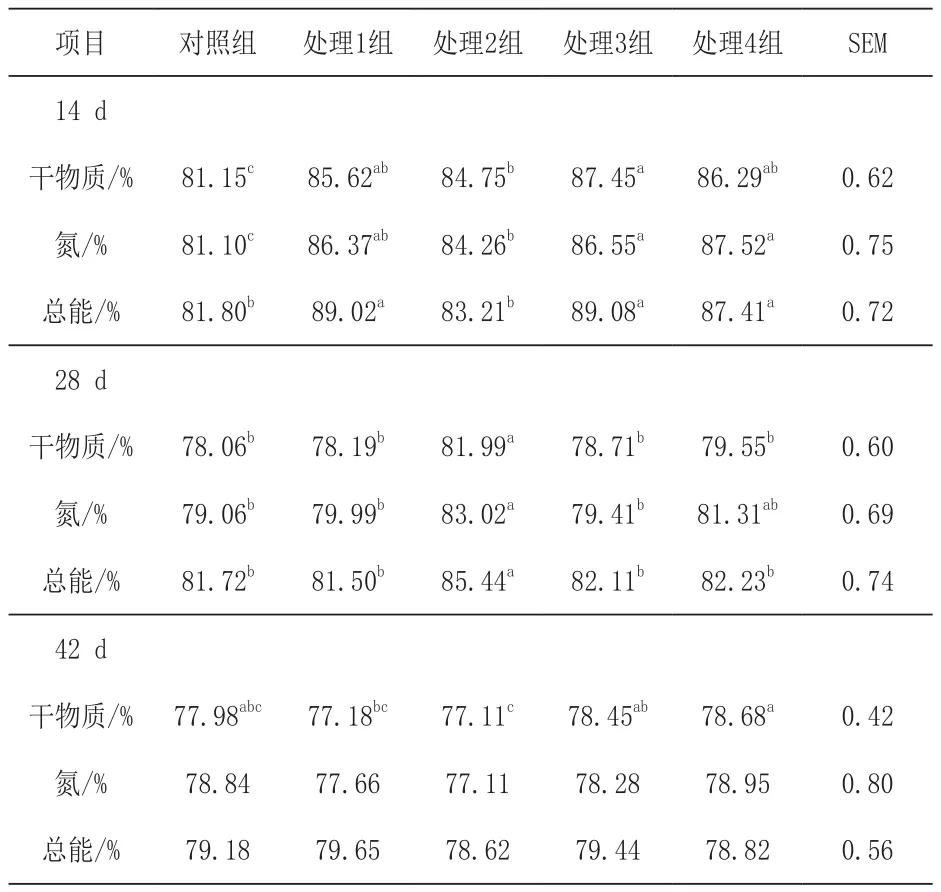
表3 日粮添加苯甲酸和精油对断奶仔猪营养物质消化率的影响
2.3 日粮添加苯甲酸和精油对断奶仔猪血液指标的影响 由表4可知,日粮添加苯甲酸和精油对断奶仔猪各阶段红细胞数量的影响无显著差异(P>0.05)。处理2组和处理4组较处理1组和处理3组显著提高了断奶仔猪14 d白细胞数量(P<0.05)。与对照组相比,处理2组断奶仔猪14 d淋巴细胞数量显著降低23.3%(P<0.05),而处理4组断奶仔猪42 d淋巴细胞数量显著提高29.2%(P<0.05);处理4组断奶仔猪14 d IgG数量显著降低25.8%(P<0.05)。

表4 日粮添加苯甲酸和精油对断奶仔猪血液指标的影响
2.4 日粮添加苯甲酸和精油对断奶仔猪粪便pH和有害气体含量的影响 由表5可知,处理1组较其他各组显著提高断奶仔猪粪便pH(P<0.05),而处理3组和处理4组较其他各组粪便pH显著最低(P<0.05)。处理1组较处理2组、处理3组和处理4组显著提高了粪便氨气含量(P<0.05)。各组间对粪便硫醇化物含量的影响无显著差异(P>0.05)。
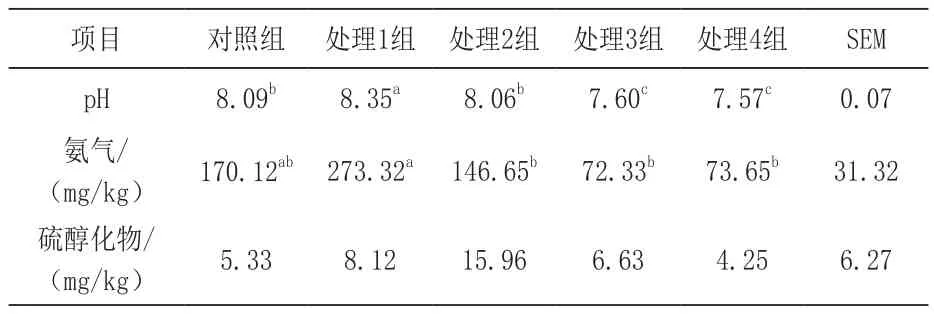
表5 日粮添加苯甲酸和精油对断奶仔猪粪便pH和其他有害气体含量的影响
2.5 日粮添加苯甲酸和精油对断奶仔猪腹泻率和腹泻评分的影响 由表6可知,各组间腹泻率和腹泻评分均无显著差异(P>0.05)。但整个试验1~7 d,处理3组腹泻率和腹泻评分均低于对照组和处理4组,但差异不显著(P>0.05)。
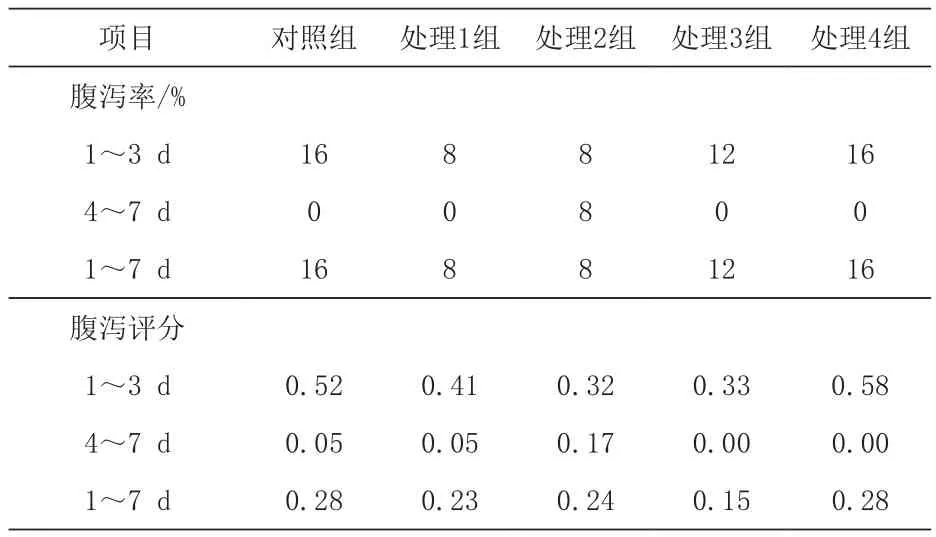
表6 日粮添加苯甲酸和精油对断奶仔猪腹泻率和腹泻评分的影响
3 讨论
3.1 日粮添加苯甲酸和精油对断奶仔猪生长性能的影响 本试验结果发现,日粮添加0.3%苯甲酸较对照组和0.1%精油组显著提高了断奶仔猪1~14 d平均日增重,但各组对断奶仔猪平均日采食量和饲料报酬均无显著影响。Hong等(2014)研究同样发现,日粮添加植物提取物仅影响断奶仔猪平均日增重。Holden和Mckean(2002)也报道,日粮添加植物提取物对断奶仔猪日增重的影响与抗生素组一致。
3.2 日粮添加苯甲酸和精油对断奶仔猪营养物质消化率的影响 Kamel(2001)研究发现,日粮添加精油可以介导肠道消化酶的分泌,从而提高氮的消化率,这与本试验研究结果一致。日粮添加精油对断奶仔猪各阶段干物质的影响存在差异,因为仔猪断奶后,其肠道微生物区系还未完全建立,精油具有杀菌功能,影响肠道微生物的增殖,进而影响干物质消化率。本研究结果发现,日粮添加苯甲酸和精油显著影响断奶仔猪14 d和28 d能量消化率,但其具体作用机制还有待进一步研究。
3.3 日粮添加苯甲酸和精油对断奶仔猪血液指标的影响 本研究结果发现,抗生素组和苯甲酸组较对照组和精油皂显著提高了断奶仔猪14 d白细胞数量,各组对红细胞数量的影响无显著差异。前人研究结果表明,日粮添加植物提取物对血液红细胞数量无显著影响,但植物提取物组较抗生素组显著提高了白细胞数量(Hong等,2014;Lien等,2006),这与本研究结果一致。
3.4 日粮添加苯甲酸和精油对断奶仔猪粪便pH和有害气体含量的影响 本研究结果发现,与对照组相比,日粮添加苯甲酸和精油对粪便氨气含量无显著影响。Cho等(2006)研究发现,日粮添加精油可以降低粪便氨气含量,粪便pH升高导致氨气含量提高,但氨气的产生不仅与pH有关,其还与粪便氨氮盐的浓度有关,这与本试验研究结果一致。苯甲酸是一种有机酸,是导致处理3组pH显著低于对照组、处理1组和处理2组的主要原因,但本试验结果发现,处理3组粪便低pH并未导致其粪便氨气含量显著低于对照组,其原因还有待进一步研究。
3.5 日粮添加苯甲酸和精油对断奶仔猪腹泻率的影响 仔猪断奶后1~3 d,各组猪只腹泻率分别为16%、8%、8%、12%和16%,腹泻评分分别为0.52、0.41、0.32、0.33 和 0.58,尽管各组对断奶仔猪腹泻率和腹泻评分的影响无显著差异,但0.3%苯甲酸组猪只腹泻率和腹泻评分均表现为最低。Kiene和Hines(1995)报道精油和有机酸是替代抗生素对控制断奶仔猪腹泻的有效手段。
4 结论
日粮添加苯甲酸和精油可以提高断奶仔猪平均日增重,促进营养物质消化率。苯甲酸和精油对断奶仔猪采食量和饲料报酬的影响与抗生素一致。
[1]毛红霞,武书庚,张海军,等.植物提取物在动物生产中的应用进展[J].中国畜牧兽医,2010,37:24~29.
[2]王静.多酚类抗菌活性的研究[J].山东食品发酵,2014,2:32~35.
[3]Cho J H,Chen Y J,Min B J et al. Effect of essential oils supplementation on growth performance,IgG concentration and fecal noxious concentration of weaned pig[J].Asian-Aust J Anim Sci,2006,19:2607~2611.
[4]Demetzos C,Katerinopoulos H,Kouvarakis A et al.Composition,antimicrobial activity of essential oil of Cistus creticus subsp. eriocephalus[J]. Planta Med,1997,63:477~ 479.
[5]Hirasa K,Takemasa M. Spice science technology [M]. Marcel Dekker Inc.,New York,USA,1998.
[6]Holden P J,McKean J D. Botanicals for nursery pigs[J]. Anim Sci,2002,80:41.
[7]Hong J W,Kim I H,Kwon O S et al. Influences of plant extract supplementation on performance and blood characteristics in weaned pigs[J].AsianAust J Anim Sci,2014,17:374 ~ 378.
[8]Kamel C. Tracing modes of action and the roles of plant extracts in non-ruminants [M].Recent advances in animal nutrition. Nottingham University Press,Nottingham,2001.
[9]Kiene R P and Hines M E. Microbial formation of dimethyl sulfide in anoxic sphagnum peat[J]. Appl Envir Microbiol,1995,61 :2720~2726.
[10]Landero J L,Beltranena E,Cervantes M et al. The effect of feeding solvent-extracted canola meal on growth performance and diet nutrient digestibility in weaned pigs[J].Anim Feed Sci Technol,2011,170:136~ 140.
[11]Sherman D M,Acres S D,Sadowski P L et al. Protection of calves against fatal enteric colibacillosis by orally administered Escherichia coli K99-specific monoclonal antibody[J]. Infect Immun,1983,42:653~ 658.
[12]Upadhaya S D,Lee K Y,Kim I H. Effect of protected organic acid blends on growth performance,nutrient digestibility and faecal micro flora in growing pigs[J].Appl Anim Res,2016,44:238~ 242.
[13]van Zeeland A,den Brock G M,van Asseldonk M. Ammonia emission of large groups of weaned piglets on a floor area of 0.4 m2per piglet. In:Research Reports 1999. Research Institute for Pig Husbandry Rosmalen,The Netherlands. pp. 3
[14]Wenk C. Herbs and botanicals as feed additives in monogastric animals[J].Asian-Aust J Anim Sci,2003,16 :282~ 289.

