N-乙酰半胱氨酸对热应激条件下肉仔鸡生长性能、肠道能量和抗氧化状态及空肠形态的影响
杨淑霞,线 萍,关樁慧
(1.西北民族大学化工学院,甘肃兰州 730020;2.甘肃省定西市临洮县水文局,甘肃定西 730515)
畜牧养殖业,尤其是家禽养殖正面临全球变暖的挑战。体温过高会导致家禽的高死亡率和生长抑制,使经济遭受巨大损失。禽类由于没有汗腺,在热应激下采食时间降低,饮水、喘气和煽动翅膀的时间升高,以此方式来进行机体散热(Lara和 Rostagno,2013)。此外,生理和代谢反应,如改变血液参数,血浆激素浓度,高温条件下的家禽也存在氧化应激和肉类酸度(Loyau等,2015)。热应激会引起肠道功能障碍,如肠黏膜损伤,肠壁通透性升高,消化吸收功能、免疫能力下降等(Lambert等,2002)。生产上通常使用降温设备来减少热应激,而从营养角度则可以通过提高饲料养分浓度,采用氨基酸平衡日粮,维持电解质平衡等(Ahmad等,2008)。有研究表明,N-乙酰半胱氨酸可以提高肉鸡的抗热能力,从而提高生长性能(Hou等,2013)。N-乙酰半胱氨酸可被小肠快速代谢产生还原型谷胱甘肽,但在没有外源添加的情况下,在动物机体内并不能检测到(Wu等,2004)。有研究报道日粮添加N-乙酰半胱氨酸可以提高脂多糖诱导的仔猪的采食量,降低脂多糖对肠道的损伤(Hou等,2013)。到目前为止,关于N-乙酰半胱氨酸对肉鸡的报道主要集中在对黄曲霉B1毒素对肉鸡生长性能的改善作用(Valdivia等,2001)。因此,本试验在舍内模拟夏季热应激,考察日粮添加N-乙酰半胱氨酸对肉鸡生长性能、肠道能量和抗氧化状态、空肠形态及消化酶活力的影响,为家禽养殖业解决热应激问题提供新思路。
1 材料与方法
1.1 试验材料 试验用N-乙酰半胱氨酸购自国药(上海)化学试剂有限公司。
1.2 试验日粮与分组 选取健康、体重一致的1 d雌性AA商品代肉仔鸡720只,随机分为4组,每组6个重复,每个重复30羽。试验日粮采用2(常温和热应激)×2(基础日粮和基础日粮+0.1%N-乙酰半胱氨酸),对照组饲喂玉米-豆粕型基础日粮,试验组在基础日粮中添加0.1%N-乙酰半胱氨酸,1~21 d和22~35 d基础日粮组成及营养水平见表1。
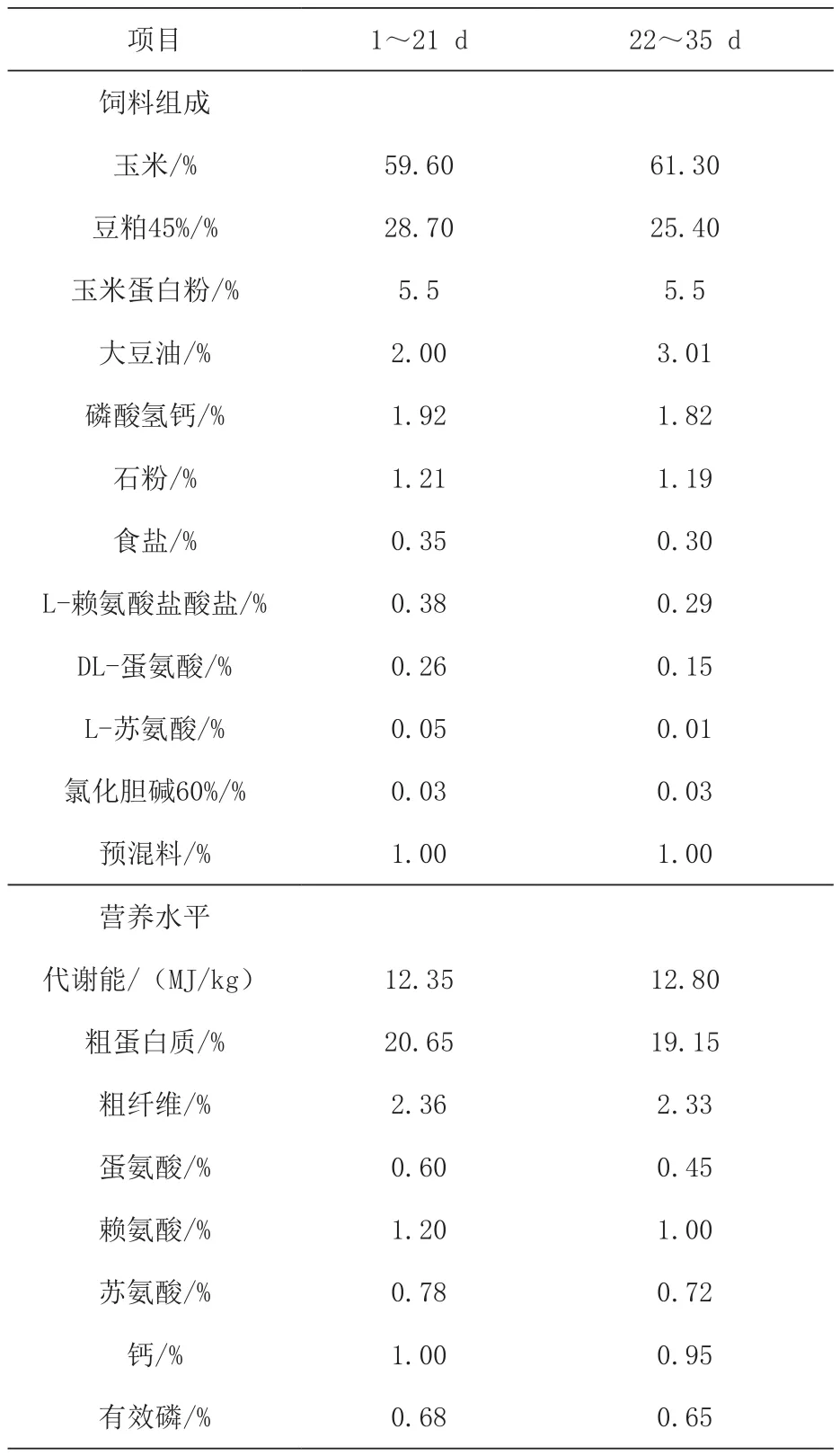
表1 基础日粮组成及营养水平(风干基础)
1.3 饲养管理 鸡只采用网上平养,用保温灯进行室内升温,鸡舍第一周温度控制在35℃左右,之后每周对照组鸡舍将温度下调2℃,直至温度控制在25℃,而试验组一致保持在35℃。光照采用自然光照和人工光照结合,光照强度控制在30 lx。试验鸡只全期自有采食、饮水,每天清粪一次,按照商品肉鸡常规程序进行免疫和消毒。饲养试验时间为35 d。
1.4 测定指标
1.4.1 生长性能 试验期间按重复记录采食量,记录期末体重,计算各重复鸡只平均日采食量、平均日增重和料重比。
1.4.2 肉鸡能量和抗氧化状态的测定 试验结束时,每组选择12只鸡进行屠宰。收集空肠肠段,收集黏膜,采用试剂盒法测定黏膜三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、一磷酸腺苷(AMP)、腺苷酸能荷(AEC)、腺苷酸总磷(TAN)、超氧化物歧化酶(SOD)、总抗氧化力(T-AOC)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)的活力、丙二醛(MDA)和双氧水含量,试剂盒购自南京建成生物工程研究所。
1.4.3 血清激素水平 鸡只翅下静脉采血5 mL用于分离血清,样品采用试剂盒法测定血清三碘甲腺原氨酸(T3)、甲状腺素(T4)及皮质醇的含量,试剂盒购自南京建成生物工程研究所。
1.4.4 绒毛形态及相关基因表达 参考Hu等(2013)研究方法测定空肠绒毛形态。采用荧光定量PCR法检测空肠黏膜热休克蛋白70、细胞凋亡蛋白酶3、AMPK、腺嘌呤核苷酸转运载体、血红素氧化酶和黄嘌呤氧化酶的mRNA相对表达量。采用2-ΔΔCt法,以β-actin基因作为内参计算各基因的相对表达量。相关基因的引物设计参考Hou等(2013)研究方法。
1.5 数据统计与分析 试验数据采用SPSS(18.0版)进行多因素方差分析,采用Turkey检验进行差异显著性检验,以P<0.05作为差异显著的标准。
2 结果与分析
2.1 日粮添加N-乙酰半胱氨酸对热应激肉鸡生长性能的影响 由表2可知,热应激显著降低了肉鸡平均日采食量和平均日增重(P<0.05)。与基础日粮组相比,日粮添加N-乙酰半胱氨酸显著体高了肉鸡平均日采食量和平均日增重(P<0.05)。日粮和热应激对肉鸡料重比存在显著的交互作用(P<0.05)。
2.2 日粮添加N-乙酰半胱氨酸对热应激肉鸡肠道能量状态和抗氧化性能的影响 由表3可知,热应激显著降低了肉鸡ATP和AEC的含量(P<0.05),显著提高了空肠黏膜AMP的含量(P<0.05)。日粮添加N-乙酰半胱氨酸提高了ATP和TAN的含量,但与基础日粮组无显著差异(P>0.05)。日粮和温度对空肠AMP含量的影响存在显著的交互效应(P<0.05)。热应激显著降低了空肠SOD、GSH-Px、CAT的水平(P<0.05),但添加N-乙酰半胱氨酸后显著降低了MDA含量(P<0.05)。
2.3 日粮添加N-乙酰半胱氨酸对热应激肉鸡肠道能量状态和抗氧化性能的影响 由表4可知,热应激显著提高了肉鸡血清皮质醇的含量(P<0.05),同时显著降低了血清T3、T4的水平(P<0.05)。日粮添加N-乙酰半胱氨酸对血清T3、T4水平无显著影响(P>0.05),但较基础日粮组显著降低了血清皮质醇含量(P<0.05)。日粮类型和温度对肉鸡血清激素水平的影响无显著的交互作用(P>0.05)。
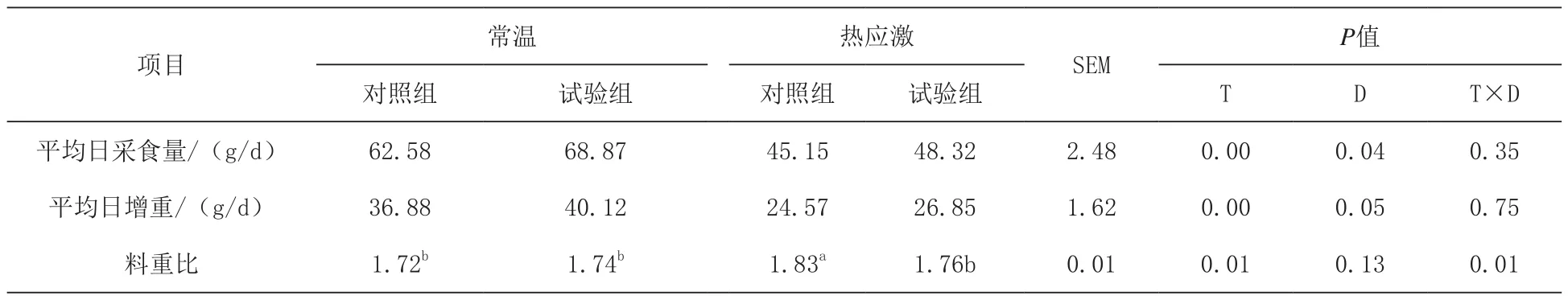
表2 日粮添加N-乙酰半胱氨酸对热应激肉鸡生长性能的影响
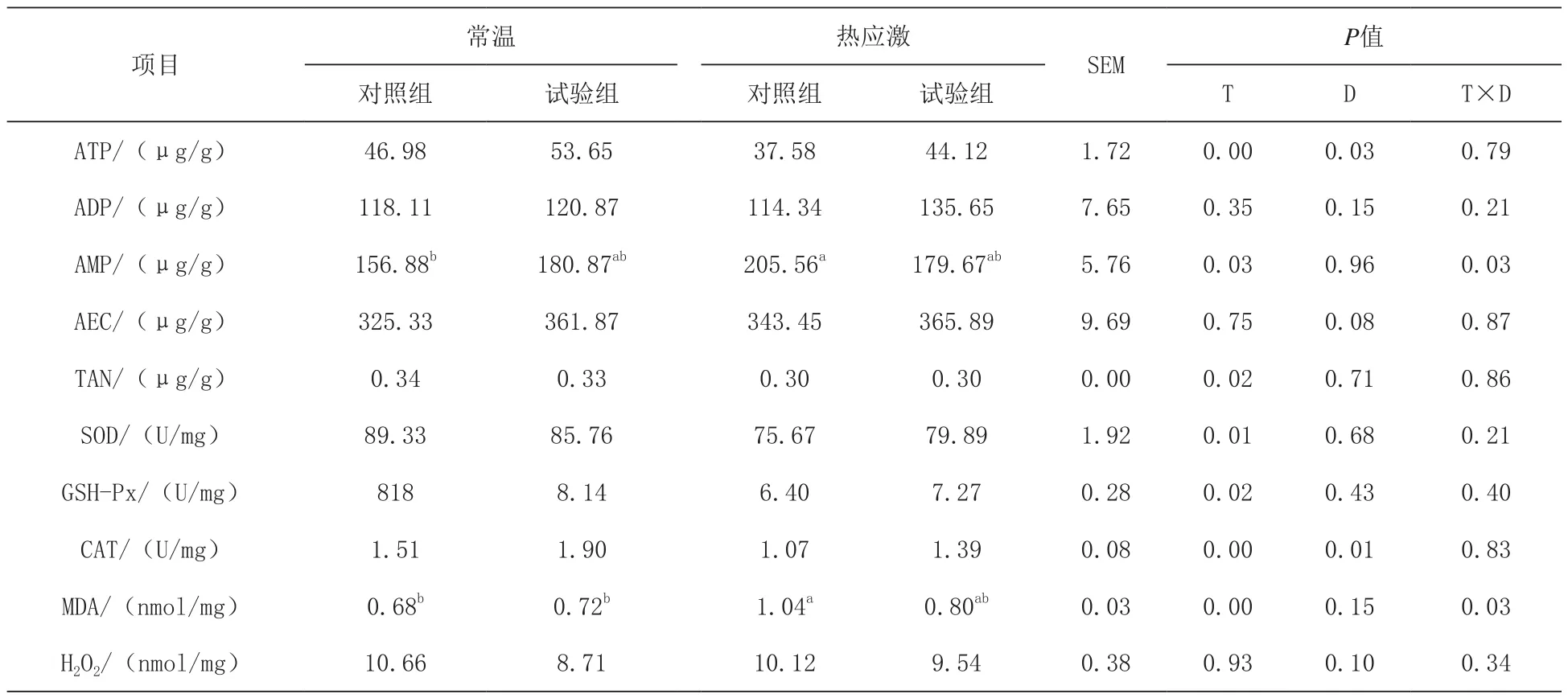
表3 日粮添加N-乙酰半胱氨酸对热应激肉鸡空肠能量和抗氧化的影响
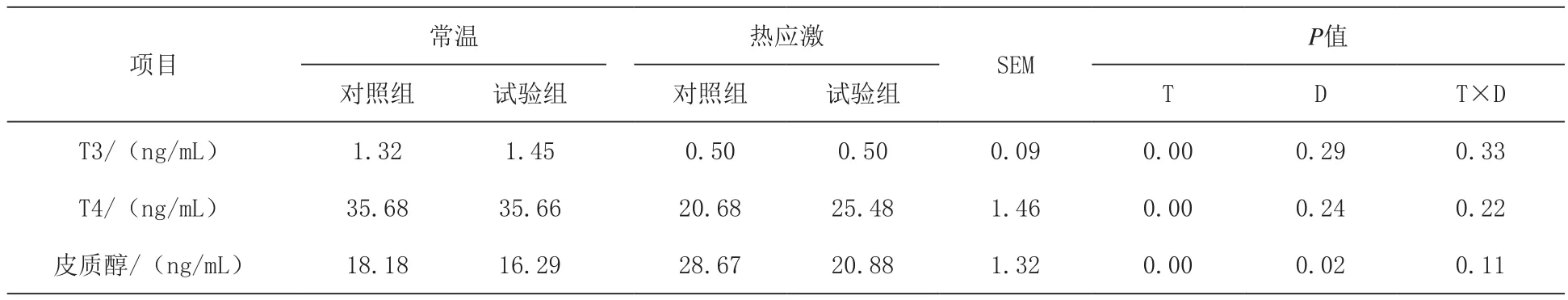
表4 日粮添加N-乙酰半胱氨酸对热应激肉鸡血清激素水平的影响
2.4 日粮添加N-乙酰半胱氨酸对热应激肉鸡空肠形态和消化酶水平的影响 由表5可知,热应激显著降低了绒毛高度与隐窝深度比值,显著提高了隐窝深度(P<0.05)。日粮添加N-乙酰半胱氨酸较基础日粮组显著提高了绒毛高度与隐窝深度比值(P<0.05)。日粮和温度对绒毛高度的影响具有交互作用的趋势(P=0.07)。热应激显著降低了肉鸡空肠AKP、脂肪酶和胰蛋白酶含量(P<0.05),但日粮添加N-乙酰半胱氨酸显著提高了胰蛋白酶的含量(P<0.05)。
2.5 日粮添加N-乙酰半胱氨酸对热应激肉鸡空肠相关基因表达的影响 由表6可知,热应激显著降低了B淋巴细胞的mRNA相对表达水平(P<0.05),显著提高了细胞凋亡蛋白酶3 mRNA相对表达水平(P<0.05)。日粮添加N-乙酰半胱氨酸显著提高了B淋巴细胞mRNA相对表达水平(P<0.05)。日粮和温度对热休克蛋白70和血红素氧化酶mRNA相对表达水平的影响具有显著的交互作用(P<0.05)。热应激条件下日粮添加N-乙酰半胱氨酸降低了热休克蛋白70和血红素氧化酶mRNA相对表达水平(P< 0.05)。
3 讨论
3.1 日粮添加N-乙酰半胱氨酸对热应激肉鸡生长性能的影响 本试验结果表明,热应激对肉鸡生长性能和肠功能有不良影响,这与Garriga等(2006)研究结果一致。防止家禽热应激的方法有添加膳食纤维、脂肪、维生素C及维持日粮氨基酸和电解质平衡。考虑到N-乙酰半胱氨酸对仔猪生长和肠道的有益作用(Hou等,2013),本研究将其应用到了热应激条件下肉鸡的试验中,旨在为解决家禽热应激提供新的手段。
3.2 日粮添加N-乙酰半胱氨酸对热应激肉鸡血清激素水平的影响 众所周知,高温条件增加下丘脑-垂体-肾上腺轴活动,从而增加皮质酮水平。这些内分泌变化是由慢性热应激引起的,导致动物的生产性能下降,并将营养代谢重新分配到脂质脂肪生成和蛋白水解(Lin等,2006)。在本研究中,日粮添加N-乙酰半胱氨酸降低了血清皮质醇浓度。有报道称N-乙酰半胱氨酸可以穿越血脑屏障,但是如何抑制皮质醇水平的机制还尚不清楚(Samuni等,2013)。
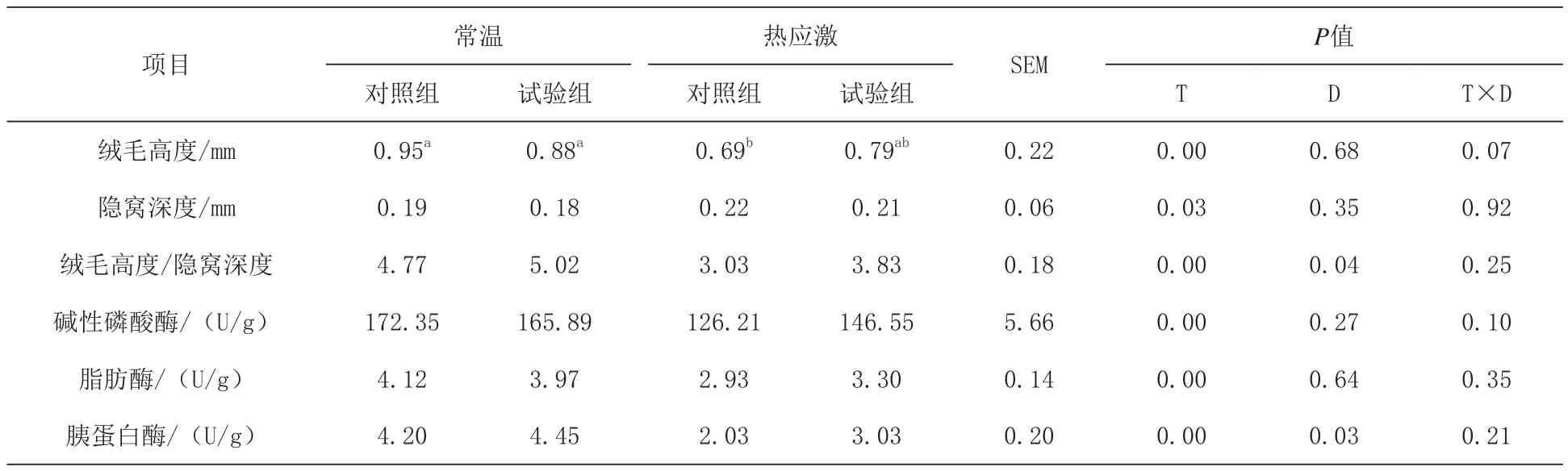
表5 日粮添加N-乙酰半胱氨酸对热应激肉鸡空肠形态和消化酶水平的影响

表6 日粮添加N-乙酰半胱氨酸对热应激肉鸡空肠相关基因表达的影响
3.3 日粮添加N-乙酰半胱氨酸对热应激肉鸡空肠能量和抗氧化状态的影响 本研究结果显示,热应激导致空肠ATP含量降低,AMP含量升高。ATP是组织能量状态的一个重要指标,此外本研究同样发现热应激导致能量电荷下降,但补充N-乙酰半胱氨酸后,ATP和TAN的浓度提高,说明N-乙酰半胱氨酸可以缓解热应激条件下肉鸡能量的损失。热应激使机体产生的大量氧自由基和相关的过氧化物会引起肠道氧化损失,如脂质过氧化及蛋白质和DNA损伤(Mujahid等,2007)。组织和细胞对氧化应激具有有防御机制,可以通过自由基清除剂来降低氧自由基,如SOD、CAT和GSH-Px,这些抗氧化酶可以协同将氧自由基转化为水和氧气(Wu等,2004)。本研究结果发现日粮添加N-乙酰半胱氨酸后显著降低了MDA含量,说明N-乙酰半胱氨酸可以提高空肠的抗氧化能力,这一结果也与补充N-乙酰半胱氨酸降低了热应激肉鸡空肠血红素氧化酶的mRNA表达水平有关,因为血红素氧化酶评判机体氧化损伤的重要指标(Osselaere等,2013)。
3.4 日粮添加N-乙酰半胱氨酸对热应激肉鸡空肠形态、消化酶和相关基因表达的影响 热应激会导致肠道绒毛-隐窝系统受损,绒毛高度下降,绒毛表面积减少(Quinteiro-Filho等,2010),这与本研究结果一致。此外,日粮添加N-乙酰半胱氨酸可以调控B淋巴细胞的mRNA表达水平,是肠细胞增殖的生物标志,因此,肠细胞的生长和增重可能与N-乙酰半胱氨酸调控有关。Wu等(2004)报道热应激会导致蛋白酶、脂肪酶和淀粉酶的活性下降,这与本试验研究结果一致。日粮添加N-乙酰半胱氨酸可以提高空肠胰蛋白酶的活性但对脂肪酶和AKP的活性物显著影响,作者推断胰蛋白酶活性的提高可能与N-乙酰半胱氨酸提高了肠道绒毛形态的完整性有关。
4 结论
日粮添加0.1%N-乙酰半胱氨酸可以提高热应激条件下肉鸡的生长性能,改善肠绒毛形态,提高消化酶含量,维持肠道能量和抗氧化状态。
[1]Ahmad T,Khalid T,Mushtaq T et al. Effect of potassium chloride supplementation in drinking water on broiler performance under heat stress conditions[J].Poult Sci,2008,87 :1276 ~ 1280.
[2]Garriga C,Hunter R R,Amat C et al. Heat stress increases apical glucose transport in the chicken jejunum[J]. Am J Physiol Regul Integr Comp Physiol,2006,290:195 ~ 201.
[3]Hou Y,Wang L,Yi D et al. N-acetylcysteine reduces inflammation in the small intestine by regulating redox,EGF and TLR4 signaling[J]. Amino Acids,2013,45:513 ~ 522.
[4]Hu Y,Ketabi A,Buchko A et al. Metabolism of isomaltooligosaccharides by Lactobacillus reuteri and bifidobacterial[J]. Lett Appl Microbiol,2013,108:108 ~ 114.
[5]Lambert G P,Gisolfi C V,Berg D J et al. Selected contribution:hyperthermia-induced intestinal permeabilityand the role of oxidative and nitrosative stress[J]. J Appl Physiol,2002,92:1750~ 1761.
[6]Lara L J,Rostagno M H. Impact of heat stress on poultry production[J]. Animals,2013,3 :356~ 369.
[7]Lin H,Sui S J,Jiao H C et al. Impaired development of broiler chickens by stress mimicked by corticosterone exposure[J]. Comp Biochem Physiol A Mol Integr Physiol,2006,143:400 ~ 405.
[8]Loyau T,Bedrani L,Berri C et al. Cyclic variations in incubation conditions induce adaptive responses to later heat exposure in chickens:a review[J]. Animal,2015,9:76~ 85.
[9]Mujahid A,Pumford N R,Bottje W et al.Mitochondrial oxidative damage in chicken skeletal muscle induced by acute heat stress[J]. J Poult Sci,2007,44 :439~445.
[10]Osselaere A,Santos R,Hautekiet V et al. Deoxynivalenol impairs hepatic and intestinal gene expression of selected oxidative stress,tight junction and inflammation proteins in broiler chickens,but addition of an adsorbing agent shifts the effects to the distal parts of the small intestine[J]. PLoS. One,2013,8 :e69014.
[11]Quinteiro-Filho W M,Ribeiro A,Ferraz-de-Paula V et al.Heat stress impairs performance parameters,induces intestinal injury,and decreases macrophage activity in broiler chickens[J]. Poult Sci,2010,89:1905~1914.
[12]Samuni Y,Goldstein S,Dean O M et al. The chemistry and biological activities of N-acetylcysteine[J]. Biochim Biophys Acta,2013,1830:4117~4129.
[13]Valdivia A G,Martínez A,Damián F J et al. Efficacy of N-acetylcysteine to reduce the effects of aflatoxin B1 intoxication in broiler chickens[J]. Poult Sci,2001,80 :727~ 734.
[14] Wu G,Fang Y Z,Yang S et al. Glutathione metabolism and its implications for health[J]. J Nutr,2004,134:489~ 492.

