猪瘟病毒NASBA-RT-LAMP快速检测方法的建立
杨平东,张明璀,曹立廷
(1.重庆荣昌高新技术产业开发区管委会,重庆 402460;2. 西南大学荣昌校区,重庆 402460)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的一种高度接触性传染病,在全球范围内造成了巨大经济损失[1],被世界动物卫生组织(OIE)列为必须上报的动物疫病。对其检测多年来一直是兽医界研究的重点。当前的CSFV实验室检测方法主要有:ELISA、细胞培养、RT-LAMP[2],以及以PCR技术为基础的RT-PCR、RT-nest-PCR、RT-FQ-PCR[4]等。本研究的思路来源于Fukuda等[3]2009年对诺如病毒检测方法的研究。由于CSFV基因组在总RNA提取过程中会大量损失,因此希望建立一个两步法反应,来扩增病毒RNA模板,提高检测灵敏度。首先利用核酸序列依赖性扩增技术(NASBA)可以大量扩增RNA的特点,来扩增病毒RNA模板,增加第二步反应中的模板含量,然后通过反转录环介导等温扩增技术(RT-LAMP)进一步扩增获得检测结果,从而建立一种NASBA和RT-LAMP技术相结合的两步法检测方法(NASBA-RT-LAMP),为CSF的临床快速诊断提供一种新思路。
1 材料与方法
1.1 毒株与试剂
CSFV毒株:重庆市畜牧科学院兽医研究所分离保存;dNTP、NTP:购自Promega公司;蛋白酶K、Taq酶:购自上海生工;T7 RNA聚合酶、RNase H和AMV和Bst DNA 聚合酶:购自NEB公司;DTT、Betaine(甜菜碱)、MgSO4:购自Sigma公司;RNA Marker RL1000、MiniBEST Viral RNA/DNA Extraction Kit Ver 4.0与Prime Script One Step RT-PCR Kit Ver 2.0 :购自TaKaRa公司;Nucleasefree water:购自Fermentas公司。
1.2 引物设计与合成
根据测序结果,利用Primer Explorer V4设计外引物和内引物。引物序列见表1。

表1 引物序列
1.3 NASBA-RT-LAMP方法的建立
使用RNA提取试剂盒(MiniBEST Viral RNA/DNA Extraction Kit Ver 4.0,TaKaRa) 提 取 模 板RNA,分别优化NASBA反应中的离子浓度、引物浓度、酶含量,确定最终反应体系为20 μL(表2)。反应程序:65 ℃加热5 min,41 ℃冷却5 min;迅速加入40 U T7 RNase,5 U AMV,0.5 U RnaseH,混匀,置于41 ℃反应90 min,-20 ℃终止反应。通过5%琼脂糖电泳鉴定反应结果。
RT-LAMP反应体系(20 μL)见表3。反应程序:65 ℃水浴锅中反应1 h。取5 μL反应产物用2%琼脂糖凝胶进行电泳分析。
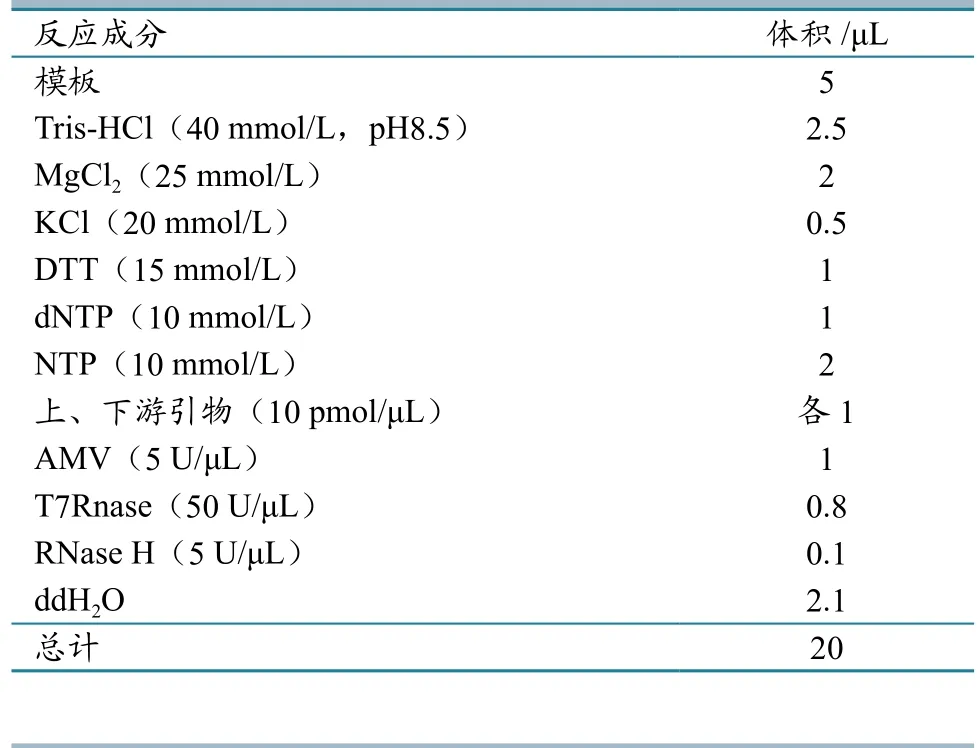
表2 NASBA反应体系

表3 RT-LAMP反应体系
1.4 NASBA-RT-LAMP特异性检测
使用建立的NASBA-RT-LAMP方法,对临床上常见的猪繁殖与呼吸综合征病毒(PRRSV)、乙型脑炎病毒(JEV)和CSFV进行检测。
1.5 NASBA-RT-LAMP、NASBA、LAMP与Nest-PCR灵敏度比较
以TakaRa公司提供的高纯度单链RNA片段(200 ng/μL)为标准对照,取2 μL提取的RNA模板,使用Eppendprf 6131 Biophotometer的Traycell超微量核酸检测模块测定RNA含量,用无酶水(Nuclease-free water,Fermentas)做10倍梯度稀释,分别进行NASBA-RT-LAMP、NASBA、RT-LAMP与RT-Nest-PCR反应。
2 结果
2.1 NASBA-RT-LAMP方法电泳
通过5%的琼脂糖电泳后,在900 bp处可见清晰的RNA条带(图1),说明第一步NASBA反应获得成功;然后通过2%的琼脂糖电泳,可见十分清晰的梯形条带(图2),说明整个NASBART-LAMP反应是可行的。

图1 NASBA反应的电泳图

图2 NASBA-RT-LAMP反应电泳图
2.2 NASBA-RT-LAMP特异性检测
分别用临床上常见的PRRSV、JEV和CSFV为模板,在相同条件下同时进行扩增。经琼脂糖电泳检测表明,只有以CSFV为模板,才能扩增出清晰的梯形条带,而以PRRSV和JEV为模板,不能扩增出条带,表明此方法对CSFV有很强的特异性。NASBA-RT-LAMP的特异性检测琼脂糖凝胶电泳图像见图3。
2.3 4种检测方法的灵敏度比较
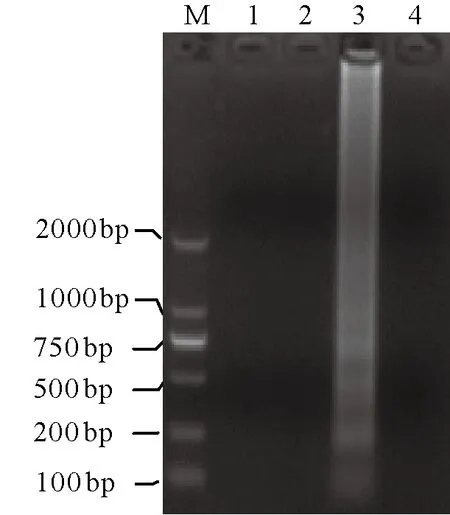
图3 NASBA-RT-LAMP反应的特异性检测
比较结果显示:NASBA与RT-LAMP的最小检测浓度都为 460 pg/μL;NASBA-RT-LAMP 与RT-Nest-PCR的检测灵敏度相近,都为46 pg/μL;不过NASBA-RT-LAMP在模板浓度从460 ng/μL到46 pg/μL变化过程中,扩增条带的亮度都十分清晰(图4),而RT-Nest-PCR扩增条带却逐渐减弱,在模板浓度46 pg/μL时已非常模糊。4种检测方法的灵敏度比较结果见表4。
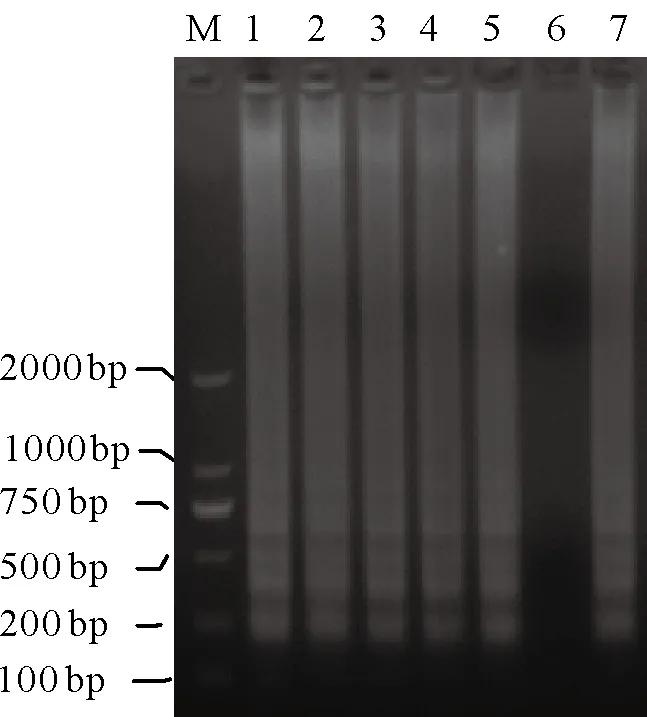
图4 NASBA-RT-LAMP反应灵敏度的检测
3 分析与讨论
本试验结合NASBA与RT-LAMP技术,探索建立了一种两步法检测方法,整个反应只需要恒温水浴锅即可完成。在反应过程中首先通过NASBA技术提高病毒RNA模板含量,然后进行RT-LAMP反应,最后通过琼脂糖电泳方式来验证反应结果。这样既解决了NASBA反应产物容易降解,不易电泳观察的问题,也使RT-LAMP反应的模板量增加,让RT-LAMP反应结果更加清晰、准确。

表4 4种检测方法灵敏度比较
此方法的敏感性与RT-nest-PCR相当,最小检测量为46 pg/μL,与朱俊灵等[5]将LAMP技术和横向流动试纸条技术(LFD)相结合建立的RTLAMP-LFD的灵敏度相当,但低于Das等[6]建立的针对CSFV的荧光定量RT-PCR方法。根据检测灵敏度结果分析发现,NASBA-RT-LAMP反应对CSFV检测的敏感性取决于NASBA反应的敏感性,当模板浓度在46 pg/μL时,NASBA与RT-LAMP反应通过琼脂糖电泳检测不到目的条带。这有可能是因RNA扩增量太低,不能通过电泳检测到。而NASBA-RT-LAMP反应,由于对NASBA反应得到的RNA模板进一步扩增,所以在模板浓度为46 pg/μL时仍能得到非常清晰的梯形条带。此方法
在反应过程中不需要特别贵重的设备,从而为基层
CSFV检测提供了一种新选择。
[1] MOENNIG V. Introduction to classical swine fever:virus,disease and control policy[J].Veterinary microbiology,2000,73(2):93-102.
[2] CHEN L,FAN X Z,WANG Q,et al. A novel RTLAMP assay for rapid and simple detection of classical swine fever virus[J]. Virologica sinica,2010,25(1):59-64.
[3] FUKUDA S,SASAKI Y,SENO M. Rapid and sensitive detection of norovirus genomes in oysters by a twostep isothermal amplification assay system combining nucleic acid sequence-based amplification and reverse transcription-loop-mediated isothermal amplification assays[J]. Applied & environmental microbiology,2008,74(12):3912-3914.
[4] RISATTI G R,CALLAHAN J D,NELSON W M,et al. Rapid detection of classical swine fever virus by a portable real-time reverse transcriptase PCR assay[J].Journal of clinical microbiology,2003,41(1):500-505.
[5] 朱俊灵,叶佐东,邓洁汝,等. 猪瘟病毒RT-LAMPLFD检测方法的建立与应用[J]. 华南农业大学学报,2016(1):1-7.
[6] DAS A,BECKHAM T R,MCINTOSH M T.Comparison of methods for improved RNA extraction from blood for early detection of classical swine fever virus by real-time reverse transcription polymerase chain reaction[J]. Journal of veterinary diagnostic investigation,2011,23(4):727-735.

