16S rDNA 克隆文库法分析油藏细菌群落结构多样性
万真真
(安庆师范大学资源环境学院,安徽安庆246133)
大港油田拥有中国东部石油“小摇篮”的美誉,其地层结构复杂,长期采用水驱法开采,是典型的水驱“半开放”循环系统。经过40余年的水驱开采,部分油井石油含水率高达95%以上,这将导致石油开采成本加大[1]。如何实现包括高含水油藏、低渗透和稠油等低品位油气资源的可持续开采已成为石油开采行业的瓶颈问题。微生物驱油技术的发展为解决贫油层或即将采空油层开采效率低的科学难题提供了可能。油藏微生物具有产表面活性剂、产气和降解石蜡等功能,这些特性可降低原油粘度并增加原油流动性,有利于石油开采[2]。研究极端油藏环境的微生物群落结构,认识油藏微生物功能多样性,有利于对油藏功能微生物群落进行系统调控。16S rDNA克隆文库技术不仅能有效克服传统微生物培养方法工作量大、耗时长、微生物信息量少等不足,而且突破了微生物培养技术的限制,能够从基因水平上分析对象的微生物群落结构多样性,具有广泛的应用前景[3]。本文将运用16S rDNA克隆文库技术对油田产出水中的微生物功能菌群多样性进行系统分析,以期为贫油或枯竭油藏的微生物驱油技术的开发提供有参考价值的微生物学信息。
1 材料与方法
1.1 大港油田样品中细菌总DNA提取
取石油产出水500 mL,用真空泵抽滤过滤膜;将滤膜用灭菌的剪刀剪碎,放入Lysing matrix E管(Fast DNA-Spinkit,MPBIO)中;然后加入978µL磷酸盐缓冲液,并额外添加20µL PolyA(200µg Poly-adenylic acid),促进DNA与Lysing matrix E管中的滤膜结合,提高DNA提取率;再依次按照Fast DNA-Spinkit说明提取产出水总DNA;最后利用NanoDrop ND-1000(ThermoFisher,USA)检测产出水中DNA含量。
1.2 16S rDNA基因PCR扩增
利用总DNA作为细菌16S rRNA克隆文库构建的PCR扩增模板,选择细菌16S rDNA序列通用引物对样本进行PCR扩增。序列引物为:5’-GAGTTTGATCCTGGCTCA-3’和 5’-TACGGYTACCTTGTTACGACTT-3’。PCR反应条件为95℃预变性5 min,94℃变性30 s,52℃退火30 s和72℃延伸2 min,共35个循环,最后在72℃下延伸7 min。利用1.2%琼脂糖凝胶检测其扩增特异性,并利用琼脂糖凝胶回收纯化试剂盒(Qiagen,Germany)对扩增的目标片段进行切胶回收。
1.3 16S rDNA基因文库的构建
PCR产物经回收试剂盒纯化后,将目标片段连接到pGEM-T easy vector(Promage公司)上,然后热激转化到大肠杆菌DH5α细胞中,涂布于含有氨苄青霉素抗性的LB平板上,37℃静置培养16 h。随机挑选100个白色单菌落,于100 μg/mL氨苄青霉素的LB液体培养基中培养,并送菌株测序。获取序列后,利用Oligo和Mega5.0生物分析软件剔除用于扩增的引物序列,并将所得序列输入NCBI网站,利用Blast与GenBank中已有的16S rDNA序列进行比对分析,确定产出水中功能细菌群落结构特征。
2 结果与分析
通过与NCBI中登录的细菌16S rDNA基因序列进行比对分析,发现大港油田石油产出水中的内源微生物组成主要如表1所示。
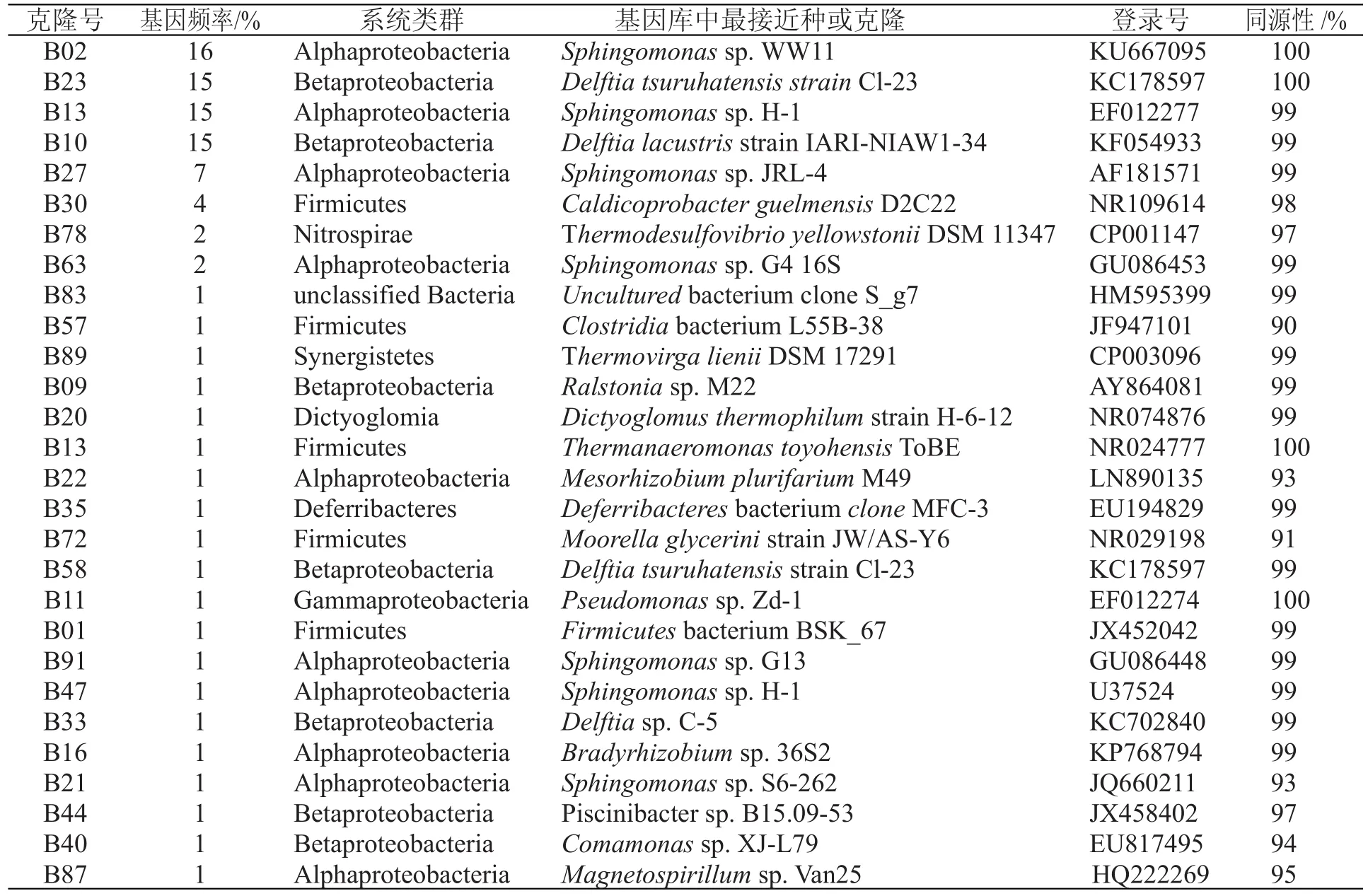
表1 油藏石油产出水细菌群落的16S rDNA序列比对分析结果
2.1 门水平上的菌群分布特征
通过克隆文库分析获得了油藏细菌的96个有效16S rDNA基因序列,由图1可知,油藏石油产出水中细菌门类主要包括:α-变形杆菌门(Alphaproteobacteria)46%、β-变形杆菌门(Betaproteobacteria)35%、厚壁菌门(Firmicutes)8%、硝化螺旋菌门(Nitrospirae)2%、互养菌门(Synergistia)1%、网团菌门(Dictyoglomia)1%、脱铁杆菌门(Deferribacteres)1%、γ-变形杆菌门(Gammaproteobacteria)1%以及未知菌门(unclassified Bacteria)。

图1 油藏石油产出水细菌群落结构的16S rDNA克隆文库分布(门水平)
2.2 属水平上的菌群分布特征
油藏细菌克隆文库分类结果显示文库所有菌属都属于细菌门,如图2所示。其中,鞘氨醇单胞菌属(Sphingomonas)占文库比例高达42%;其次,代尔夫特菌属(Delftia)占文库比例为32%;而Caldicoprobacter及高温脱硫弧菌属(Thermodesulfovibrio)比例分别为4%和2%。本文通过细菌16S rDNA克隆文库技术全面地揭示油藏环境微生物群落结构多样性。
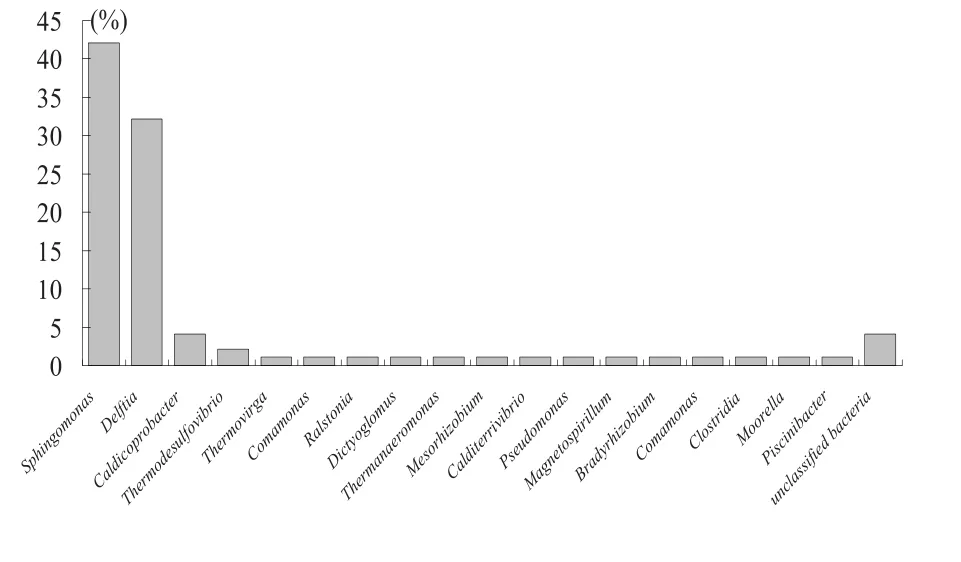
图2 油藏细菌功能微生物在16S rDNA文库的比例分布(属水平)
2.3 油藏主要细菌的功能
2.3 .1 α-变形杆菌纲细菌功能
文库分析揭示α-变形杆菌门(Alphaproteobacteria)是石油产出水中的第一大微生物门类,占文库比例为45%。而通常情况下,绝大多数的α-变形杆菌门的细菌属于寡营养型的微生物,即能在相对贫瘠的营养环境中生活。而油藏环境正是一种特殊的贫瘠生态环境,具有高温、高压、缺氧的地质特征,油藏环境中营养物质缺乏,其主要碳源通常情况下都是石油烃及其代谢衍生物。这种特殊的生态环境为α-变形杆菌门这类寡营养型微生物的大量存在创造了条件,使得其成为油田中的优势菌。其中,鞘氨醇单胞菌属(Sphingomonas)是石油产出水中α-变形杆菌门的第一大种属。研究发现鞘氨醇单胞菌耐受贫营养的代谢机制使其在自然界中有着极强的生命力和广泛的分布[4]。Kumar等研究发现鞘氨醇单胞菌Sphingomonas sp.GF2B对菲有较强的降解能力,而且表面活性剂鼠李糖脂还能显著提高该细菌的菲降解效果[5]。Kilbane等研究指出Sphingomonas sp.GTIN11.A对多环芳烃9-氮-芴具有良好的降解效果,而且发现了该菌基因组涉及9-氮-芴降解的复合酶系由9-氮-芴末端双加氧酶、2,3-二羟基联苯双加氧酶、复合物裂解酶、铁氧化还原蛋白等主要功能酶蛋白构成[6]。也有文献报到Sphingomonas sp.ZP1不仅可以降解菲、萘、甲苯等芳香族化合物,还能降解对甲醇、乙醇、水杨酸等醇类物质[7]。隶属于α-变形杆菌门红螺菌科的磁螺菌属Magnetospirillum在石油产出水中也占有一定比例,该类微生物通常会产生磁小体,据报道磁小体具有类似于过氧化物酶活性的特征,能够有效清除活性氧,有利于生命体适应于缺氧或微氧环境[8]。与此同时,还发现了如慢生根瘤菌属(Mesorhizobium)和慢生根瘤菌属(Bradyrhizobium)等较稀有的菌属。通过分析可知,油藏产出水中α-变形杆菌门的功能微生物以具有石油烃降解功能的鞘氨醇单胞菌属为主,该类微生物可以利用石油烃类物质作为唯一碳源,通过降解长链烷烃或原油重质组分,改善极端环境下原油的流动性,在促进原油开采过程中具有重要的应用潜力。
2.3 .2 β-变形杆菌门细菌功能
β-变形杆菌门(Betaproteobacteria)作为石油产出水中第二大功能微生物门类,在该克隆文库中的比例为37%。据文献报道,Betaproteobacteria常常参与环境中多环芳烃类物质的代谢,同时,SIP分析方法也证明该类菌群在多环芳烃的生物降解方面具有较高的潜力[9]。产出水中的β-变形杆菌门主要由代尔夫特菌属(Delftia)、青枯菌属(Ralstonia)、以及丛毛单胞菌属(Comamonas)组成。这里,代尔夫特菌属占比达32%,而且该菌属往往具有较强的降解石油类物质的潜力。其中,Delftia sp.是从化工行业废水污染的河道水体中分离获得的一株以2,4-二氯苯氧乙酸(2,4-D)为唯一碳源和能源的原始菌株[10],同时,Delftia sp.XYJ6则对苯胺有良好的降解效果[11],另外,有报道显示Delftia tsuruhatensis BM90菌种则具有降解多种酚类化合物的能力[12]。在该环境中也发现了β-变形杆菌门的Ralstonia,如Ralstonia eutropha在填料塔反应器中对高浓度的苯酚溶液(8.52 mol/m3)具有较高的降解效率[13]。Heidari等发现Ralstonia eutropha降解芳环类化合物双酚A的动力学模型满足Monod模型,其动力学参数Vmax=7.4(mg BPA g−1biomass h−1)及 Ks=10.8(mg/L)[14]。同时,也发现了丛毛单胞菌属(Comamonas)的存在,该属细菌大多能降解多种类固醇和多环芳香烃,例如Comamonas testosteroni中的β诱变-羟类固醇脱氢酶(诱变β-HSD)是诱导蛋白和激素降解的关键酶,能降解类固醇和多环芳香烃[15],在石油类物质的降解中发挥一定作用。
2.3 .3 厚壁菌门细菌功能
Firmicutes厚壁菌纲,该类菌序列在样品序列中所占比例为8%,为第三大类群,属于厚壁菌纲的很多菌种是能够产生芽孢的,这些芽孢能抵抗脱水和极端恶劣等环境。隶属于厚壁菌门Firmicutes厌氧的Caldicoprobacter菌属在石油产出水文库中比例为4%,研究发现该菌属能够利用葡萄糖、乳糖和蔗糖等糖类进行发酵代谢,同时生成乙酸、乳酸、乙醇、CO2和H2等代谢产物,可以为其他微生物的代谢提供小分子的营养物[16]。与此同时,厚壁菌门中还发现了兼性厌氧梭菌Clostridia,热厌氧单胞菌属Thermanaeromonas以及穆尔氏菌Moorella等稀少的微生物,这些菌属往往具有发酵糖类产乙醇、乙酸等小分子的能力。
2.3 .4 其他菌门细菌功能
在克隆文库中2%属于硝化螺旋菌门(Nitrospirae)中的兼性厌氧、嗜热、脱硫的热脱硫弧菌属Thermodesulfovibrio。研究发现Thermodesulfovibrio aggregans能在55~60℃的高温环境中生长,同时可以利用如氢、甲酸盐、丙酮酸和乳酸等小分子作为电子供体,进行硫酸盐还原代谢[17]。同时,热袍菌目(unclassified Thermotogales)的微生物也存在。通常情况下,热袍菌目细菌可以在90℃的极端高温环境生长,所有的热袍菌目的新陈代谢都是严格厌氧有机营养型的。而互养菌门Synergistetes厌氧菌Thermovirga为中等程度嗜热的厌氧细菌,通常能够利用蛋白质类、小分子氨基酸类以及部分有机酸类底物进行发酵代谢,但是不能够利用糖类、脂肪酸和乙醇作为底物;与此同时往往会将胱氨酸和S等还原为硫化物[18]。另外,在文库中发现了隶属于脱铁杆菌门Deferribacteres中的厌氧菌脱铁杆菌Deferribacter,研究发现脱铁杆菌属细菌往往以分子氢、乙酸盐、乳酸盐、琥珀酸盐、丙酮酸盐以及复杂的蛋白类化合物作为电子供体,而以Fe(III)、锰(IV)、硝酸或是元素硫作为电子受体进行生长代谢[19]。油藏环境中存在大量的耐高温的兼性厌氧和严格厌氧的微生物,这些微生物通常存在降解小分子酸和醇类物质的潜力,为油藏利用本源微生物进行微生物驱油技术的发展提供了重要的分子生物学信息。
3 结论
利用细菌16S rDNA克隆文库法对大港油田油藏内源微生物群落结构进行系统分析,发现油藏极端环境中仍存在大量的功能微生物,在细菌门类水平上包括Alphaproteobacteria、Betaproteobacteria、Firmicutes、Nitrospirae、Synergistetes、Dictyoglomia、Deferribacteres以及 Gammaproteobacteria等菌门。油藏极端环境中存在大量涉及石油烃类物质降解的功能微生物,在此以Sphingomonas和Delftia菌属为主。通过认识油藏极端环境微生物功能群结构特征,为微生物驱油技术的开展提供重要的参考信息。
[1]NAZINA T N,GRIGOR'IAN A A,SHESTAKOVA N M,et al.Microbiological investigations of high-temperature horizons of the Kongdian petroleum reservoir in connection with field trial of a biotechnology for enhancement of oil recovery[J].Microbiology,2007,76(3):287-296.
[2]LIU H J,YAO J,YUAN Z M,et al.Isolation and characterization of crude-oil-degrading bacteria from oil-water mixture in Dagang oilfield,China[J].International Biodeterioration&Biodegradation,2014,87(1):52-59.
[3]窦娜莎,王琳.16S rDNA克隆文库法分析Biostyr曝气生物滤池处理城市污水的细菌多样性研究[J].环境科学学报,2011,31(10):2117-2124.
[4]胡杰,何晓红,李大平,等.鞘氨醇单胞菌研究进展[J].应用与环境生物学报,2007,67(03):431-437.
[5]KUMAR V,SHARMA N,MAITRA S S.Comparative study on the degradation of dibutyl phthalate by two newly isolated Pseudomonas sp V21b and Comamonas sp 51F[J].Biotechnology Reports,2017,15:1-10.
[6]KILBANE II J J,DARAM A,ABBASIAN J,et al.Isolation and characterization of Sphingomonas sp GTIN11 capable of carbazole metabolism in petroleum[J].Biochemical and Biophysical Research Communications,2002,297(2):242-248.
[7]ZHAO H P,WANG L,REN J R,et al.Isolation and characterization of phenanthrene-degrading strains Sphingomonas sp ZP1 and Tistrella sp ZP5[J].Journal of Hazardous Materials,2008,152(3):1293-1300.
[8]LI K,CHEN C,CHEN C,et al.Magnetosomes extracted from Magnetospirillum magneticum strain AMB-1 showed enhanced peroxidase-like activity under visible-light irradiation[J].Enzyme and Microbial Technology,2015,72:72-78.
[9]MARTIN F,TORELLI S,PASLIER D L,et al.Betaproteobacteria dominance and diversity shifts in the bacterial community of a PAH-contaminated soil exposed to phenanthrene[J].Environmental Pollution,2012,162:345-353.
[10]GONZÁLEZ A J,GALLEGO A,GEMINI V L,et al.Degradation and detoxification of the herbicide 2,4-dichlorophenoxyacetic acid(2,4-D)by an indigenous Delftia sp strain in batch and continuous systems[J].International Biodeterioration&Biodegradation,2012,66(1):8-13.
[11]YAN H,YANG X,CHEN J,et al.Synergistic removal of aniline by carbon nanotubes and the enzymes of Delftia sp XYJ6[J].Journal of Environmental Sciences,2011,23(7):1165-1170.
[12]JUAREZ JIMENEZ B,REBOLEIRO RIVAS P,GONZALEZ LOPEZ J,et al.Immobilization of Delftia tsuruhatensis in macro-porous cellulose and biodegradation of phenolic compounds in repeated batch process[J].Journal of Biotechnology,2012,157(1):148-153.
[13]AMANI A,JALILNEJAD E,MOUSAVI S M.Simulation of phenol biodegradation by Ralstonia eutropha in a packed-bed bioreactor with batch recycle mode using CFD technique[J].Journalof Industrialand Engineering Chemistry,2017.doi.10.10161j.jiec.2017.10.037
[14]HEIDARI H,SEDIGHI M,ZAMIR S M,et al.Bisphenol A degradation by Ralstonia eutropha in the absence and presence of phenol[J].International Biodeterioration&Biodegradation,2017,119:37-42.
[15]XIONG G,MASER E.Construction of a biosensor mutant of Comamonas testosteroni for testosterone determination by cloning the EGFP gene downstream to the regulatory region of the 3,17β-HSD gene[J].Chemico-Biological Interactions,2015,234:188-196.
[16]BOUANANE-DARENFED A,FARDEAU M L,GRÉGOIRE P,et al.Caldicoprobacter algeriensis sp nov a new thermophilic anaerobic,xylanolytic bacterium isolated from an Algerian hot spring[J].Current Microbiology,2011,62(3):826-832.
[17]SEKIGUCHI Y,MURAMATSU M,IMACHI H,et al.Thermodesulfovibrio aggregans sp.nov.and Thermodesulfovibrio thiophilus sp nov,anaerobic,thermophilic,sulfate-reducing bacteria isolated from thermophilic methanogenic sludge,and emended description of the genus Thermodesulfovibrio[J].International Journal of Systematic&Evolutionary Microbiology,2008,58(11):2541-2548.
[18]DAHLE H,BIRKELAND N K.Thermovirga lienii gen nov,sp.nov.,a novel moderately thermophilic,anaerobic,amino-acid-degrading bacterium isolated from a North Sea oil well[J].International Journal of Systematic&Evolutionary Microbiology,2006,56(7):1539-1545.
[19]SLOBODKINA G B,KOLGANOVA T V,CHERNYH N A,et al.Deferribacter autotrophicus sp nov,an iron(III)-reducing bacterium from a deep-sea hydrothermal vent[J].International journal of systematic and evolutionary microbiology,2009,59(6):1508.

