桔子精油优化鱼鳞明胶膜性能的作用研究
宋琳璐,单梦圆,唐 艳,胡 熠,杨文鸽,徐大伦,楼乔明,张进杰
(宁波大学海洋学院,浙江宁波 315211)
近年来,一次性塑料包装材料引起的食品安全问题日益受到关注,塑料垃圾在自然界中不易分解腐烂,给生态环境造成负面影响。而且,在食品加工贮藏过程中,塑料中残留的一些化学物质可能会向袋内食品迁移,这刺激了食品包装产业研发安全的可生物降解包装材料[1]。可生物降解包装膜具有绿色环保、无毒无害、能够提高食品的质量和延长食品保质期等优点,近年来研究较多的可生物降解的膜材料有多糖、蛋白质和脂质或这些中性大分子材料的组合物[2-3]。其中蛋白质膜的原材料可以来自于植物(麦麸、玉米醇溶蛋白和大豆蛋白),也可来源于动物,如胶原、明胶和乳清蛋白[4-5]。而明胶因具有丰富的来源和良好的成膜性能,在全球受到广泛重视。明胶是衍生自胶原的蛋白质材料,可以用作食品添加剂、可食性包装膜材料以及作为封装剂[6]。
罗非鱼我国重要的经济鱼类,近年来我国每年加工量高达60万吨以上,在加工过程中产生的鱼体重4%的鱼鳞下脚料,为鱼鳞明胶的生产提供了充足的来源[7]。由于鱼鳞中没有血液循环,且水生动物胶原安全性高于陆地动物,因而鱼鳞胶原蛋白被认为是最安全的胶原蛋白之一[8]。但与哺乳动物明胶相比,鱼类明胶中亚氨基酸(脯氨酸和羟脯氨酸)的含量较低,导致鱼类明胶的热稳定性和机械强度较低[9]。明胶蛋白中含有较多的亲水性氨基酸,现有研究报道明胶膜的耐水性能普遍较差,这限制了明胶作为食品包装的应用领域。
桔子为芸香科植物,用桔皮提取的精油被广泛应用于食品香辛料中,其具有清甜的果香气味,给人以新鲜感[10]。同时,由于其来源丰富且价格低廉,桔子精油有望作为疏水性物质,以改善鱼鳞明胶膜的水蒸汽阻隔性能。此外,萜烯类(柠檬烯等)、芳香族化合物(芳樟醇、葛缕醇、酮类化合物等)和萜类化合物是桔子精油的主要成分,这使其具有一定的抑菌和抗氧化活性,能够通过降低脂质氧化来延长食物的保质期[10-11]。因此,柑橘精油可作为对人体和环境有害的化学杀菌剂的天然替代物,在食品应用中具有较大的应用潜力。
近年来有研究将牛至精油[12]、姜精油[13]添加到鱼皮明胶膜中以改善膜的各项性能,而将桔子精油加入鱼鳞明胶膜的研究鲜有报道。本文以鱼鳞明胶为基质,通过添加不同浓度的桔子精油制备桔子精油-鱼鳞明胶可食性膜,研究桔子精油浓度对鱼鳞明胶成膜特性的影响,并从精油作用于鱼鳞明胶分子结构的角度进行解析桔子精油优化鱼鳞明胶可食膜性能的机理。以期为工业化生产鱼鳞明胶可食性膜提供理论基础,提高其在食品包装上的应用范围。
1 材料与方法
1.1 材料与仪器
罗非鱼鱼鳞明胶 广东欧帝玛生物工程有限公司;甘油 国药集团化学试剂有限公司;桔子精油 上海奇卡商贸有限公司;Tween-20 北京索莱宝科技有限公司;营养肉汤培养基、营养琼脂培养基 杭州微生物试剂有限公司;金黄色葡萄球菌(ATCC 25923)、大肠杆菌(ATCC 25922) 中国农业微生物菌种保藏管理中心。
78-1磁力加热搅拌器 常州国华电器有限公司;HH-4数显恒温水浴锅 国华电器有限公司;XHF-D高速分散器 宁波新芝生物科技股份有限公司;DHG-9070AS电热恒温鼓风干燥箱 宁波江南仪器厂;JASCO傅立叶红外光谱仪 日本分光公司;HZQ-100A回旋振荡器 上海一恒科学仪器有限公司;数显千分测厚规 上海川陆量具有限公司;CR400色差仪 日本柯尼卡美能达;DSC200F3差示扫描量热仪 德国NETZSCH公司;INSTRON 5567万能材料实验机 美国英斯特朗公司;恒温恒湿培养箱 上海发瑞仪器科技有限公司。
1.2 桔子精油明胶复合膜的制备
参考Tongnuanchan等人[14]的方法略有修改,称取1.5 g干样罗非鱼鳞明胶,溶于50 mL去离子水中,静置溶胀20 min,再于50 ℃水浴20 min至充分溶解;将25%、50%、75%、100%(w/w,基于明胶的质量)的桔子精油与0.25 g/g(吐温/精油)的Tween-20混合均匀,加入明胶溶液中;在22000 r/min条件下均质3 min;再加入0.3 g/g(甘油/明胶)的甘油,磁力搅拌5 min混合均匀;成膜液在4000 r/min条件下离心1 min脱除气泡;再倒入10 cm×10 cm的平板中,放置于4 ℃冰箱中,凝胶状时放入25 ℃的鼓风干燥箱中干燥24 h,取出揭膜;测定前将干燥后的可食性膜放在25 ℃(相对湿度50%(1%)恒温恒湿箱中平衡48 h,再进行各项性能指标测试。
1.3 膜厚度检测
用千分测厚规(精确到0.001 mm)在每张膜上均匀取9个点,测厚度,取平均值。
1.4 膜机械性能
将可食性膜剪成2 cm×5 cm的样品,用万能材料实验机测定膜的抗拉伸强度(TS)、断裂伸长率(EAB)和弹性模量(EM)。测试的夹具间距为30 mm,拉伸速度为30 mm/min。每个样品重复测定5次,计算平均值[15]。
1.5 含水量
将膜剪成1 cm×4 cm的样品,称量膜质量Wi;放入105 ℃鼓风干燥箱中烘干至恒重,称量膜质量Wf[16]。每个样品重复测定三次。
水分含量(Moisture Content)计算公式如下:
1.6 溶解性
将膜剪成1 cm×4 cm的样品,放入105 ℃鼓风干燥箱中烘干至恒重,称量膜质量Wi;将样品浸没在30 mL蒸馏水中,室温下浸泡24 h;溶液用滤纸过滤,将滤纸和膜不溶部分在105 ℃鼓风干燥箱中烘干至恒重,称量膜质量Wf[15]。每个样品重复测定三次。
水溶性(Water Solubility)计算公式如下:
1.7 水蒸汽透过率(WVP)
将膜剪成4 cm×4 cm的样品,在5 mL的小烧杯中加入5 mL去离子水,用膜封口,置于含有硅胶的干燥器中,用±0.0001 g分析天平称重,10 h内每2 h称量一次。通过线性回归获得质量相对于时间变化的斜率。每个样品重复测定三次。
水汽渗透性(Water Vapor Permeability)计算公式[15]如下:
式中:WVTR(Water Vapor Transmission Rate)为膜的水蒸汽透过率(g/h·m2),由质量随时间变化率除以封口膜面积(m2)得到;L是平均膜厚度(mm);ΔP为膜两侧水蒸汽分压差(kPa)。
1.8 颜色和透明度以及透光性
利用全自动色差仪测定可食性膜的色泽,以白板作为色差测定参比,在每张膜上选择五处位置测量L*、a*、b*值,一个点从中央选取,另外沿着膜四周取4个点,计算平均值;颜色参数L*,a*,b*使用CIELAB色标测量:L*=0(黑色)至L*=100(白色),-a*(绿色)到+a*(红色)和-b*(蓝色)到+b*(黄色)。
利用紫外-可见分光光度计测定200~800 nm范围内可食膜对紫外光和可见光的阻隔性能,将膜剪成1 cm×4 cm的样品,贴于比色皿一侧,用空白比色皿做参比。在600 nm波长条件下测量吸光度确定膜的透明度[15]。每个样品重复测定三次。
透明度计算公式如下:
透明度=-log T600/x
式中:T600:600 nm处可食膜的透光率;x:膜的厚度(mm)。
1.9 差示扫描量热法
将待测膜放置在含有硅胶的干燥器中干燥2周。用±0.0001 g分析天平准确称量10 mg左右样品,置于铝制坩埚中并压片封口,放入DSC仪器中,以空铝皿作为参比。N2作为保护气和吹扫气,流量分别为60 mL/min和20 mL/min,以10 ℃/min的速率从20 ℃加热到120 ℃[15]。
利用DSC配套的数据处理软件对DSC曲线进行分析,可食性膜的玻璃化转变温度(Tg)为转变斜线的中点所对应的温度。
1.10 傅里叶变换红外光谱和二级结构分析
将可食性膜放置在含有硅胶的干燥器中干燥2周,在20%相对湿度环境下,取剪碎的膜片0.2 mg,加入2 mg KBr在研钵中研磨,取适量进行压片,然后固定于样品架上,用傅立叶红外光谱仪以4 cm-1的分辨率在400~4000 cm-1的波数范围测定膜的红外光谱。每个光谱扫描32次。
对可食性膜1600~1700 cm-1范围内的红外光谱进行傅立叶变换去卷积,并利用PeakFit4.12进行二阶导数拟合,得到的子峰数目在8~12之间,其残差(R2)大于0.99。确认峰位归属,计算各分峰面积的相对百分含量。
1.11 抑菌活性测定
通过常规液体培养实验研究桔子精油明胶膜对大肠杆菌和金黄色葡萄球菌的抗菌活性。将0.18~0.20 g的样品放入玻璃试管中,加入10 mL营养肉汤培养基,然后,将0.1 mL菌种接种到培养基中。在相同条件下用不含明胶膜培养的试管作为空白对照组。通过观察细菌生长测定桔子精油明胶膜的抑菌活性。在统计分析之前,将细菌数转化为log10菌落形成单位/克(CFU/g)。每个样品重复3次,计算平均值[17]。
1.12 数据分析
所得数据使用SPSS 21.0(IBM SPSS Statistics)软件处理,ANOVA法进行方差分析,Duncan多重比较检验法进行显著性分析(p<0.05)。用Origin Pro9.0(Origin Lab)作图。
2 结果与分析
2.1 桔子精油对鱼鳞明胶膜厚度的影响
由表1可知,随着桔子精油质量浓度的增加,明胶膜的厚度逐渐上升,当精油浓度为75%时,与对照膜相比显著增加(p<0.05)。纯鱼鳞明胶膜的厚度为(0.101±0.007) mm,当桔子精油浓度从25%增加到100%(w/w)时,膜的厚度从(0.105±0.007) mm升高到0.117±0.003 mm。Tongnuanchan等人[14]也发现与生姜、姜黄、姜参精油结合的鱼皮明胶膜的厚度随着精油含量的增加而增加。

表1 桔子精油鱼鳞明胶膜的机械性能和厚度Table 1 Mechanical properties and thickness of fish scale gelatin films containing orange oil
明胶分子与桔子精油为互不相融成分,本实验中随着桔子精油量的增加,桔子精油-鱼鳞明胶膜厚度的逐渐增加,这主要是由于精油成分增加了明胶膜结构的疏松度,从而增加了膜的厚度[18]。同时,桔子精油油滴分布在蛋白质链之间,降低了鱼鳞明胶膜内明胶分子网络的致密性[14]。精油的存在也会阻碍明胶分子肽链之间的相互作用,导致明胶膜致密网络的损失和明胶分子链有序排列的减少,从而会对鱼鳞明胶膜的结构和机械性能有一定影响。
2.2 桔子精油对鱼鳞明胶膜机械性能的影响
可食性膜在加工、运输、应用过程中需要保持完整性以保护产品免受外界损伤。可食性膜足够的机械强度可以保证包装的完整性。桔子精油鱼鳞明胶膜的机械性能如表1所示,甘油增塑后的鱼鳞明胶膜的抗拉强度(TS)为(12.83±1.10) MPa,断裂伸长率(EAB)为50.42%±5.88%,弹性膜量值(EM)为(160.45±10.97) MPa。随着桔子精油浓度的增加,鱼鳞明胶膜的TS和EM值不断降低,EAB逐渐增大。当加入桔子精油的浓度较高(75%~100%)时,复合膜的TS和EM值与对照膜相比差异显著(p<0.05)。
吴菲菲等[8]测得含有2%(w/v)明胶蛋白和0.3 g/g甘油的鱼鳞明胶膜的TS为(27.55±1.67) MPa,EAB为57.82%±4.60%。与之相比,本实验测得的明胶膜的拉伸强度相对较低,可能与制膜的厚度和成膜明胶蛋白的分子量分布相关,通常情况是,高分子量成分含量越多膜越厚,膜的拉伸强度越高[19]。Qin等人[17]制备聚乳酸活性包装膜,加入0.9%(w/w)香柠檬、柠檬草、迷迭香和丁香精油,结果显示:添加植物精油的复合膜TS和EM随着浓度增加而降低,EAB随浓度增加而升高,和本实验得到的结果一致。在实际应用中,包装膜的TS值必须大于3.5 MPa[20],并且聚合物膜必须能够抵抗相当大的应力而不断裂。因此,具有较高的EAB值和适当的TS值的复合膜适用于食品包装,由上可知,50%~75%质量分数的桔子精油比较适宜。
2.3 桔子精油对鱼鳞明胶膜含水量的影响
水分含量值用以评估可食性膜产品保持水分的能力。水分含量不仅能反映膜内部明胶和精油的相互作用,而且还可以反映蛋白膜的吸湿性和亲水性[21-22]。
从表2可以看出,经甘油增塑之后的鱼鳞明胶膜的水分含量为39.78%。当明胶膜加入25%的桔子精油之后,水分含量显著降低到29.29%。之后,随着精油含量的增加,膜的含水量不断降低,最低达到16.60%。Ansorena等人[23]在小麦面筋蛋白膜中加入百里香精油发现含有高浓度精油的活性膜与对照膜相比,水分含量显著降低(63.4%~55.4%)。这反映了疏水脂质成分对膜组成的影响,导致样品的亲水性总体降低,有助于延长膜的保质期。由上可知,添加桔子精油后显著改善了明胶膜的平衡水含量,加入75%~100%的桔子精油比较适宜。
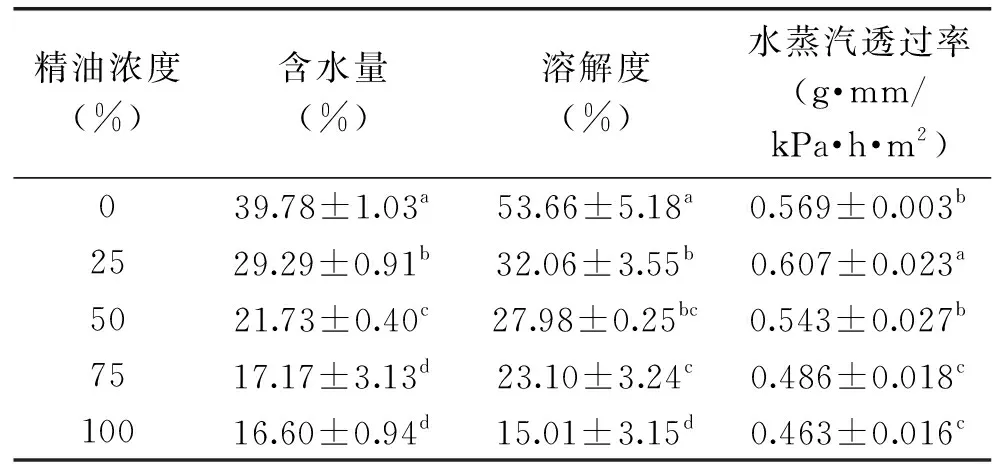
表2 桔子精油鱼鳞明胶膜的含水量、溶解度和WVPTable 2 The water content,solubility and WVP of fish scale gelatin films containing orange oil
2.4 桔子精油对鱼鳞明胶膜溶解度的影响
膜的水不溶性或水抗性是食品保护过程中一个重要的特性,膜溶解度可以被看作是膜的耐水性和完整性的量度[21]。当膜包裹的食品水分活度很高时或当膜要与水接触时,要避免新鲜或冷冻成分的渗出[24]。
由表2可以看出,纯明胶膜的溶解度最高,达到53.66%;添加25%桔子精油的鱼鳞明胶膜的溶解度与对照膜相比显著降低(p<0.05);之后,随着精油的浓度提高,膜的溶解度不断下降,最低达15.01%。翁武银等[25]加入20%的甘油制得的鱼皮明胶膜的膜溶解度为57.62%±1.59%,Hosseini等[15]用4%鱼皮明胶和30%甘油制备的可食膜的溶解度为63.81%,本实验中明胶膜溶解度略低于这两位研究者的结果。通常,蛋白溶解率的降低可用于判断交联改性的效果[21]。添加精油的鱼鳞明胶膜的溶解度降低可能是因为桔子精油的非极性组分有利地与明胶的疏水结构域相互作用[26],也可能是桔子精油在低浓度下分散,作为明胶分子之间间隙的填充,在更高的桔子精油浓度下诱导蛋白链之间的更强的相互作用[25],导致随着精油含量的增加膜的水溶性降低。膜水溶性变化趋势和水分含量变化具有一定的相关性,所以,桔子精油能够改善鱼鳞明胶膜对水的抗性,添加75%~100%的桔子精油比较适宜。
2.5 桔子精油对鱼鳞明胶膜水蒸汽透过率的影响
水蒸汽透过率是可食性膜的一项重要性能指标,反映膜对水蒸汽的阻隔性能。可食性膜的重要功能之一是减少包装产品与环境之间的水分交换,从而减少产品的水分损失[27]。因为包装内的水会导致变质反应和微生物生长,所以WVP值应该尽量低。然而,包装膜的高WVP可允许更多的水蒸汽透过并降低包装内的相对湿度,因此,对于新鲜产品的保存,优选适当的WVP值。
由表2可以看出,鱼鳞明胶膜的水蒸汽透过率为0.569 g·mm/kPa·h·m2,当加入25%(w/w)精油时,其水蒸汽透过率与对照膜相比增大,达到0.607 g·mm/kPa·h·m2,之后随着精油浓度的增加,水蒸汽透过率逐渐减小,最低达0.463 g·mm/kPa·h·m2。这可能是因为加入精油的含量低时,增加水分子转移的曲折因子脂质的不连续性是有限的,并且不能补偿由桔子精油引入活性膜中的破坏。由于水蒸汽传输通常通过膜网络的亲水部分发生,因此水蒸汽透过率的高低也取决于膜组分的亲水/疏水比[28],此外,精油掺入明胶中同时还伴随着甘油含量的减少,所以,对于含有较高精油浓度的复合膜,其水蒸汽透过率随着精油浓度的增加而减小。结合实际应用,选择浓度为75%~100%桔子精油较为适宜。
2.6 桔子精油对鱼鳞明胶膜色差、透光度和透明度的影响
桔子精油明胶膜的色差如表3所示,加入桔子精油后可食膜的L*、a*、b*值与对照膜相比存在显著性差异(p<0.05)。本实验测得单一明胶膜的L*=91.04,a*=-0.97,b*=6.35,与陈书霖等[29]在2%罗非鱼鳞明胶溶液,加入20%甘油作为增塑剂,测定的明胶膜L*=91.86,a*=-0.88,b*=1.42的结果相似。随着桔子精油含量的增加,鱼鳞明胶膜的L*值和a*值逐渐减小,说明膜的明亮度不断降低,颜色越来越暗。b*值由6.35增加到12.37,说明在加入桔子精油后,明胶膜有变黄的趋势,且随着精油浓度的增加,膜的颜色进一步加深。

表3 桔子精油鱼鳞明胶膜的色差和透明度Table 3 Chromatic aberration and transparency of fish scale gelatin films containing orange oil
由图1可知,在200~280 nm的紫外辐射范围内,所有的膜都显示出优异的紫外阻隔性能。单一鱼鳞明胶膜的紫外透光度低至0.01~0.14,加入桔子精油的明胶膜的紫外透光度更低,处在0.01~0.08范围内。这可能是由于在蛋白质膜中吸收紫外光的芳香族氨基酸如酪氨酸和色氨酸含量高,也可能与蛋白质中的肽键相关[30]。这与Tongnuanchan等[14]测得的罗非鱼鱼皮明胶膜在200 nm处0.01的透光度相一致,但在280 nm处,3.5%明胶浓度的鱼皮明胶膜透光度为40.73,明显高于本实验获得的数据,这可能是由于成膜方法、测试条件、明胶浓度和组分等因素造成的。
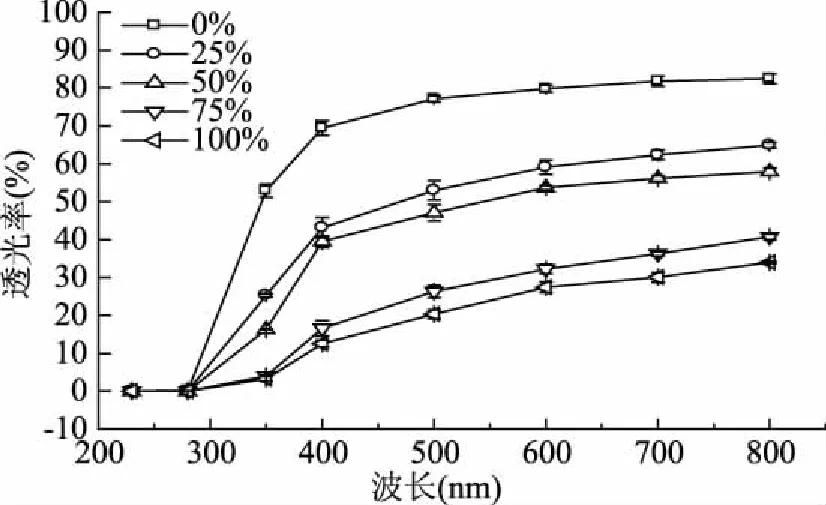
图1 桔子精油鱼鳞明胶膜的透光度Fig.1 Light transmission of the fish scale gelatin films containing orange oil
由图1可知,在350~800 nm的可见光区,膜的透光性随着精油浓度的提高逐渐降低。透光度降低可能是与分布在整个膜中的精油导致的不同程度的光散射相关[31]。此外,Limpan等人[32]提到膜的透光性最有可能由膜网络中聚合物的排列来控制。
膜透明值越低,膜的实际透光度越高。在加入25%桔子精油之后,膜的透明值显著提高(p<0.05),由0.0908升高到0.2548,之后随着精油浓度的增加而不断升高。明胶膜透光度的降低与添加精油有关,精油中的着色成分以及有序膜蛋白网络的破坏也使得含有精油的明胶膜的透明度降低[14]。因此,添加精油对明胶膜的外观和光阻隔性质具有影响,尤其在加入桔子精油之后明胶膜的紫外阻隔性能得到增强,这有利于减缓由于紫外线照射引发的脂质氧化对食品造成的劣变。在实际应该中应结合所包装食品的色泽以及膜颜色的可接受度考虑,从而选择适合浓度的可食性膜。
2.7 桔子精油对鱼鳞明胶膜热性能的影响
玻璃化转变温度(Tg)是材料从无定形固态到更粘稠的橡胶状态的结构转变温度,与体系流动性有关[33]。鱼鳞明胶膜的DSC热分析谱图如图2所示。单纯添加甘油作为增塑剂的鱼鳞明胶膜的玻璃化转变温度为59.1 ℃,加入25%桔子精油之后,明胶膜的Tg值降低为53.5 ℃,而当精油浓度为50%时,Tg值随浓度提高到64.1 ℃,之后随着浓度的增加,Tg值基本维持在66 ℃左右。

图2 桔子精油鱼鳞明胶膜的DSC热谱图Fig.2 DSC thermograms of the fish scale gelatin films containing orange oil
本实验测得的纯明胶膜的Tg值低于吴菲菲[8]等人加入0.4 g/g甘油制得的罗非鱼鱼鳞明胶膜的Tg值(66.64 ℃),而略高于Hosseini[15]的冷水鱼皮明胶膜的Tg值(56.9 ℃)。明胶膜玻璃化转变温度的差异主要和明胶的来源、膜的组成和使用的方法有关。Tg是组分间易混合性的一个重要标准,加入25%桔子精油的明胶膜的Tg值的下降反映了体系中精油、甘油与明胶蛋白等组分间的相融程度降低。之后,随着精油浓度的增加,Tg值提高,表明明胶和精油之间发生了相互作用并随浓度提高不断加强,提升了组分相融性,从而使明胶膜物理状态的转变需要吸收更多的热,使得Tg值不断升高。而当精油浓度为100%时,Tg值不再升高,这可能是因为加入的精油过多,与蛋白质基膜分离,分布于膜的表面[14]。整体上,添加桔子精油提高了鱼鳞明胶膜的玻璃化转变温度,只有精油含量为25%时会降低玻璃化转变温度,可知添加浓度为50%~100%的桔子精油比较适宜。
2.8 桔子精油-鱼鳞明胶复合膜的红外光谱分析


图3 桔子精油鱼鳞明胶膜的红外谱图Fig.3 The FT-IR spectra of the fish scale gelatin films containing orange oil

2875~2879 cm-1和2926~2938 cm-1波数的峰存在于所有样品中,分别对应CH2和CH3基团中的脂肪族C-H亚甲基的不对称和对称伸缩振动[37]。在添加精油的膜中这两个峰的振幅较高,表明在膜基质中存在含烃的精油。1732~1734 cm-1吸收峰只存在于含有精油的明胶膜中,代表醛或酯羰基的C=O伸缩振动,且振幅随着精油含量的增加而增大。此外,923 cm-1和854 cm-1处的两个带与C-C键骨架伸缩振动相关[38],在含有精油的膜中更加明显。这两个峰的位置和强度随精油含量的增加有明显变化,因为精油的较长碳链结构比较容易受到多聚物基质和精油相互作用的影响[39]。整体来看,在桔子精油-鱼鳞明胶膜的FTIR图中酰胺Ⅰ和酰胺Ⅱ等响应峰随着精油含量的增加而变得更加尖锐,说明精油均匀分布到蛋白质结构域的内部,影响了明胶分子的结构,同时明胶与精油的相互作用与精油浓度有一定关系。
2.9 桔子精油-鱼鳞明胶复合膜的二级结构分析
蛋白质的二级结构是通过主链上的C=O和N-H间的氢键作用维持,酰胺I带(1600~1700 cm-1)对应C=O伸缩振动,且吸收最强,在定量分析蛋白二级结构上的应用已十分成熟。各拟合子峰与二级结构对应关系为:1600~1639 cm-1被指认为β-折叠,1640~1650 cm-1被指认为无规则卷曲;1651~1660 cm-1被指认为α-螺旋结构;1661~1700 cm-1被指认为β-转角结构[40]。由图4可见,加入25%的桔子精油后,β-折叠含量由28.02%降低到了25.44%,之后随着精油含量的提升开始不断增加,最终在100%精油浓度时达到最大值36.80%。无规则卷曲在加入0~50%的桔子精油之后比例变化不大,在加入50%~100%的桔子精油之后比例明显降低。α-螺旋在加入桔子精油之后比例明显降低。纯明胶膜的β-转角比例为28.93%,在加入25%的桔子精油后提高到44.87%,之后随着精油浓度的升高略微降低,但整体呈现上升的趋势。
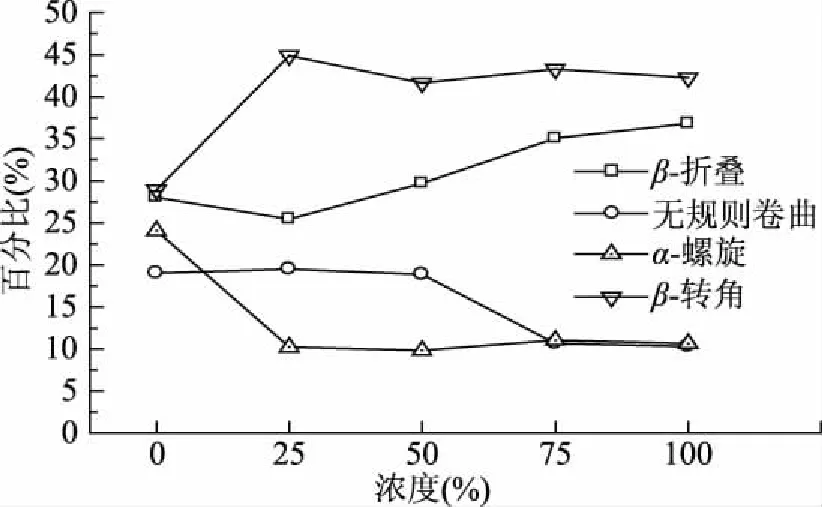
图4 桔子精油鱼鳞明胶膜的二级结构含量Fig.4 Content of secondary structure of the fish scale gelatin films containing orange oil
结合红外光谱内部作用变化分析,加入25%的桔子精油后,精油分布在明胶膜基质间,打破了原有的明胶膜蛋白质结构,导致明胶链间氢键相互作用减弱,使得与氢键有关的二级结构峰由低波数向高波数转变[41],因而较高波数的β-转角含量明显增加,而低波数的β-折叠含量减少。而当精油浓度增加到75%之后,由于精油中的羰基和羟基与明胶链的羰基和氨基发生相互作用,导致明胶链内部的羰基氧和氨基氢的静电相互作用以及羰基氧和氨基氢的氢键受到破坏,使得复杂的α-螺旋转变为更多简单形式的无规则卷曲和β-转角。这与Herrero等人[42]的结果一致,其研究发现,由于添加大豆蛋白和热作用,使得肉糊的α-螺旋结构内部氢键被破坏,而峰位较高的β-转角比例增加。因此,二级结构变化与红外光谱分析内部作用的变化有着相应性。所以FTIR谱图揭示了加入不同浓度的桔子精油之后膜内部相互作用以及鱼鳞明胶部分二级结构的变化。
2.10 桔子精油对鱼鳞明胶膜抑菌活性的影响
纯鱼鳞明胶膜和复合膜对大肠杆菌和金黄色葡萄球菌的抑菌效果如图5所示。大肠杆菌和金黄色葡萄球菌分别是革兰氏阴性菌和革兰氏阳性菌的典型代表,在食品中较为常见。从图中可以看出,纯鱼鳞明胶膜基本无抑菌作用,复合膜对两种腐败菌均有抑制效果,当桔子精油浓度为25%时,抑菌效果与纯鱼鳞明胶膜相比显著增加(p<0.05),随着精油浓度的增加,抑菌效果逐渐增强,而当添加75%和100%的桔子精油时,发现复合膜对两种腐败菌的抑菌效果无显著性差异(p>0.05)。复合膜对腐败菌的抑制效果主要是因为在桔子精油中发现的生物活性化合物如萜烯和多酚类物质的抑菌作用[43-44];而高浓度时抑制效果无显著差异,可能是因为复合膜中精油的含量已达到饱和,多余的精油分布于明胶膜的表面并且有效成分逐渐挥发。

图5 桔子精油添加量对鱼鳞明胶膜抑菌性能的影响Fig.5 Effect of OEO content on the antibacterial activity of fish scale gelatin films
同时,发现添加桔子精油的明胶膜对金黄色葡萄球菌比对大肠杆菌抑制效果更好,因为革兰氏阴性细菌的外细胞壁含有脂多糖和外膜蛋白,可作为保护膜限制精油中酚类成分的扩散[45]。这些结果证明桔子精油可以固定在鱼鳞明胶膜中,然后释放出来,抑制微生物的生长。由上可知,添加75%~100%桔子精油比较合适。
3 结论
添加不同浓度的桔子精油对鱼鳞明胶膜的机械、物理、热性能和抑菌性能有不同程度的影响。随着精油浓度的增加,明胶复合膜的抗拉性能和透明度降低,厚度和延展性增加。高浓度(75%~100%)的精油能显著改善鱼鳞明胶膜的水溶性、WVP、热稳定性和抑菌性能。综合来看,添加75%的桔子精油对明胶膜性能优化效果最好。
[1]Yen T H,Lin-Tan D T,Lin J L. Food safety involving ingestion of foods and beverages prepared with phthalate-plasticizer-containing clouding agents[J]. Journal of the Formosan Medical Association,2011,110(11):671-684.
[2]Pavlath A E,Orts W. Edible films and coatings for food applications[M]. United States:Springer New York,2009.1-23.
[3]Tharanathan R N. Biodegradable films and composite coatings:past,present and future[J]. Trends in Food Science & Technology,2003,14(3):71-78.
[4]Reddy N,Yang Y. Thermoplastic films from plant proteins[J].Journal of Applied Polymer Science,2013,130(2):729-738.
[5]Silva N H C S,Vilela C,Marrucho I M,et al. Protein-based materials:from sources to innovative sustainable materials for biomedical applications[J]. Journal of Materials Chemistry B,2014,2(24):3715-3740.
[6]Moorhouse S,Grundon V. Encapsulation:A new concept for the food industry?[J]. Nutrition & Food Science,1994,94(2):17-19.
[7]中国渔业年鉴[M].北京:中国农业出版社,2011.
[8]吴菲菲,翁武银,苏文金,等. 罗非鱼鱼鳞明胶蛋白膜的制备及特性[J]. 食品工业科技,2013,34(11):277-282.
[9]Gómezguillén M C,Pérezmateos M,Gómezestaca J,et al. Fish gelatin:a renewable material for developing active biodegradable films[J]. Trends in Food Science & Technology,2009,20(1):3-16.
[10]余珍,丁靖垲.几种芸香科柑桔类精油的化学成分与香气的研究[J].云南植物研究,1996,18(4):465-470.
[11]Zivanovic S,Chi S,Draughon A F. Antimicrobial activity of chitosan films enriched with essential oils[J]. Journal of Food Science,2010,70(1):M45-M51.
[12]Hosseini S F,REZAEI M,ZANDI M,et al. Bio-based composite edible films containingOriganumvulgare,L. essential oil[J].Industrial Crops & Products,2015,67:403-413.
[13]邵东旭,王卉,裴志胜,等.鱼鳞胶原蛋白复合抗菌膜对罗非鱼肉的保鲜效果[J].包装工程,2016(23):73-77.
[14]Tongnuanchan P,Benjakul S,Prodpran T. Physico-chemical properties,morphology and antioxidant activity of film from fish skin gelatin incorporated with root essential oils[J]. Journal of Food Engineering,2013,117(3):350-360.
[15]Hosseini S F,Rezaei M,Zandi M,et al. Preparation and functional properties of fish gelatin-chitosan blend edible films[J]. Food Chemistry,2013,136(3-4):1490-1495.
[16]Hosseini S F,Rezaei M,Zandi M,et al. Preparation and characterization of chitosan nanoparticles-loaded fish gelatin-based edible films[J].Journal of Food Process Engineering,2016,39(5):521-530.
[17]Qin Y,Li W,Liu D,et al. Development of active packaging film made from poly(lactic acid)incorporated essential oil[J]. Progress in Organic Coatings,2016,103:76-82.
[18]Benavides S,Villalobos-Carvajal R,Reyes J E. Physical,mechanical and antibacterial properties of alginate film:Effect of the crosslinking degree and oregano essential oil concentration[J].Journal of Food Engineering,2012,110(2):232-239.
[19]Jongjareonrak A,Benjakul S,Visessanguan W,et al. Characterization of edible films from skin gelatin of brownstripe red snapper and bigeye snapper[J].Food Hydrocolloids,2006,20(4):492-501.
[20]Kim Y J,Lee H M,Park O O. Processabilities and mechanical properties of surlyn-treated starch/LDPE blends[J]. Polymer Engineering & Science,1995,35(20):1652-1657.
[21]Rhim J W,Gennadios A,Handa A,et al. Solubility,tensile,and color properties of modified soy protein isolate films[J]. Journal of Agricultural & Food Chemistry,2000,48(10):4937-4941.
[22]Hernández-Muoz P,Villalobos R,Chiralt A. Effect of thermal treatments on functional properties of edible films made from wheat gluten fractions[J]. Food Hydrocolloids,2004,18(4):647-654.
[23]Ansorena M R,Zubeldía F,Marcovich N E. Active wheat gluten films obtained by thermoplastic processing[J]. LWT-Food Science and Technology,2016,69:47-54.
[24]Gontard N,Guilbert S,Cuq J L. Edible wheat gluten films:influence of the main process variables on film properties using Response Surface Methodology[J]. Journal of Food Science,1992,57(1):190-195.
[25]翁武银,吴菲菲,大迫一史,等. 脱水热处理改善鱼皮明胶可食膜的性能[J]. 农业工程学报,2013,29(22):284-291.
[26]Ahmad M,Benjakul S,Prodpran T,et al. Physico-mechanical and antimicrobial properties of gelatin film from the skin of unicorn leatherjacket incorporated with essential oils[J]. Food Hydrocolloids,2012,28(1):189-199.
[27]Du,W-X,Olsen C W,Avena-Bustillos R J,et al. Physical and antibacterial properties of edible films formulated with apple skin polyphenols[J]. Journal of Food Science,2011,76(2):149-155.
[28]Tongnuanchan P,Benjakul S,Prodpran T. Properties and antioxidant activity of fish skin gelatin film incorporated with citrus essential oils.[J]. Food Chemistry,2012,134(3):1571-1579.
[29]陈书霖,陶忠,吴菲菲,等. 鱼皮明胶蛋白膜的制备及其性质改良[J]. 集美大学学报:自然科学版,2012(5):335-342.
[30]Aitken A,Learmonth M. The protein protocols handbook[M].United States:Humana Press,1996:3-6.
[31]Hoque M S,Benjakul S,Prodpran T. Properties of film from cuttlefish(Sepiapharaonis)skin gelatin incorporated with cinnamon,clove and star anise extracts[J]. Food Hydrocolloids,2011,25(5):1085-1097.
[32]Limpan N,Prodpran T,Benjakul S,et al. Properties of biodegradable blend films based on fish myofibrillar protein and polyvinyl alcohol as influenced by blend composition and pH level[J]. Journal of Food Engineering,2010,100(1):85-92.
[33]Tang C H,Xiao M L,Zhong C,et al. Properties of cast films of vicilin-rich protein isolates from Phaseolus legumes:Influence of heat curing[J]. LWT-Food Science and Technology,2009,42(10):1659-1666.
[34]Tanong A,Soottawat B,Wonnop V. Functional properties of gelatin from cuttlefish(Sepiapharaonis)skin as affected by bleaching using hydrogen peroxide[J]. Food Chemistry,2009,115(1):243-249.
[35]Muyonga J H,Cole C G B,Duodu K G. Characterisation of acid soluble collagen from skins of young and adult Nile perch(Latesniloticus)[J]. Food Chemistry,2004,85(1):81-89.
[36]Bergo P,Sobral P J A. Effects of plasticizer on physical properties of pigskin gelatin films[J]. Food Hydrocolloids,2007,21(8):1285-1289.
[37]Muik B,Lendl B,Molina-Diaz A,et al. Two-dimensional correlation spectroscopy and multivariate curve resolution for the study of lipid oxidation in edible oils monitored by FTIR and FT-Raman spectroscopy[J]. Analytica Chimica Acta,2007,593(1):54-67.
[38]Guerrero P,Nur Hanani Z A,Kerry J P,et al. Characterization of soy protein-based films prepared with acids and oils by compression[J]. Journal of Food Engineering,2011,107(1):41-49.
[39]Le T,Maki H,Takahashi K,et al. Properties of gelatin film from horse mackerel(Trachurusjaponicus)scale[J]. Journal of Food Science,2015,80(4):E734-E741.
[40]Dogan A,Siyakus G,Severcan F. FTIR spectroscopic characterization of irradiated hazelnut(CorylusavellanaL.)[J]. Food Chemistry,2007,100(3):1106-1114.
[41]高红艳,蒋士龙,莫蓓红,等. 涂抹再制干酪中蛋白质的二级结构及其对质构的影响[J]. 中国乳品工业,2009,37(1):36-39.
[42]Herrero A M,Carmona P,Cofrades S,et al. Raman spectroscopic determination of structural changes in meat batters upon soy protein addition and heat treatment[J]. Food Research International,2008,41(7):765-772.
[43]Fisher K,Phillips C A. The effect of lemon,orange and bergamot essential oils and their components on the survival ofCampylobacterjejuni,EscherichiacoliO157,Listeriamonocytogenes,BacilluscereusandStaphylococcusaureusinvitroand in food systems[J]. Journal of Applied Microbiology,2006,101(6):1232-1240.
[44]Sánchezgonzález L,Cháfer M,Gonzálezmartínez C,et al. Study of the release of limonene present in chitosan films enriched with bergamot oil in food simulants[J]. Journal of Food Engineering,2011,105(1):138-143.
[45]Sharma P C,Jain S,Yadav G,et al. Natural preservatives:current insights and applications[J]. Der Pharmacia Sinica,2010,1(3):95-108.

