水酶法从红花籽中提取油脂与水解蛋白的工艺优化
关炳峰,吕凯波,李向力,高海东,徐 钟,李 彬,刘 晓,洪慧杰,李 栋
(1.河南省商业科学研究所有限责任公司,河南郑州 450002; 2.武汉工商学院环境与生物工程学院,湖北武汉 430065; 3.食品安全大数据关键技术与应用河南省工程实验室,河南郑州 450002)
红花(CarthamustinctoriusL.)又名草红花、菊红花等,是一年生双子叶菊科草本植物,集油、药、染料、饲料兼用,其花冠、籽实、茎叶、秸秆都可以利用[4],其籽含油一般在23%~46%,高于大豆。红花和红花籽用处较为广泛,红花籽油中必需脂肪酸含量达80%以上,其中亚油酸的含量高达73%~85%,在已知植物油中亚油酸含量最高[2],有“亚油酸之王”之称。红花籽油在很多国家可以被食用,经常食用红花籽油有延缓衰老的功效,还具有促进微循环、间接恢复神经功能等作用[3]。红花籽蛋白含有丰富的氨基酸,且很多为必需氨基酸,即可以作为蛋白质营养强化剂,也可以作为食品添加剂,有很大的利用开发空间。
红花籽油的提取方法有压榨法、溶剂法等。传统的压榨法利用外力挤压获得油,这种方法提取的油虽然纯净,油的品质也相对较高,但出油率较低,成本也比较高,而且压榨后得到的红花籽粕一般都是用作了饲料,残油率也很大,整个红花籽的利用率不高;有机溶液浸出法提取油脂,虽然红花籽粕中残油少,出油率比起压榨法高,加工成本较低,但含有有机溶剂,工艺比较繁琐,食用安全性差,并且会给造成环境污染[5-6];比起这两种传统的提油方法,水酶法具有很多优势,李倩等人的研究得到水酶法提取红花籽油提油率为63.16%[4]。水酶法采用的是在机械破碎后,用酶对细胞壁、脂多糖、脂蛋白进行降解,使油料细胞中的油释放出来,水酶法相比压榨法和有机溶剂浸出法来说,出油率较高,工艺条件相对简单,环境污染小,提出的油品质较高,在提油的同时还可以得到水解蛋白等[6-7]。现如今水酶法已经运用到多种含油原料的提取工艺中,有花生、油菜籽、大豆、巴坦木、核桃、牡丹籽、杏仁、核桃等[5-10]。
本实验对水酶法从红花籽中提油和提取水解蛋白同时进行了研究,基于王英瑶等[6]对碱提工艺优化的研究,选出最佳的碱提温度和时间,对红花籽和酶解后的乳状液成分进行分析,在筛选出最佳酶组合后,选出最佳酶用量、酶解时间、料液比,确定水酶法从红花籽中提取油脂和水解蛋白的最佳工艺条件。对酶解后得到的O/W型乳状液进行破乳提油,以期提高红花籽油脂得率,为开发红花籽油和水解蛋白提供理论依据。
1 材料与方法
1.1 材料与仪器
红花籽 新疆产地;茚三酮 AR,天津市凯通试剂有限公司;纤维素酶(50 U/mg) 食品级,江苏锐阳生物科技有限公司;果胶酶(100 U/mg) 食品级,江苏锐阳生物科技有限公司;水解蛋白酶Alcalase 2.4L(2.4 AU/g) 食品级,丹麦诺维信。
YP202N电子天平 上海精密仪器仪表有限公司;AUY120分析天平 SHIMADZU CORPOPA TION JAPAN;BCD-217C电冰箱 美的集团电冰箱合肥有限公司;50目分样筛 上虞市龙翔精密仪器厂;DG120型粉碎机 浙江省瑞安市飞达药材器械厂;HH-2恒温水浴锅 常州国华电器有限公司;722E可见分光光度计 上海光谱仪器有限公司;HH恒温水浴锅 江苏金坛中大仪器厂;GZX-9070MBE电热恒温鼓风干燥箱 上海博讯实业有限公司医疗设备厂;GL-21M高速冷冻离心机 湘麓离心机仪器有限公司。
1.2 实验方法
1.2.1 红花籽基本成分的测定 红花籽经去壳、粉碎,然后进行基本成分的测定。水分含量测定:直接干燥法;灰分含量测定:重量法;蛋白质含量的测定:凯氏定氮法;脂肪含量的测定:索氏提取法[11]。
1.2.2 游离油和水解蛋白的提取 将红花籽烘干后粉碎过筛,称取红花籽10 g,以1︰5(w/v)的比例与水混合后,调至pH为8.8,在温度为55 ℃下将水解蛋白酶加入碱提取液,搅拌酶解一定时间后,直接升温灭酶(85 ℃,10 min),趁热离心(3000 r/min,20 min)后得到四层:游离油、乳状液、水解液和渣[13]。
1.2.3 红花籽水解蛋白液水解度的测定 采用茚三酮比色法[12]。
1.2.3.1 标准曲线的制作 取100 mg甘氨酸配成1000 mg/L甘氨酸溶液,再取2 mL加蒸馏水定容到100 mL,使得其溶液浓度为20 μg/mL,然后取0、0.1、0.2、0.3、0.4、0.5、0.6、0.8、1 mL加1 mL显色剂茚三酮,加1 mL pH=8的缓冲液,摇匀后沸水水浴15 min,进行显色反应,冷却后加入5 mL 40%乙醇溶液,然后于波长为570 nm处测定其吸光度值,以蒸馏水为空白,根据测定值绘制标准曲线。
1.2.3.2 样品的测定 取水解蛋白液稀释到一定范围后取4 mL,同标准曲线制作的方法,在570 nm处测出吸光度,通过标准曲线方程得到蛋白质含量。
水解度DH(%)=(蛋白质的毫克数/1000×样品蛋白质量)×水解液的总体积×(100/显色时稀释液的体积)×100
式(1)
1.2.4 碱提条件的选择 将与水混合后的红花籽,用NaOH调至pH8.5,在温度为30、40、50、60、70 ℃条件下,碱提60 min,以游离油得率和水解蛋白得率为标准选出最佳的碱提温度。将与水混合后的红花籽,用NaOH调至pH8.5,在温度为60 ℃下,碱提30、60、90、120、150 min,以游离油得率和水解蛋白得率为标准选出最佳的碱提时间。

式(2)
式(3)
1.2.5 筛选最适合的酶及组合 在pH为8.8、温度为55 ℃、酶解时间是3 h条件下得到提取液进行酶水解。按表1四组酶分别水解后离心,测定游离油得率,选出最佳酶组合。
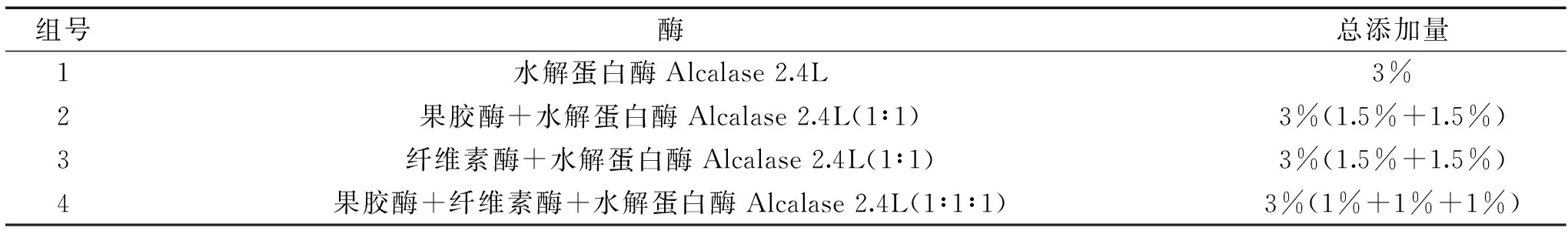
表1 酶的筛选Table 1 Screening for enzymes
1.2.6 酶解单因素实验 酶解时间对酶解效果的影响:在酶解温度55 ℃,酶总添加量3%,pH为8.5,料液比(w/w)为1∶5的条件下,设定其酶解时间为1、2、3、4、5 h,以游离油得率和水解蛋白得率为指标,研究酶解时间对其酶解效果的影响;酶添加量对酶解效果的影响:在酶解时间为3 h,酶解温度为55 ℃,pH为8.5,料液比(w/w)为1∶5的条件下,设定果胶酶、纤维素酶、水解蛋白酶组合,比例为1∶1∶1,每种酶添加量为0.5%、1%、1.5%、2%、2.5%,以游离油得率和水解蛋白得率为指标,研究酶添加量对酶解效果的影响;料液比对酶解效果的影响:在酶解温度为55 ℃,酶总添加量4.5%(1∶1∶1),pH为8.5,酶解时间为3 h的条件下。设定其料液比为1∶4、1∶5、1∶6、1∶7、1∶8(w/w),以游离油得率和水解蛋白得率为指标,研究料液比对酶解效果的影响。
1.2.7 正交实验设计 在酶解温度55 ℃,酶解pH为8.5下,以酶解时间、酶添加量、料液比为单因素设计三因素三水平的正交表L9(34),其中酶添加量采用水解蛋白酶、纤维素酶和果胶酶三种酶不同比例的添加。

表2 正交实验因素水平表Table 2 Factors and levels of orthogonal test
1.2.8 最适破乳方法的选择 按1.2.2的工艺提取后离心分四层,第二层乳化层中含有大部分的油脂,在对乳化层的成分进行研究后,采用以下三种方式破乳以提高油得率;冷冻破乳:取乳化层,放入冰箱冷冻(-18 ℃)24 h,取出后室温解冻3 h,8000 r/min离心15 min;静置破乳:取乳化层,放在室温静置30 h,后8000 r/min离心15 min;加热破乳:取乳化层,放在沸水中加热10 min,后8000 r/min离心15 min;取最佳破乳方法下的乳化层,在不同离心速率(6000、8000、10000 r/min)离心15 min后,根据其破乳率挑选出最好的离心速率。
乳状液的破乳率(%)=破乳离心后得到的油质量/乳状液所含油质量×100
式(4)
1.3 数据分析
每个实验点平行三次,并用Excel数据处理软件求出平均值。酶解时间、酶总添加量、料液比对游离油得率和水解蛋白得率的影响采用SPSS 13.0分析软件进行处理。
2 结果与分析
2.1 红花籽成分分析
由表3可知,红花籽中含有较多的蛋白质和油脂,去壳后的红花籽蛋白质和油脂含量更高,红花籽中的蛋白质、油脂和水在摇晃、搅拌中形成乳化层,而这层乳化层中含有一定的油脂,所以破乳很有必要。酶解升温灭酶后离心,在高温的状态下可以减少乳化层。

表3 红花籽成分表Table 3 Main components of safflower seeds
2.2 水解蛋白液中蛋白质测定的标准曲线
根据1.2.3采用茚三酮比色法测定水解蛋白液的水解度,根据蛋白质的吸光度绘制其标准曲线。
由图1可以得到其线性回归方程为y=0.0069x+0.0024(R2=0.9998)。

图1 水解蛋白液蛋白质标准曲线Fig.1 Hydrolysate standard curve
2.3 碱提条件的选择
2.3.1 碱提温度对得率的影响 结果见图2。
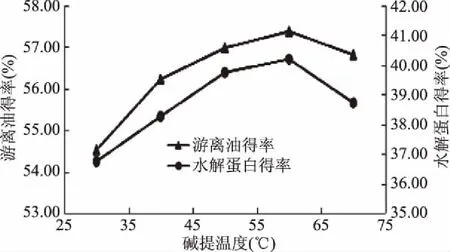
图2 碱提温度对游离油得率和水解蛋白得率的影响 Fig.2 The oil and hydrolyzed protein at alkali mention temperature
由图2可以看出,碱提温度为60 ℃时,游离油得率和蛋白质得率最高,游离油得率和水解蛋白得率在30~60 ℃之间随温度的升高得率在不断增加,在温度60 ℃后,由于温度的改变蛋白质变性,游离油和水解蛋白得率随温度的变化而减小,因此碱提温度不能太高,应该在60 ℃左右。此时游离油得率为57.38%,水解蛋白得率为40.19%。
2.3.2 碱提时间对得率的影响 将与水混合后的红花籽,按照1.2.4方法研究碱提时间对游离油得率和水解蛋白得率的影响,结果见图3。

图3 碱提时间对游离油得率和水解蛋白得率的影响Fig.3 The oil and hydrolyzed protein at different time
由图3可以看出,在碱提时间30~60 min时,游离油得率和水解蛋白得率随时间的增加而增加,但到60 min后游离油得率基本保持不变,为了提高实验的效率,选定碱提60 min为最佳碱提条件。此时游离油得率为57.28%,水解蛋白得率为40.29%。
2.4 酶的筛选
将在1.2.2条件下得到的碱提取液,加入不同的酶,添加量按表1,测定其游离油得率和水解蛋白得率,结果见图4。
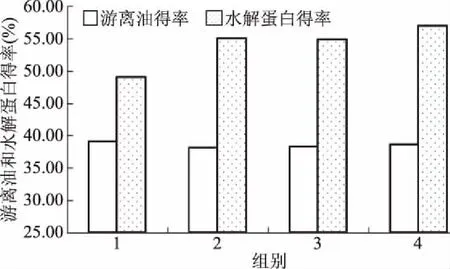
图4 酶的筛选Fig.4 Screening for enzymes
由图4可以看出,在加酶总量相同,酶解时间、酶解温度、pH相同的情况下,三种不同的酶及其不同的酶组合方式,果胶酶、纤维素酶、水解蛋白酶共同作用下的游离油得率最高。单独使用水解蛋白酶Alcalase 2.4L时水解蛋白得率最高,但游离油得率很低,果胶酶有降解果胶大分子的作用,纤维素酶能降解细胞壁,使油脂游离出来,所以加了纤维素酶和果胶酶之后能更好的降解细胞壁,使油得率提高,故实验选用酶总添加量3.0%(果胶酶1%+纤维素酶1%+水解蛋白酶Alcalase 2.4L1%)。此时的游离油得率为57.05%,水解蛋白得率为38.73%。
2.5 酶解单因素实验
2.5.1 酶解时间对酶解效果的影响 研究不同酶解时间对酶解效果的影响,结果见图5。
图5 酶解时间对游离油得率和水解蛋白得率的影响Fig.5 The oil and hydrolyzed protein at hydrolysis time
由图5显示,在酶解时间1~3 h之间游离油得率不断的升高,水解蛋白得率也随时间增长得率越高,在3 h后油得率基本不变,水解蛋白得率在小幅度的升高,水解时间越长,变化不大,在一定时间后酶解越完全,但酶解时间过长会降低油品质,所以选择最佳的酶解时间为3 h。此时的游离油得率为57.52%,水解蛋白得率为39.81%。
2.5.2 酶总添加量对酶解效果的影响 研究不同复合酶总的添加量对酶解效果的影响,结果见图6。
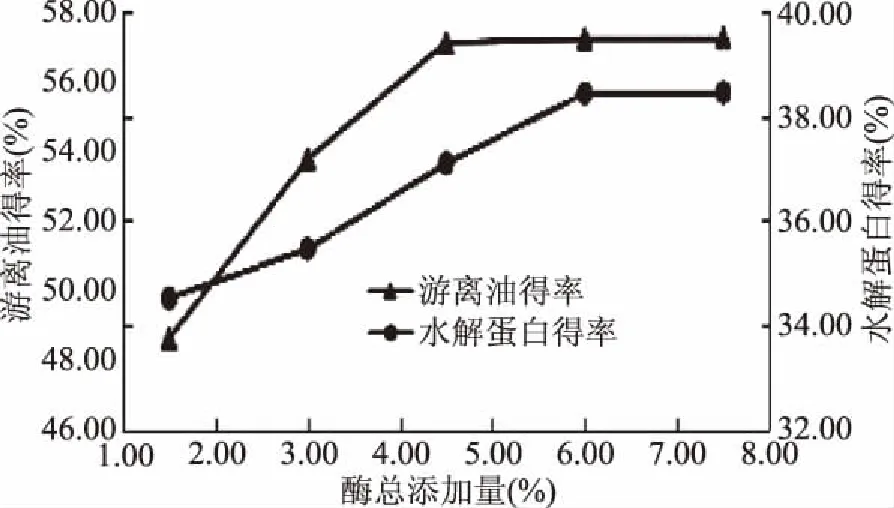
图6 酶总添加量对游离油得率和水解蛋白得率的影响Fig.6 The oil and hydrolyzed protein at the enzyme addition
由图6显示,随着每种酶加量的不断增加游离油得率和水解蛋白得率在不断的提高,游离油得率在酶总添加量到4.5%时基本增加幅度变小,水解蛋白得率在酶总添加量达到6%以后也基本保持不变,酶加量越大,就与底物作用的越完全,但到一定的量后,水解蛋白得率和游离油得率增加量变小,因为底物量一定,已经达到充分酶解,考虑到酶的成本和结合得率的增长情况,故选用酶总添加量为4.5%。此时的游离油得率为57.11%,水解蛋白得率为37.09%。
2.5.3 料液比对酶解效果的影响 研究不同料液比对酶解效果的影响,结果见图7。

图7 料液比对游离油得率和水解蛋白得率的影响Fig.7 The oil and hydrolyzed protein at the different solid liquid ratio
由图7显示,游离油得率在料液比1∶5时达到最大值,在这之后游离油得率逐渐减少,水解蛋白得率也在1∶5后逐渐保持不变。在料液比1∶3~1∶4之间,水量较少,底物和酶不能完全接触,酶反应被限制,但当水量逐渐增加时,底物浓度会降低,反应也会跟着变慢,故选用料液比1∶5为最佳的料液比。此时的游离油得率为57.43%,水解蛋白得率为39.40%。
2.6 正交实验
在酶解温度55 ℃,酶解pH为8.5下,选酶解时间、酶总添加量、料液比为单因素设计三因素三水的正交实验,结果见表4。

表4 正交分析结果表Table 4 Design and result of orthogonal experiment
从表中数据可以看出,以游离油得率为标准分析,影响因素主次依次是酶解时间、料液比、酶添加量,最优方案为A2B2C2,即酶解时间为3 h,酶总量为4.5%,料液比为1∶5。游离油得率为57.89%,以水解蛋白得率为标准分析,影响因素主次依次是酶添加量、料液比、酶解时间,最优方案为A3B3C3,即酶解时间为4 h,酶总添加量为6%,料液比为1∶6。水解蛋白得率为41.08%,方差分析结果见表5和表6。

表5 游离油得率正交方差分析Table 5 Orthogonal test analysis of the oil

表6 水解蛋白得率正交方差分析Table 6 Orthogonal test analysis of the hydrolyzed protein
由表5可以看出,酶解时间对游离油得率有极显著影响,方差分析和极差分析结论相同。
由6表可以看出,酶添加量对水解蛋白得率有显著影响,方差分析和极差分析结论相同。
2.7 验证实验
根据单因素实验和正交实验结果,综合考虑酶的成本,选定在酶解温度55 ℃,酶解pH为8.5、酶解时间3 h,酶总添加量为4.5%,料液比为1∶5条件下进行验证实验,三组验证实验结果游离油得率分别为58.06%、58.31%、58.27%,水解蛋白得率分别为41.36%、41.26%、41.33%,平均值为游离油得率为58.21%,相对误差为0.55%,水解蛋白得率为41.32%,相对误差是0.58%,与正交实验中所得实验值较为接近,证明此优化方法可行。
2.8 破乳方法的研究
2.8.1 乳状液成分分析 结果见表7。

表7 乳状液成分表Table 7 The components of the emulsion
由表7可知:乳状液所含油脂占24.82%,含油量较高,蛋白质含量较少。可能是红花籽中含有的天然蛋白质有稳定乳状液的作用,这对破乳来说增加了破乳的难度,不易破乳。
2.8.2 破乳方法的确定 结果见表8。

表8 破乳率分析Table 8 The analysis of the demulsification rate
由表8可以看出,冷冻破乳效果更好,然后是加热破乳,加热破乳和冷冻破乳都是改变乳状液的温度,改变了乳状液的稳定性,静置破乳时油滴上浮,但耗时太久,时间久后会改变油的品质,故选用冷冻破乳,此时破乳率约为35.28%。
2.8.3 破乳离心转速的确定 取经过冷冻破乳后的乳化层经不同转速离心,得到如表9结果。

表9 离心转速对破乳率的影响分析Table 9 The analysis of effects of rotational speed on the demulsification rate
离心后的乳化层,放入冰箱冷冻24 h,取出后室温解冻3 h,10000 r/min离心15 min,最后的破乳率约为35.28%。由表中数据可以看出随着离心转速的升高,破乳率逐渐提高,但在8000~10000 r/min之间变化不是特别大。但从破乳率考虑选择8000 r/min离心15 min。与之前游离油合并,此时的油得率为63.94%。
3 结论与讨论
本实验采用水酶法同时酶解制备红花籽油和水解蛋白粉,在选出最佳的碱提温度和时间后,通过对酶制剂的筛选,最终确定用果胶酶1%+纤维素酶1%+水解蛋白酶Alcalase 2.4L1%为实验酶。采用单因素实验和正交实验对酶用量、酶解时间、料液比进行优化,最终兼顾酶的成本,选定在碱提温度为60 ℃,碱提时间60 min后加入果胶酶、纤维素酶、水解蛋白酶Alcalase 2.4L比例为1∶1∶1,酶总添加量为4.5%,料液比为1∶5,酶解3 h后进行高温灭酶(85 ℃灭酶10 min),离心得游离油、水解液、乳化层、渣,通过测定和计算得到此时的游离油得率为58.21%,水解蛋白得率为41.32%。将酶解后的乳状液进行破乳,对静置破乳、冷冻破乳、加热破乳三种方法进行比较后选出最佳的破乳方法为冷冻破乳,将乳化层冷冻后离心,选出最佳的离心速率为8000 r/min,此时的破乳率为35.28%。将破乳后的油与游离油合并得到油得率为63.94%。
与传统法相比,水酶法具有设备简单、操作温度低,无需脱除溶剂,可以同时提取水解蛋白等优点,随着生物技术的发展,酶制剂价格的下降,对减少环境污染要求的提高,水酶法从红花籽中提取油脂与水解蛋白的工艺将具有广泛的应用前景。
[1]胡爱军,孙连立,郑捷,等. 超声波促进水酶法提取红花籽油工艺研究[J].粮食与油脂,2012,25(7):20-22.
[2]刘志国,王华林,王丽梅,等. 多不饱和脂肪酸对神经细胞保护作用的研究进展[J].食品科学,2016,37(7):239-248.
[3]张学鹏,田少君,朱玲. 红花籽油微胶囊的制备及性质研
究[J]. 河南工业大学学报:自然科学版,2012,33(6):27-30.
[4]李倩,赵丽,马媛,等. 水酶法提取红花籽油工艺的研究[J]. 食品与发酵科技,2016,52(1):52-59.
[5]李大房,马传国. 水酶法制取油脂研究进展[J]. 中国油脂,2006,31(10):29-32.
[6]王英瑶,王璋. 水酶法从花生中提取蛋白质与油[J]. 无锡轻工大学学报,2003,22(4):60-65.
[7]盛小娜,王璋,许时婴. 水酶法提取甜杏仁油及水解蛋白的研究[J]. 中国油脂,2007,32(11):26-30.
[8]李天兰. 水酶法提取核桃油及多不饱和脂肪酸富集研究[D]. 乌鲁木齐:新疆农业大学,2013.
[9]江连洲,李杨,王妍,等. 水酶法提取大豆油的研究进展[J]. 食品科学,2013,34(9):346-350.
[10]张靖楠,曹阳,邱树毅,等. 水酶法提取菜籽油预处理新工艺研究[J]. 食品科技,2010(10):230-232.
[11]大连轻工业学院. 食品分析[M]. 北京:中国轻工业出版社,1994.
[12]赵新淮,冯志彪. 蛋白质水解物水解度的测定[J]. 食品科学,1994,15(11):65-67.
[13]罗明亮,申爱荣,蒋丽娟. 生物酶的选择对水酶法提取蓖麻油的影响[J]. 中南林业科技大学学报,2013,33(9):55-59.
[14]李杨,冯红霞,王欢,等. 超声波辅助水酶法提取红花籽油的工艺研究[J]. 中国粮油学报,2014,29(7):63-67.
[15]刘贺,庚平,张娟,等. 响应面设计优化水酶法提取火麻仁油工艺参数[J]. 中国粮油学报,2014,29(4):62-67.
[16]Sajid Latif,Farooq Anwar. Aqueous enzymatic sesame oil and protein extraction[J]. Food Chemistry,2011,125(2):679-684.

