利用大豆油脱臭馏出物酶法合成植物甾醇酯
林惠颖,辛嘉英,2,*,么婷婷,韩 雪,陈书明
(1.哈尔滨商业大学,食品科学与工程重点实验室,黑龙江哈尔滨 150076; 2.中国科学院,兰州化学物理研究所,羰基合成与选择氧化国家重点实验室,甘肃兰州 730000; 3.山西农业大学动物科技学院,山西太谷 030801)
植物甾醇,是植物体中一种类环状醇结构的生物活性物质,具有降低机体胆固醇水平、保护心血管[1],预防冠状动脉粥样硬化作用。同时其较高的渗透性可保持皮肤水分,促进皮肤新陈代谢、抑制皮肤炎症等。但其脂溶性和水溶性有限,反应活性较差,反应时需要大剂量进行,因而限制了其应用发展[2]。与游离的植物甾醇相比,植物甾醇与脂肪酸酯化而成的植物甾醇酯具有较好的溶解性和兼容性[3],因而在医药、食品、化妆品等领域广泛应用。
大豆油脱臭馏出物(SODD)是大豆油精炼加工工序中利用油脂中嗅味物质与脂肪酸甘油酯高温下挥发程度的差异,水蒸气蒸馏收集得到的物质[4],其中富含游离脂肪酸、植物甾醇、生育酚、甘油酯以及其他物质。大豆经处理加工后,脱臭馏出物很难利用,而且一定程度上对环境造成了污染,然而经适当的分离处理得到的植物甾醇和脂肪酸是酯化合成植物甾醇酯的理想原料,同时为植物甾醇酯的绿色合成、大豆油脱臭馏出物的合理利用提供了新的思路。
近年来,植物甾醇酯的生理功能及保健功效逐渐被人们熟知,对富含植物甾醇酯的功能性食品的需求也越来越高。传统的植物甾醇酯的制取主要采用化学合成法,如酯交换法、羧酸直接酯化法、酸酐酯化法以及羧酸酰氯酯化法等,但化学法合成植物甾醇酯反应温度较高,副产物较多;此外,也可以利用酶催化法合成植物甾醇酯,其催化反应条件较温和,副产物较少,易于产物的分离纯化,但需要选择合适的有机溶剂同时提高酶的稳定性,提高生产效率。
本文从大豆油脱臭馏出物中分离得到植物甾醇和脂肪酸,利用生物酶法催化合成植物甾醇酯,但由于酶在有机试剂中溶解度较差,且易结块,因此将酶固定在适当载体上,提高酶在有机相中的催化性能和热稳定性,同时有利于酶的回收。
1 材料与方法
1.1 材料与仪器
大豆油脱臭馏出物 九三豆油公司提供;丙酮、甲醇、正己烷 分析纯,天津渤海化工股份有限公司;氢氧化钠、氢氧化钾 分析纯,天津富宇精细化工有限公司;硅藻土、活性炭、大孔树脂HP20 日本三菱化成公司;薄层层析硅胶 青岛海洋化工厂;柱状假丝酵母酵母脂肪酶CRL Sigma公司;植物甾醇标品 浙江大为药业有限公司;油酸标品 天津渤海化工股份有限公司。
BSA220S-CW型精密天平 Sartorius公司;KH-2000型薄层色谱仪 上海科贺生化科技有限公司;C97951型红外光谱仪 Sartorius公司;RV8V型旋转蒸发仪 德国IKA公司;UV-2550型紫外-可见分光光度计 上海一恒科技有限公司;HL-2S型恒流泵 上海沪西分析仪器厂有限公司。
1.2 实验方法
1.2.1 大豆油脱臭馏出物的酶法水解 称取5 g脱臭馏出物,加入到25 mL带塞磨口锥形瓶中,加入30%的水,恒温预热并摇匀。然后加入25 U/g底物的假丝酵母脂肪酶(CRL),摇匀,使其充分混合,将锥形瓶置于恒温摇床中,45 ℃,200 r/min,反应12 h。反应结束后,反应液置于水浴中高温灭酶并破乳,过滤去除脂肪酶。待油水两相明显分层后,用滴管吸取上层油相,甘油经水洗分层去除。
1.2.2 溶析冷却结晶法提取植物甾醇 在水解后脱臭馏出物中,加入一定比例的丙酮-甲醇混合溶剂,溶剂与原料以一定的比例混合,在50 ℃的水浴中溶解。30 min后混合均匀,冷却至室温。在-20 ℃的冰箱中冷却结晶一定的时间后,取出迅速抽滤,用有机溶剂洗涤甾醇粗品来精制,在一定温度热水浴中浸泡一段时间,抽滤,可将甾醇酯完全除去[5]。滤饼真空干燥,滤液收集。分别设置丙酮-甲醇比为4∶1、2∶1、1∶1、1∶2、1∶4 (V/V),溶剂原料比1∶1、2∶1、3∶1、4∶1、5∶1 (V/W)以及甲醇、乙醇、丙酮、正己烷四种洗涤剂,考察不同溶剂比、溶剂原料比以及洗涤剂对甾醇得率的影响,计算公式如下

1.2.3 甾醇红外光谱分析 称取0.25 g溴化钾置于100 ℃烘箱中充分干燥,随后置于研钵中充分研磨,将研磨后的溴化钾放入压片机中压片,进行背景扫描。取少量甾醇置于溴化钾中充分研磨,压片,将制备得到的样品置于红外光谱中,4000~500 cm-1范围内扫描,进行红外分析。
1.2.4 脂肪酸的分离提取 将上一步收集的滤液旋转蒸发,除去有机溶剂。然后称取5 g,用0.5 mol/L的氢氧化钾-乙醇溶液在室温下皂化24~48 h(加入过量氢氧化钾),直到油滴完全消失为止[6]。真空抽滤,除去不皂化物,可将甾醇酯完全除去,加入1 mol/L浓盐酸溶液至pH为2,用正己烷(5~10 mL)萃取脂肪酸,用分液漏斗除去水相,用旋转蒸发仪将正己烷除去,即得到脂肪酸[6]。
1.2.5 脂肪酸红外光谱分析 取少量脂肪酸置于制备好的溴化钾中充分研磨、压片,红外光谱分析检测,具体操作同1.2.3。
1.2.6 CRL脂肪酶的固定 CRL脂肪酶溶于一定量的正己烷中,并加入一定量的载体[7-8](硅藻土、分子筛粉末、活性炭粉末、柱层析硅胶及大孔树脂,酶粉∶载体=1∶10,W/W),80 r/min、30 ℃条件下吸附1 h,过滤,用缓冲溶液冲洗3遍,收集滤液,抽滤,40 ℃除水干燥。固定化的酶及滤液在0~4 ℃冰箱中储存,备用[9-10]。
1.2.7 担载率和酶活力的测定 将磷酸缓冲溶液固定化酶过程中的滤液(包括洗涤固定化酶的缓冲液)稀释十倍,用紫外-可见分光光度计测定CRL酶溶液280 nm下的吸光值,以确定其蛋白含量。计算公式如下:
担载率(%)=(固定化之前酶溶液蛋白含量-固定化之后残液蛋白含量)/固定化之前酶溶液蛋白含量×100
采用橄榄油乳化法,以空白样组作对照。水解橄榄油每分钟产生1 μmol游离的脂肪酸定义为一个酶活力(U)。
1.2.8 植物甾醇酯的酶法合成 合成大豆油脱臭馏出物中分离得到的脂肪酸1 g,分离得到的植物甾醇0.5 g,加入一定量的固定化酶,正己烷5 mL,45 ℃,150 r/min摇床反应25 h[9-11]。
1.2.9 植物甾醇酯红外光谱分析 植物甾醇酯置于制备好的溴化钾中充分研磨,压片,红外光谱分析检测,具体操作同1.2.3。
1.2.10 薄层色谱分离鉴定 微量进样器分别吸取油酸标样、脱臭馏出物中提取的脂肪酸、植物甾醇标样、脱臭馏出物中提取的甾醇以及通过酶法合成的植物甾醇酯,点涂在事先制备的层析硅胶与1%羧甲基纤维素钠混合(质量比1∶3)的层析板上,层析展开剂为正己烷∶无水乙醚∶冰乙酸=90∶10∶1 (v/v/v),室温下展开约20 min,晾干,用碘液熏蒸10 min显色,放入薄层色谱扫描仪中进行分析。根据峰面积计算酯化率,公式如下:
酯化率(%)=植物甾醇酯峰面积/(1.643×植物甾醇峰面积+植物甾醇酯峰面积)×100
式中:1.643为甾醇与甾醇酯之间的转换系数(甾醇酯的相对分子质量/甾醇的相对分子质量)。
2 结果与讨论
2.1 影响植物甾醇提取的因素
2.1.1 混合溶剂比例对植物甾醇提取的影响 植物甾醇在丙酮中的溶解度随温度变化较明显,通过降温很容易结晶析出,但色素等杂质也易溶于丙酮且不易析出。因此选用对甾醇溶解度很小的甲醇,与丙酮配成丙酮-甲醇混合溶剂,改善溶解平衡关系和结晶条件。
由于甾醇在甲醇中的溶解度较小,因此在混合溶剂中甲醇比例较大时,甾醇的析出量较少,混合溶剂中丙酮的比例逐渐增大,甾醇的析出量逐渐增多,当混合溶剂中甲醇与丙酮比例为1∶2 (V/V)时,甾醇析出量达到最大,但当混合溶剂中丙酮的比例继续增加时,甾醇的析出量逐渐减少,直至没有甾醇析出,这是因为丙酮对甾醇的溶解度较大,混合溶剂中丙酮的比例过大时,甾醇全部溶解于丙酮中,无法冷却结晶析出,结果如图1所示,因此,混合溶剂中甲醇与丙酮最佳比例为1∶2 (V/V)。
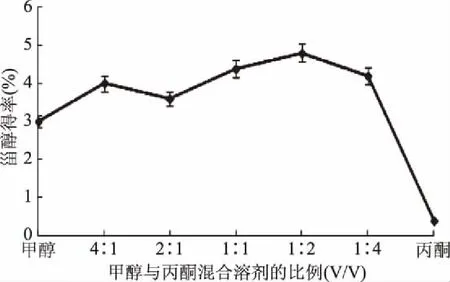
图1 混合溶剂对甾醇得率的影响Fig.1 The effect of the ratio of mixed solvent on the extraction of phytosterol
2.1.2 溶剂原料比对甾醇提取的影响 随着溶剂的比例逐渐加大,甾醇的析出量逐渐增加,在溶剂原料比为3∶1 (V/W)时,甾醇析出量达到最大;但当溶剂的比例继续增加时,甾醇的析出量反而逐渐减少。这可能是因为溶剂用量较小时,原料酶解液粘度仍然很大,处于过度饱和的状态,对植物甾醇的结晶产生一定的阻碍,植物甾醇结晶速度慢[12]。然而,当溶剂用量过大时,原料酶解液粘度降低了,过饱和程度降低,结晶和除杂效果很好,但甾醇被溶解的量增多,同时对甾醇也有一定的损耗,结果如图2所示,因此,溶剂原料比为3∶1 (V/W)为提取甾醇的最优条件。
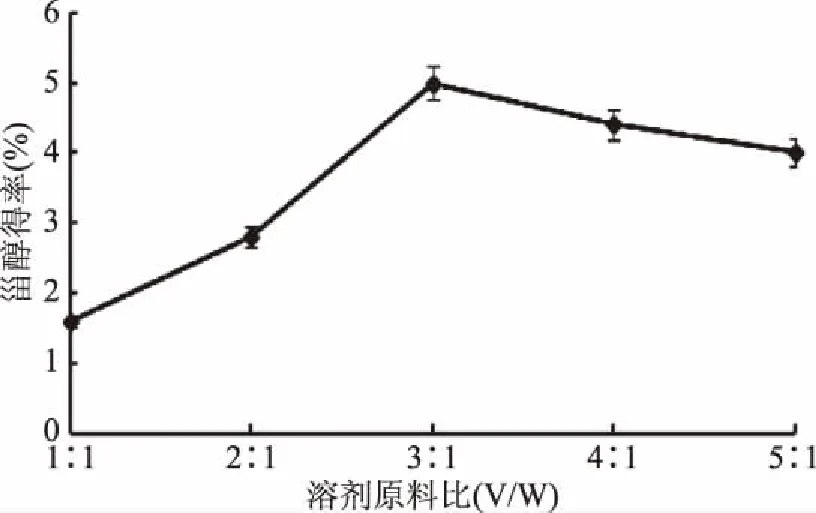
图2 溶剂原料比对甾醇得率的影响Fig.2 The effect of the ratio of solvent to material on the extraction of phytosterol
2.1.3 粗甾醇洗涤剂对甾醇提取的影响 洗涤植物甾醇要求溶剂要对色素等杂质的溶解度大,对植物甾醇的溶解度小。本实验选择了正己烷、甲醇、乙醇和丙酮这几种常见的有机溶剂作为洗涤溶剂。结果如图3所示,在相同条件下,经正己烷洗涤的甾醇析出量最大,而丙酮洗涤后几乎没有甾醇析出,这是因为甾醇溶解于丙酮中。因此,洗涤粗甾醇的最佳溶剂为正己烷。

图3 粗甾醇洗涤剂对甾醇得率的影响Fig.3 The effect of detergent on the extraction of phytosterol
2.2 植物甾醇的红外定性分析
在最优提取条件下(甲醇-丙酮混合溶剂的比例为1∶2 (V/V),溶剂原料比为3∶1 (V/W),洗涤粗甾醇的溶剂为正己烷)提取大豆油脱臭馏出物中的植物甾醇,与植物甾醇标样对照,结果如图4所示。参考文献[13-14]可知,-OH的伸缩振动峰出现在3700~3200 cm-1,图4分离产物的红外图谱中,3367 cm-1处存在植物甾醇特征吸收峰-OH,且与植物甾醇标准品对照相比,大体一致,-OH特征峰出峰位置大体相同,因此初步确定大豆油脱臭馏出物中分离提取得到的样品可能为植物甾醇。
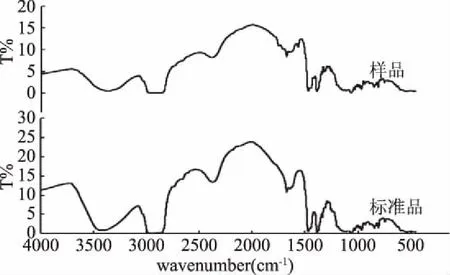
图4 植物甾醇标样与提取的甾醇红外图谱对比Fig.4 The FTIR contrast of standard sample of phytosterol and extracted phytosterol
2.3 脂肪酸的红外定性分析
对大豆油脱臭馏出物中提取的脂肪酸做红外光谱分析,以油酸的红外图谱作对照。如图5所示,大豆油脱臭馏出物中的脂肪酸主要为不饱和脂肪酸:油酸、亚油酸,与油酸标准品红外图进行比对基本一致,且1725~1750cm-1范围内没有酯键的官能团特征峰[15]。

图5 油酸标样与提取的脂肪酸红外图谱对比Fig.5 The FTIR contrast of standard sample of oleic acid and extracted fatty acid
2.4 CRL脂肪酶的固定化
选用5种载体分别在正己烷中进行CRL脂肪酶的固定化处理,测定了不同条件下载体对脂肪酶的固载情况即担载率以及固定化酶的酶活,结果如图6、图7所示。
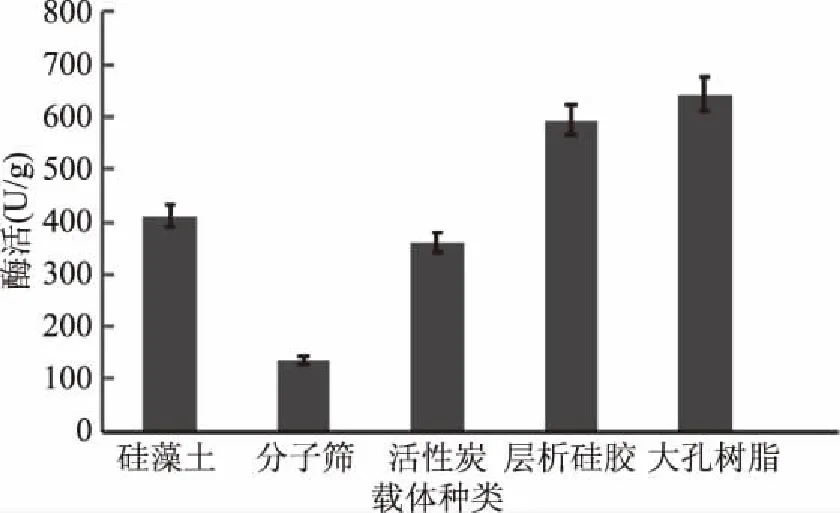
图6 不同载体固定化酶的担载率Fig.6 The immobilization degree of different carriers

图7 不同载体固定化酶的酶活力Fig.7 The enzyme activity of different carriers
脂肪酶在有机相中与水相中不同,脂肪酶不溶于有机试剂,载体表面形成的水膜促使脂肪酶只能存在于载体的水膜内,因此有利于脂肪酶的固定化,这种方法也被称为游离固定化[16-17],即不需要通过任何的键合手段就可以将脂肪酶固定在载体表面上。此外,几种载体中大孔树脂固定化酶的担载率最高,且酶活力相对较高,因此选用大孔树脂固定CRL脂肪酶。
2.5 植物甾醇酯的合成
从大豆油脱臭馏出物酶解液中经溶析冷却结晶提取植物甾醇,与之后从提取植物甾醇后的滤液中分离得到的脂肪酸,在大孔树脂固定化酶的催化作用下酯化反应。
2.5.1 红外光谱分析 图8酯化产物的红外光谱中,4000~3000 cm-1范围内不存在-OH的伸缩振动[13-14],意味着经酯化反应的分离操作后,产物中不存在游离的植物甾醇。1725~1750 cm-1为酯键的官能团特征吸收峰[15],不难发现在酯化产物光谱的1734 cm-1处新出现了很明显的吸收峰,为酯键的特征峰,由此可以判定产物中有酯键,结合薄层色谱的分析结果,确定产物为植物甾醇脂肪酸酯。
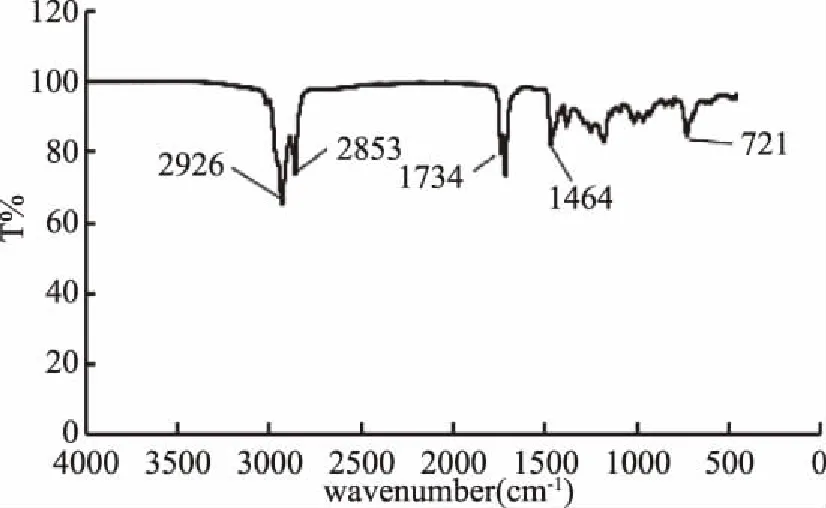
图8 酶法合成的植物甾醇脂肪酸酯的红外图谱Fig.8 The FTIR result of enzymatic synthesized phytosterol ester
2.5.2 薄层色谱分析 图9所示,大豆油脱臭馏出物中提取的脂肪酸和植物甾醇在薄层硅胶板上与油酸和植物甾醇的标样出现的位置大体一致,Rf值相同,可确定提取物与标样为同种物质。植物甾醇脂肪酸酯反应液位置在薄层硅胶板最上方部位有新的物质出现,由于植物甾醇酯Rf值要大于反应底物脂肪酸和植物甾醇,且植物甾醇酯的扩散速度比反应底物脂肪酸和植物甾醇快,因此初步判定出现的新物质为植物甾醇脂肪酸酯。而在提取的脂肪酸和植物甾醇位置上方没有与植物甾醇酯Rf值相同的物质出现,这也表明了从大豆油脱臭馏出物中提取的脂肪酸和植物甾醇纯度较好,没有植物甾醇酯的存在。而且不难发现,酯化反应后,薄层硅胶板上底物的颜色变浅、面积变小,底物大部分已经被反应,但因在实验中脂肪酸的含量相对植物甾醇过量,因此有一些脂肪酸残留,经计算酯化率为45.11%。

图9 反应液薄层色谱图Fig.9 The TLC result of sample注:1.油酸标样;2.脱臭馏出物中提取的脂肪酸; 3.植物甾醇标样;4.脱臭馏出物中提取的甾醇; 5.脱臭馏出物中提取的脂肪酸和 甾醇通过酶法合成的植物甾醇脂肪酸酯。
3 结论
从大豆油脱臭馏出物酶解液中经溶析冷却结晶提取植物甾醇,考察了混合溶剂比例、溶剂原料比、洗涤粗甾醇的溶剂对植物甾醇提取的影响,确定最佳提取工艺为:甲醇-丙酮混合溶剂的比例为1∶2 (V/V),溶剂原料比为3∶1 (V/W),洗涤粗甾醇的溶剂为正己烷。然后再从提取植物甾醇后的滤液中分离得到脂肪酸,并选用大孔树脂作为载体的固定化酶催化,两者进行酯化反应合成植物甾醇酯。根据薄层色谱鉴定,初步判定酯化反应有新的物质生成,再用红外光谱分析,产物红外图谱中,1734 cm-1处存在酯键的官能团特征吸收峰,证明了从脱臭馏出物中提取的植物甾醇和脂肪酸,在非水相中经脂肪酶催化合成产物为植物甾醇酯[18-20],可用于日后食品、医疗、化妆品等各个方面。
[1]张蕾,陈庆森,阎亚丽,等.植物甾醇对心血管疾病作用的研究现状[J].食品科学,2013,23(2):344-350.
[2]左玉.植物甾醇研究与应用[J].粮食与油脂,2012,5(7):1-4.
[3]许新德,邵斌.植物甾醇酯——一种新型的健康食品[J]. 食品添加剂,2004,29(8):25-28.
[4]雷炳福.油脂脱臭馏出物的组成与市场前景[J].中国油脂,2002,1(3):75-78.
[5]徐水祥,周淡宜,徐飞鹤,等. 甲鱼油中多不饱和脂肪酸的提取与纯化研究[J].食品科学,2004,25(11):118-119.
[6]沈彩英.乌贼油中多不饱和脂肪酸的提取[J].中国油脂,2008,33(2):76-79.
[7]辛嘉英,李树本.脂肪酶的固定化及其在有机酶促反应中稳定性研究[J].分子催化,1999,13(2):103-108.
[8]马玲芝,钱俊青.离子交换树脂固定化脂肪酶催化合成蔗糖乙酯[J].浙江工业大学学报,2012,40(1):21-24.
[9]姜德生,龙胜亚,肖海燕,等.磁性壳聚糖微球的制备及其用作漆酶固定化载体[J].应用化学,2005,22(10):1122-1126.
[10]张琛,张宽朝,章琛,等.海藻酸钠包埋法制备固定化菠萝蛋白酶[J].生物加工过程,2009(6):31-34.
[11]许青青,金文彬,苏宝根,等.植物甾醇酯的化学合成及其分离研究进展[J].中国粮油学报,2014,3(6):120-128.
[12]许文林,沙鸥,钱俊红,等.混合植物甾醇中豆甾醇和β-谷甾醇的高效液相色谱分析[J].分析测试学报,2003,22(6):98-100.
[13]许文林,王岩.β-谷甾醇与马来酸酐酯化产物的表征及高效液相色谱分析[J]. 扬州大学学报,2006,3(9):32-35.
[14]Santas J,Codony R,Rafecas M. Phytosterols:Beneficial effects[J].Natural Products,2013,113(6):3437-3464.
[15]陈舒.植物甾醇酯微波加热合成的研究[D]. 西安:西安理工大学,2007.
[16]刘振春,孙慧娟.脂肪酶催化共轭亚油酸植物甾醇酯合成工艺的优化[J]. 西北农林科技大学学报,2014,42(6):173-179.
[17]陈陶声,居乃琥,陈石根,等.固定化酶理论与应用[M].北京:轻工业出版社1987:98-102.
[18]于殿宇,王腾宇,陈昊,等.生物酶法合成植物甾醇酯的研究[J].食品工业科技,2011,32(6):318-393.
[19]Villeneuve P,Turon F,Caro Y,et al.Lipase-catalyzed synthesis of canola phytosterolsoleate esters as cholesterol lowering agents[J]. Enzyme&Microbial Technology,2005,37(1):150-155.
[20]W He,C Jia.Lipase-catalyzed synthesis of phytostanyl esters in non-aqueous media[J]. Journal of Molecular Catalysis BEnzymatic,2010,7(6):60-65.

