NEDD9表达变化与神经胶质瘤的恶性表型及不良预后的关系
姜红升,周彩凤,王艳洲,邢晓锋,于金然
(1.沧州市中心医院神经外四科;2.沧州市中心医院教学处,河北 沧州 061000)
神经胶质瘤是最常见的脑肿瘤,也是中枢系统常见的恶性肿瘤,可占到颅内肿瘤的一半左右,常在功能区呈浸润性生长[1]。临床上,常采用手术、放化疗或综合治疗等手段对神经胶质瘤进行治疗,以手术为主要治疗手段,但手术治疗很难一次性彻底完整切除,尤其对恶性程度高的神经胶质瘤,其预后仍不理想,复发率较高,患者生存期较短[2]。神经元细胞表达发育下调基因9(NEDD9)属于一种局灶性粘附骨架蛋白,最早在期胚胎小鼠的大脑组织中被发现,在细胞的分化、转移及凋亡中起重要作用,在调节蛋白复合物,控制细胞转移、趋化、调亡、细胞周期和分化中起重要的作[3]。相关研究[4]表明,NEDD9的高表达与大脑胶质瘤、皮肤黑色素瘤及乳腺癌等多种肿瘤的不良预后有密切关系。本研究通过分析NEDD9表达变化与神经胶质瘤的恶性表型及不良预后的关系,为寻找胶质瘤新标志物奠定基础,为临床客观、准确判断患者预后提供理论依据。
1 资料与方法
1.1 一般资料
选取2010年10月至2012年10月沧州市中心医院收治的神经胶质瘤患者100例作为研究对象,纳入标准:(1)符合神经胶质瘤诊断标准[5];(2)患者均为首次手术治疗,Ⅲ~Ⅳ级胶质瘤患者术后给予替莫唑胺辅助化疗;(3)术前未接受放化疗;(4)签署知情同意书。根据病理诊断恶性程度分为低度恶性组(WHO分级为Ⅰ~Ⅱ级胶质瘤)和高度恶性组(WHO 分级为Ⅲ~Ⅳ级胶质瘤),每组各50例,同时收集因重度颅脑外伤患者50例作为对照组。低度恶性组中:男性32例,女性18例,年龄30~68岁,平均(46.24±6.82)岁;高度恶性组中:男性33例,女性17例,年龄32~67岁,平均(45.85±7.36)岁;正常对照组中:男性30例,女性20例,年龄30~69岁,平均(46.16±7.35)岁。各组一般资料比较差异无统计学意义(P>0.05),研究经本院伦理委员会审批并通过。
1.2 方法
1.2.1 样本采集 神经胶质瘤患者手术切除的胶质瘤标本,对照组行内减压而切除的脑组织,置入液氮中冰冻,并存放于-80℃冰箱备存,所有标本都用石蜡包埋。
1.2.2 免疫组化法检测NEDD9表达情况 采用免疫组织化学方法观测脑组织标本中NEDD9的表达,使用切片机(德国Leica公司)将石蜡包埋组织切成4 μm厚度,二甲苯液脱蜡后依次采用95%、90%、85%乙醇水化,蒸馏水浸泡5 min后加入3%过氧化氢溶液50 μL,20 ℃下孵育10 min, PBS冲洗3次,加入50 μL的一抗4 ℃下过夜后,加入二抗20 ℃下孵育10 min,采用DBA试剂盒(美国KPL公司)中的试剂进行显色,放入显微镜下观察,显色后用蒸馏水洗掉,终止显色,采取苏木素复染2 min,中性树胶封片。
1.2.3 NEDD9 mRNA及蛋白表达检测 采用qRT-PCR技术检测脑组织NEDD9 mRNA的表达:(1)从冰箱中取出标本组织20 mg,研磨成粉末状;(2)严格按照Trizol试剂(美国 Invitrogen 公司)说明书提取组织总RNA;(3)采用反转录试剂盒(加拿大Fermentas公司)配置反应混合物,反转录合成环状DNA;(4)荧光实时定量RT-PCR反应反应条件:95 ℃预变性2 min,95 ℃变性15 s, 60 ℃退火30 s,40个循环,相关引物序列(上海生工公司)见表1;(5)PCR产物经EB染色和2%琼脂糖凝胶电泳后,采用紫外分析仪进行观察,并采用HMIAS-2000系统进行定量分析,用NEDD9 mRNA与GAPDH的灰度比值表示NEDD9 mRNA的相对表达水平。采用Western-blot法检测脑组织NEDD9蛋白的表达:(1)采用改良异硫氰酸胍法提取脑组织总蛋白,-70℃下冻存;(2)将40 μg总蛋白溶入等体积的缓冲液中煮沸10 min,经聚丙烯酰胺凝胶电泳进行分离蛋白;(3)将蛋白质转印到硝酸纤维素膜(NC膜)上;(4)NC膜置入封闭液中振荡封闭30 min(室温20℃),漂洗3次(每次30 min)后加入NEDD9抗体和辣根过氧化物酶标记的山羊抗兔IgG稀释液摇匀后,采用免疫荧光增强法(ECL)试剂盒(北京普利莱基因有限公司)检测NEDD9蛋白的表达,同样的方法检测β-actin的表达作为内参照。

表1 NEDD9与GAPDH引物序列表
1.3 评价标准
采用免疫组织化学的方法对脑组织的NEDD9蛋白表达情况进行检测,以阳性细胞数占总数的比率和染色强度进行评分:(1)0分:无阳性细胞;(2)1分:阳性细胞百分比<5%;(3)2分:5%<阳性细胞百分比≤20%。(4)3分:阳性细胞百分比>20%;对染色强度进行评分:(1)0分:无染色;(2)1分:淡黄色;(3)2分:棕黄色;(4)3分:棕褐色。将两者的评分相乘得到总分,并将总分>4分定义为高表达,总分≤4分定义为低表达[6]。
1.4 统计学分析
2 结果
2.1 免疫组织化学法结果比较
免疫组织化学染色实验结果显示,在对照组的脑组织中NEDD9蛋白的表达极低,在低度恶性组和高度恶性组中NEDD9表达较高,且高度恶性组明显高于低度恶性组(图1)。免疫组织化学评分结果显示,对照组、低度恶性组和高度恶性组的NEDD9蛋白评分为1.89±0.42、3.12±1.03、8.12±1.03,对照组<低度恶性组<高度恶性组(P<0.05)。

2.2 各组NEDD9 mRNA及蛋白表达情况
RT-PCR结果显示,对照组、低度恶性组和高度恶性组的NEDD9 mRNA相对表达量为0.23±0.07、0.42±0.08、0.79±0.12,对照组<低度恶性组<高度恶性组(P<0.05);Western-blot结果显示,见图2。

2.3 患者5年生存情况比较
NEDD9高表达组患者平均生存时间为26.35个月(95%CI 20.15~29.94),NEDD9低表达组患者平均生存时间39.94个月(95%CI 32.25~46.38),低表达组5年生存时间明显高于高表达组(χ2=9.876,P<0.001),见图3。
2.4 神经胶质瘤患者5年总生存时间的相关因素分析
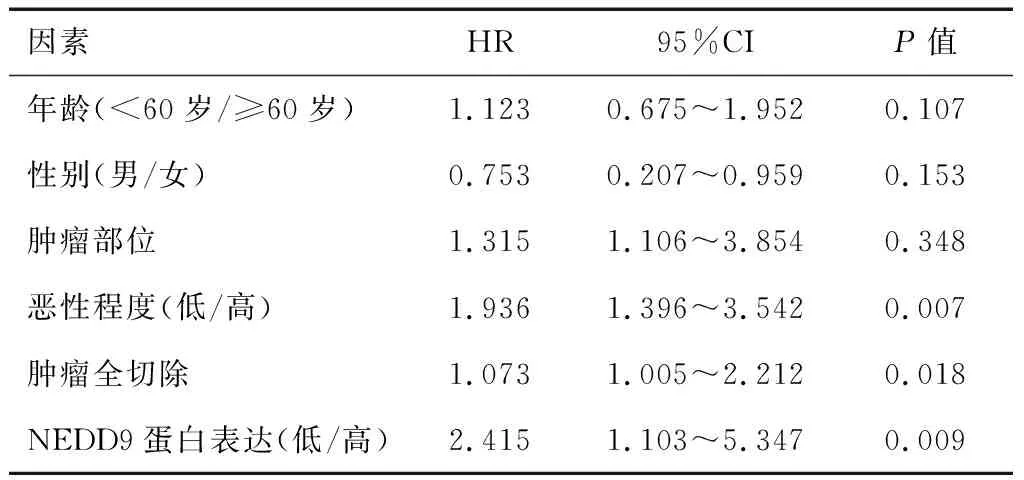
多因素COX回归分析显示,恶性程度(HR=1.936,P=0.007)、肿瘤全切除(HR=1.073,P=0.018)、NEDD9蛋白表达(HR=2.415,P=0.009)是神经胶质瘤患者5年总生存时间的独立危险因素(P<0.05),见表2。
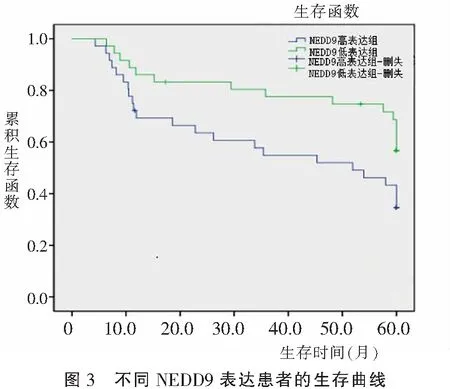
表2 神经胶质瘤患者5年总生存时间COX回归分析
因素HR95%CIP值年龄(<60岁/≥60岁)1.1230.675~1.9520.107性别(男/女)0.7530.207~0.9590.153肿瘤部位1.3151.106~3.8540.348恶性程度(低/高)1.9361.396~3.5420.007肿瘤全切除1.0731.005~2.2120.018NEDD9蛋白表达(低/高)2.4151.103~5.3470.009
3 讨论
神经胶质瘤属于临床最常见的脑肿瘤,是起源于胶质细胞的神经外胚层肿瘤,通常生长部位较深,且呈浸润性的生长,具有难以治愈、病程短、患者生存质量差及死亡率高的特点[7]。神经胶质瘤临床主要表现为:头痛、恶性呕吐、神经功能缺失、视乳头水肿、偏瘫、精神性格改变及共济失调等,易出现远处转移[8]。目前对神经胶质瘤首选的治疗手段为手术切除,但术后半年左右易复发,此时患者神经功能损伤加重,神经结构破坏范围扩大,患者意识水平下降,最终诱发脑功能衰竭进而发生死亡[9]。恶性程度高的患者预后极差,其平均中位生存期通常约一年左右[10]。
上个世纪90年代初,NEDD9首次被提出,其又称Cas-L,属于骨架蛋白的CAS家族蛋白成员,在介导细胞信号转导中起到重要作用[11]。NEDD9在多种肿瘤的发生发展中起作用,其可与多个细胞信号通路(BCAR3、CHAT-H、AND-34等)发生作用,促进肿瘤细胞趋化、迁移、侵袭和转移[12]。本研究经免疫组织化学法实验结果显示,在对照组脑组织中NEDD9蛋白的表达极低,在低度恶性组和高度恶性组中NEDD9表达较高,尤其在高度恶性胶质瘤组织中呈高表达状态,这是因为NEDD9是前致癌基因FAK激酶的特异性效应分子,其通过对蛋白复合体(Fascin蛋白)进行调节,调控细胞的粘附、迁移和侵袭、凋亡及细胞周期,从而促进肿瘤细胞迁徙及侵袭。高表达的NEDD9可导致Fascin蛋白发生结构性重组,促使应力纤维性结构形成,从而实现细胞骨架重塑,破坏细胞间及细胞与细胞外基质间的正常粘附性,使细胞粘附性下降,细胞的运动性增强,促进肿瘤细胞迁移侵袭能力增强,随着NEDD9持续的高表达,最终胶质瘤恶性演变[13-14]。
本研究经qRT-PCR和Western blot实验结果显示,NEDD9 mRNA及蛋白相对表达量在各种的表达为:对照组<低度恶性组<高度恶性组(P<0.05),这说明了NEDD9 mRNA及蛋白相对表达量与神经胶质瘤的恶性演变有关,在正常脑组织中其表达很微弱,随着神经胶质瘤的恶性的递进而呈上调趋势,且在高度恶性胶质瘤中呈高表达状态。NEDD9会提高与细胞外基质的结合,促进肿瘤细胞的生长增殖,当NEDD9呈高表达时,会激活一些下游效应分子(氨基端激酶、细胞外信号调节激酶及丝裂原激活的蛋白激酶等),从而促进细胞迁移及侵袭,同时NEDD9也会刺激细胞产生更多的金属蛋白酶 2(MMP-2)和基质金属蛋白酶 9(MMP-9),而MMP-2或MMP-9会降解细胞基质,进一步增加生长因子及细胞因子的作用,促进恶性肿瘤的侵袭转移[15]。因此临床上可通过基因靶向治疗下调NEDD9 的表达水平来削弱肿瘤细胞的转移能力,阻断或延缓神经胶质瘤的恶性演变进程。
本研究通过对神经胶质瘤患者预后影响因素进行分析,Cox回归多因素分析结果显示,NEDD9蛋白表达(HR=2.415,P=0.009)是神经胶质瘤患者5年总生存时间的独立危险因素(P<0.05),胶质瘤生存率会随其恶性程度的升高而降低,这与国内外相关研究结果相一致,是影响患者预后的危险因素,并意味着NEDD9可能是一个有用的神经胶质瘤标志物,可作为一个独立的患者预后指标。
综上所述,NEDD9表达程度与神经胶质瘤发生发展关系密切,在胶质瘤的恶性进展中扮演重要角色,NEDD9高表达可预测神经胶质瘤患者长期不良预后。
[1] Ostrom QT,Bauchet L,Davis FG,etal.The epidemiology of glioma in adults:a “state of the science” review[J].Neuro-oncology,2014,16(7):896.
[2] Stummer W.Fluorescein in brain metastasis and glioma surgery[J].Acta Neurochirurgica,2015,157(12):2199-2200.
[3] Kozyulina PY,Loskutov YV,Kozyreva VK,etal.Pro-metastatic NEDD9 regulates individual cell migration via caveolin-1-dependent trafficking of integrins[J].Molecular Cancer Research Mcr,2015,13(3):423.
[4] Shagisultanova E,Gaponova AV,Gabbasov R,etal.Preclinical and clinical studies of the NEDD9 scaffold protein in cancer and other diseases[J].Gene,2015,567(1):1-11.
[5] 韩苏阳,张佩佩.DCE-MRI在脑肿瘤临床诊治中的应用进展[J].浙江医学,2016,38(17):1468-1470.
[6] Jagadish N,Parashar D,Gupta N,etal.A novel cancer testis antigen target A-kinase anchor protein (AKAP4) for the early diagnosis and immunotherapy of colon cancer[J].Oncoimmunology,2016,5(2):e1078965.
[7] Karunamuni R,Bartsch H,White NS.Dose-Dependent Cortical Thinning After Partial Brain Irradiation in High-Grade Glioma. International Journal of Radiation Oncology Biology Physics,2016,94(2):297.
[8] Paw I,Carpenter RC,Watabe K,etal.Mechanisms regulating glioma invasion[J].Cancer Letters,2015,362(1):1-7.
[9] Pang C,Guan Y,Zhao K,etal.Up-regulation of microRNA-15b correlates with unfavorable prognosis and malignant progression of human glioma[J].International Journal of Clinical & Experimental Pathology,2015,8(5):4943.
[10] 范英俊,刘艳辉.贝伐单抗在多形性胶质母细胞瘤中的研究进展[J].中华神经外科疾病研究杂志,2013,12(3):281-283.
[11] Iida J,Dorchak J,Clancy R,etal.Role for chondroitin sulfate glycosaminoglycan in NEDD9-mediated breast cancer cell growth[J].Experimental Cell Research,2015,330(2):358.
[12] Han T,Yi XP,Liu B O,etal.MicroRNA-145 suppresses cell proliferation,invasion and migration in pancreatic cancer cells by targeting NEDD9[J].Molecular Medicine Reports,2015,11(6):4115-4120.
[13] Ahmed HH,Abdrabou AA,Hassan AZ,etal.Phytochemical Analysis and Anti-cancer Investigation of Bswellia serrata Bioactive Constituents In Vitro[J].Asian Pacific Journal of Cancer Prevention Apjcp,2015,16(16):7179-7188.
[14] Feng J,Zhao J,Xie H,etal.Involvement of NEDD9 in the invasion and migration of gastric cancer[J].Tumour Biology the Journal of the International Society for Oncodevelopmental Biology & Medicine,2015,36(5):3621.
[15] Kalhori V,Törnquist K.MMP2 and MMP9 participate in S1P-induced invasion of follicular ML-1 thyroid cancer cells[J].Molecular & Cellular Endocrinology,2015,404(C):113.

