扩散加权成像(DWI)在诊断胃肠道恶性肿瘤中的价值
左后东,翟昭华,敬宗林,陈天武
(医学影像四川省重点实验室,川北医学院附属医院放射科,四川 南充 637000)
胃肠道恶性肿瘤是人类常见的消化道疾病,也是目前发病率和致死率最高的肿瘤之一。据报道每年全世界范围内胃肠道肿瘤新发病例和死亡病例也呈增长趋势[1]。早期诊断和治疗是治疗胃肠道肿瘤患者的关键。磁共振扩散加权技术成像(diffusion weighted imaging, DWI)能早期发现病灶和对病变进行分期,在颅脑、肝脏等实质器官中有较广泛应用[2-4]。近年来,DWI也越来越多应用于胃肠道肿瘤研究中[5-6],但研究对象相对单一,缺少不同组织类型肿瘤对照。本研究收集了32例胃恶性肿瘤患者并纳入15名志愿者行腹部MRI成像和DWI成像,分析和探讨DWI在评价胃肠道恶性肿瘤中的潜在价值。
1 材料和方法
1.1 一般资料
纳入2015年1月至2018年2月在川北医学院附属医院经病理确诊胃肠道恶性肿瘤患者32例,其中胃低分化腺癌18例,胃神经内分泌癌7例和胃、十二指肠淋巴瘤7例。32例患者中,男性23例,女性9例,年龄38~75岁,平均年龄(58.3±2.2)岁。另外,随机选取15例志愿者作为正常对照。
1.2 磁共振成像及图像分析
所有患者和志愿者均行3.0 T磁共振扫描(GE公司,Discovery 750)。常规序列包括T1WI、T2WI和DWI)。患者禁食8 h,扫描前做好胃肠道的准备及口服温开水,至患者有饱胀感即可。患者取仰卧位,采用呼吸门控和32通道腹部相控阵表面线圈进行扫描。对肿瘤患者为了诊断需要,还进行了增强扫描。主要扫描参数:T2WI:TR/TE 2609/97 ms,矩阵 384×384,FOV 340×340,层厚 5 mm,层间距 1 mm。T1WI TR/TE 400/18 ms,矩阵 384×384,FOV 340×340,层厚 5 mm,层间距 1 mm。DWI TR/TE 3000/80 ms,矩阵 160×192,FOV 340×340,层厚 5 mm,层间距 0,b值:0~800 s/mm2。
横轴位 T1WI-LAVA FLEX序列增强扫描(TR/TE =3.0~4.0 ms/1.7~1.9 ms,矩阵=384×384,层厚=5.0 mm,层间距=0,FOV=340×340)。增强扫描:高压注射器通过肘正中静脉团注对比剂Gd-DTPA,剂量为0.2 mmol/kg,流速为2.5 mL/s,并以相同速度注射生理盐水30 mL,进行动态扫描。
扫描采集图像均传送至ADW4.4工作站。图像分析由两位高年资MR诊断医师采用双盲法阅片完成。胃肠道恶性肿瘤患者,参照增强扫描图像,勾勒出病变范围,在病变显示最清楚、最大层面,随机选取3个感兴趣区(region of interest, ROI)进行测量。在工作站测量肿瘤组织和正常组织的信号强度值及ADC值,取其平均值。
1.3 统计学分析
统计采用SPSS 19.0软件进行分析,不同肿瘤组织和正常组织信号强度及ADC值采用One-way ANOVA进行分析。P<0.05为差异,有统计学意义。
2 结果
2.1 胃肠道恶性肿瘤病变影像学特点及增强特点
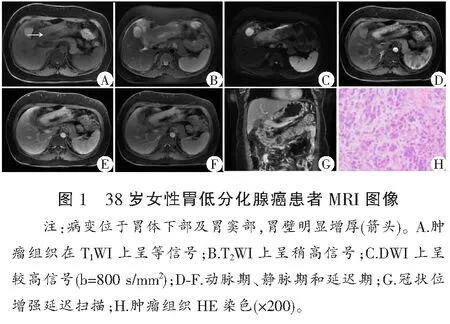
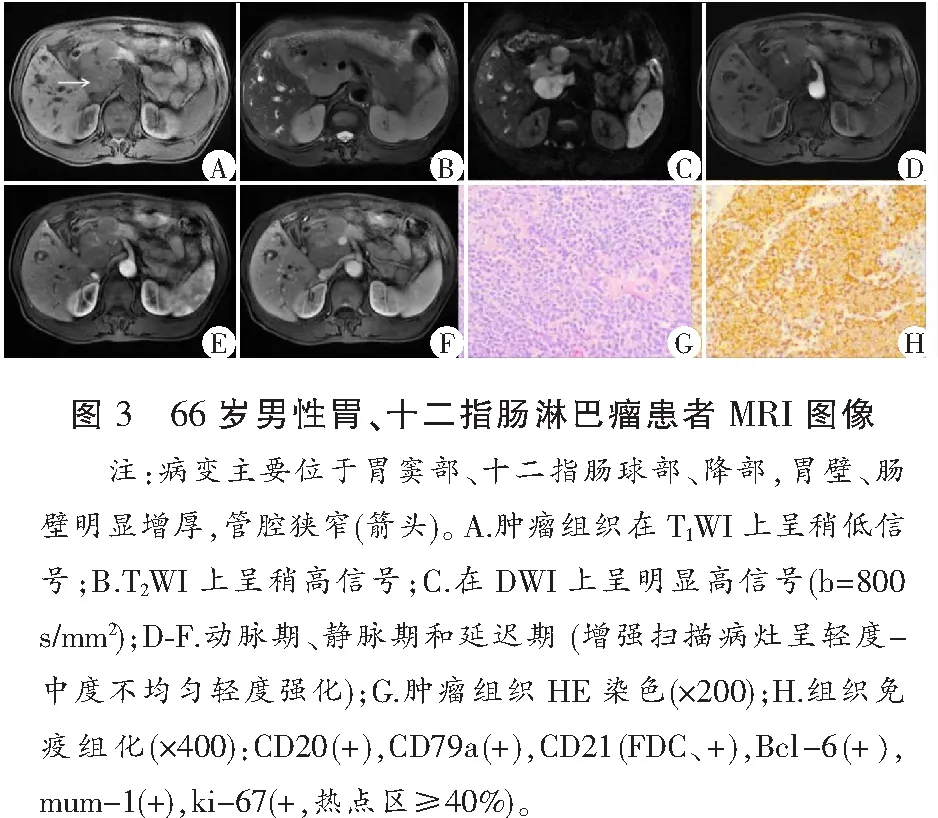
肿瘤病变部位胃壁、十二指肠壁明显增厚,部分呈团块状,管腔不同程度狭窄。病变T1WI上呈等、稍低信号,T2WI上肿瘤组织呈稍高或高信号,DWI上,相对正常胃壁组织,肿瘤组织呈较明显高信号,增强扫描:所有病变均能清楚显示,并呈不同程度强化,病变显示更加清楚(图1-图3)。
2.2 T2WI上胃肠道恶性肿瘤与正常组织信号强度
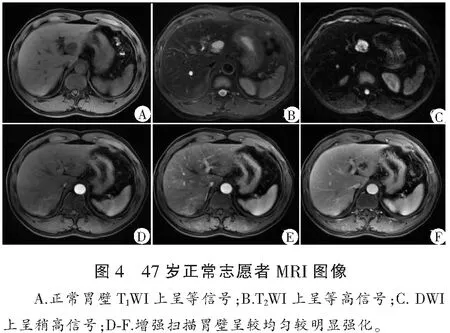
T2WI上,胃腺癌、神经内分泌癌和胃、十二指肠淋巴瘤组织平均信号强度分别为415.36±150.61、408.67±88.19和320.53±63.37,明显高于正常胃壁组织201.83±45.92,且结果有统计学意义(P<0.01)(图1-图4)。
2.3 胃肠道恶性肿瘤和正常组织ADC值
胃低分化腺癌、神经内分泌癌、淋巴瘤和正常胃壁组织的ADC值分别为(0.84±0.15)×10-3mm2/s、(0.91±0.23)×10-3mm2/s、(1.25±0.38)×10-3mm2/s和(1.85±0.36)×10-3mm2/s,3种肿瘤组织平均ADC值显著低于正常胃壁组织(P<0.05)。胃腺癌、神经内分泌癌与胃淋巴瘤组织ADC值间具有统计学差异(P<0.05),而胃腺癌和神经内分泌癌之间结果差异无统计学意义(P>0.05)。

3 讨论
本研究讨论了DWI在胃恶性肿瘤患者中的应用,结果发现相比于正常胃壁组织,所有肿瘤病变在DWI上呈明显高信号,ADC值减低,可以间接反映出肿瘤内水分子扩散受限。肿瘤组织内水分子的扩散受到多种因素的影响,如细胞密度增加、细胞异型性的改变和细胞膜的完整性等。DWI能量化组织中水分子的扩散,从而能间接提供组织微观结构的有关信息[7-9]。由于恶性肿瘤内部微环境的变化,可导致水分子运动发生相应变化,从而可以在DWI上反映出来。
DWI能通过病变信号变化及ADC值辨别出潜在恶性病变,为临床提供术前评估[5-7]。水分子的低扩散对应DWI高信号,而水分子高扩展对应DWI低信号。ADC具有可量化性,能提供对应区域的信号衰减及水分子的扩散运动的定量值。组织中水分子的扩散运动与组织的结构和排列有关,如细胞密度、细胞外基质及纤维成分等。因为绝大多数水分子的平移运动发生在细胞外间隙,所以组织肿胀和细胞增多会影响ADC值。因此,在恶性肿瘤组织中。不断增多的肿瘤细胞伴随着细胞外间隙的减小导致了水分子运动的受限[10]。同时,DWI还可以作为胃癌分期、淋巴结转移、疗效评估和预后的标记[5,11-12]。
目前已有不少DWI和ADC值用于胃肿瘤研究的报道,Caivano等[2]研究发现DWI在肿瘤分期和淋巴结分期上较常规MRI明显提高,分别达到了80%和93%。ADC值可间接反映病变的恶性度,恶性度越高的肿瘤,其ADC值降低越明显,Tang等[9]报道了胃癌的平均ADC值为1.19×10-3mm2/s,较正常胃壁组织降低,与本次研究结果相一致。ADC值对肿瘤分期、淋巴结转移等也有借鉴意义,Giganti等[5]发现胃癌局部侵犯和淋巴结转移ADC值明显不同,综合最后病理结果,他们总结出了术前当ADC值为1.8×10-3mm2/s,可以区分出肿瘤的I期和II期,而当ADC值≤1.36×10-3mm2/s时,可能与III期有关,因此ADC值可作为肿瘤预后的一个潜在生物学标记。Zhong等[13]报道了进展期胃癌患者有淋巴结转移的平均ADC值较无淋巴结转移者明显减低,值分别为(1.145±0.014)×10-3mm2/s和(1.491±0.010)×10-3mm2/s。ADC值与肿瘤内部细胞密度呈负相关,即ADC值越低,肿瘤内细胞密度越大,也间接说明肿瘤增殖较快和恶性程度高。因此,ADC值也可作为评价肿瘤恶性度和分级的敏感指标。本次研究发现胃腺癌、神经内分泌癌和淋巴结的ADC值较正常胃壁明显减低,且胃腺癌和神经内分泌癌较淋巴瘤低,这也符合不同组织类型肿瘤的病理学表现,病理上胃腺癌和神经内分泌癌恶性程度很高,可早期出现局部侵犯、淋巴结和血行转移,而淋巴瘤恶性度相对以上两种相对较低,所以其ADC值就稍高,这也与有关文献报道相一致。该结果表明,DWI和ADC值在辨别肿瘤的恶性度上具有潜在的价值,能为临床提供更多的有利信息。
本研究还有一些不足之处,如样本量相对偏少,对于纳入的胃腺癌、神经内分泌癌没有更详细的区分分化程度,这可能会对结果产生一定影响,还有我们未纳入更多病理组织学类型的胃肠道肿瘤,我们会在以后的研究中不断完善和改进。
总之,DWI和ADC值在胃恶性肿瘤中具有潜在的应用价值,能间接反映不同组织类型肿瘤的微环境变化,为临床诊断和鉴别诊断和临床治疗提供更多、更有价值的信息。
[1] Torre LA,Bray F,Siegel RL,etal.Global Cancer Statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] Caivano R,Rabasco P,Lotumolo A,etal.Gastric cancer:The role of diffusion weighted imaging in the preoperative staging[J].Cancer Invest,2014,32(5):184-190.
[3] Cao M,Suo S,Han X,etal.Application of a Simplified Method for Estimating Perfusion Derived from Diffusion-Weighted MR Imaging in Glioma Grading[J].Front Aging Neurosci,2018,9:432.
[4] Choi SY,Kim SH,Park CK,etal.Imaging Features of Gadoxetic Acid-enhanced and Diffusion-weighted MR Imaging for Identifying Cytokeratin 19-positive Hepatocellular Carcinoma:A Retrospective Observational Study[J].Radiology,2018,286(3):897-908.
[5] Giganti F,Ambrosi A,Chiari D,etal.Apparent diffusion coefficient by diffusion-weighted magnetic resonance imaging as a sole biomarker for staging and prognosis of gastric cancer[J].Chin J Cancer Res,2017,29(2):118-126.
[6] Liu S,Wang H,Guan W,etal.Preoperative apparent diffusion coefficient value of gastric cancer by diffusion-weighted imaging:Correlations with postoperative TNM staging[J].J Magn Reson Imaging,2015,42(3):837-843.
[7] Giganti F,Orsenigo E,Esposito A,etal.Prognostic Role of Diffusion-weighted MR Imaging for Resectable Gastric Cancer[J].Radiology,2015,276(2):444-452.
[8] Bogner W,Gruber S,Pinker K,etal.Diffusion-weighted MR for differentiation of breast lesions at 3.0 T:how does selection of diffusion protocols affect diagnosis[J]. Radiology,2009,253(2):341-351.
[9] Tang L,Sun YS,Li ZY,etal.Diffusion-weighted magnetic resonance imaging in the depiction of gastric cancer:initial experience[J].Abdom Radiol (NY),2016,41(1):2-9.
[10] Cheng J,Wang Y,Zhang CF,etal.Chemotherapy response evaluation in a mouse model of gastric cancer using intravoxel incoherent motion diffusion-weighted MRI and histopathology[J].World J Gastroenterol,2017,23(11):1990-2001.
[11] Mao Y,Hedgire SS,Liao G,etal.Topographic distribution and characteristics of normal gastric regional lymph nodes on diffusion-weighted magnetic resonance imaging[J].Acta Radiol,2016,57(2):152-161.
[12] Song XL,Kang HK,Jeong GW,etal.Intravoxel incoherent motion diffusion-weighted imaging for monitoring chemotherapeutic efficacy in gastric cancer[J].World J Gastroenterol,2016,22(24):5520-5531.
[13] Zhong J,Zhao W,Ma W,etal.DWI as a Quantitative Biomarker in Predicting Chemotherapeutic Efficacy at Multitime Points on Gastric Cancer Lymph Nodes Metastases[J].Medicine (Baltimore),2016,95(13):e3236.

