血清降钙素原在重症医学科感染患者中的应用价值
钱志成,王强,王大庆
(川北医学院附属医院,1.重症医学科;2.检验科,四川 南充 637000)
近年来,尽管重症医学取得长足进步,但严重感染依然是威胁重症患者生命的常见病。如何实现严重感染的早期诊断和早期抗感染治疗,以及正确评估抗感染治疗的有效性,是决定重症感染抗感染治疗成败的关键。无菌体液或病理组织的微生物培养结果是目前感染性疾病最具诊断价值的实验室诊断方法,是诊断感染部位和病原菌的金标准。但由于其为有创操作,难以在重症患者中实施,严重程度评估也缺乏客观、有效、动态的方法。降钙素原(procalcitonin,PCT)是一种由116个氨基酸构成的三肽,正常情况下由甲状腺C细胞产生,产生后迅速裂解为降钙素等产物[1]。生理情况下, PCT水平处于极低状态,在急性炎症反应时炎性介质及细菌毒素可刺激其分泌增加[2]。本研究探讨PCT在不同严重程度感染、不同部位感染和不同病原菌中的差异性,进一步明确PCT在重症感染评估中的价值,现将结果报告如下。
1 资料和方法
1.1 研究对象
采用回顾性病例对照研究方法,收集并分析2015年6月至2016年12月就诊于川北医学院附属医院重症医学科治疗的感染性疾病患者90例。纳入年龄≥18岁。排除标准:ICU住院时间≤3 d,入ICU后发生的院内感染。
1.2 分组
根据2012拯救脓毒症运动指南[3]定义,按照感染严重程度分为严重感染,脓毒症和脓毒性休克。根据感染不同部位分为肺部感染、腹腔感染、颅内感染、尿路感染和血流感染。根据不同病原菌分为革兰阳性菌、革兰阴性菌和真菌感染。
1.3 观察指标
患者入ICU 24 h内临床指标最差值和实验室指标计算急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分,应用抗生素前采用全自动免疫荧光分析仪和专用原装试剂盒进行PCT定量测定试剂和机器。比较各组PCT、APACHEⅡ评分的差异,明确PCT和APACHEⅡ评分的相关性,PCT对感染严重程度、感染部位、病原菌的鉴别价值。
1.4 统计学分析
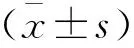
2 结果
共纳入90例患者,其中男性52例,女性38例;年龄31~82岁,平均(61.2±15.8)岁;血清PCT 5.8(1.30±12.50)μg/L,APACHEⅡ评分(15.0±6.2)分。
在所有纳入患者中,PCT与APACHEⅡ的相关性:血清PCT 水平与APACHE Ⅱ呈正相关(r=0.626,P<0.05)。
不同感染严重程度下,患者PCT水平和疾病严重程度的比较(表1):严重感染组、脓毒症组和脓毒性休克组患者性别、年龄差异无统计学意义(P>0.05)。严重感染组、脓毒症组和脓毒性休克组PCT水平、APACHEⅡ评分逐级升高,多组比较和两两间比较差异均有统计学意义(P<0.01)。
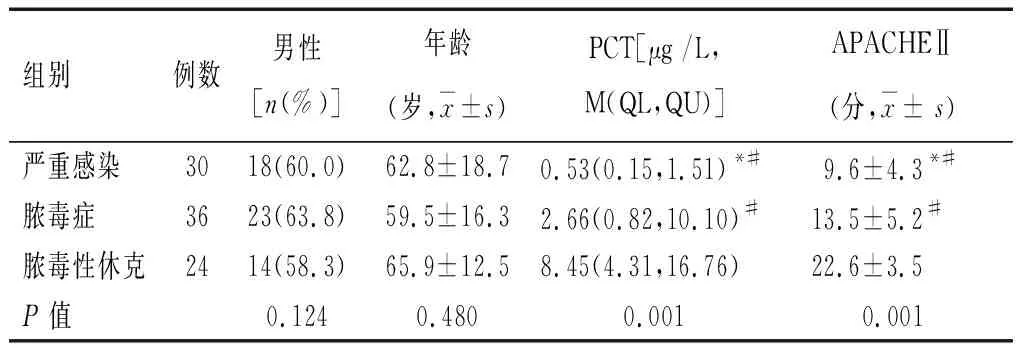
表1 不同感染严重程度基本资料和检测结果比较
*P<0.01,与脓毒症组比较;#P<0.01,与脓毒性休克组比较。
不同感染部位时,患者PCT水平和疾病严重程度的比较(表2):多组间比较患者性别有统计学意义(P<0.05),年龄差异无统计学意义(P>0.05)。多组间比较PCT水平、APACHEⅡ评分差异有统计学意义(P<0.05)。两两间比较除了血流感染组与其他各组PCT水平、APACHEⅡ评分差异有统计学意义(P<0.01),其他组间两两比较差异无统计学意义(P>0.05)。
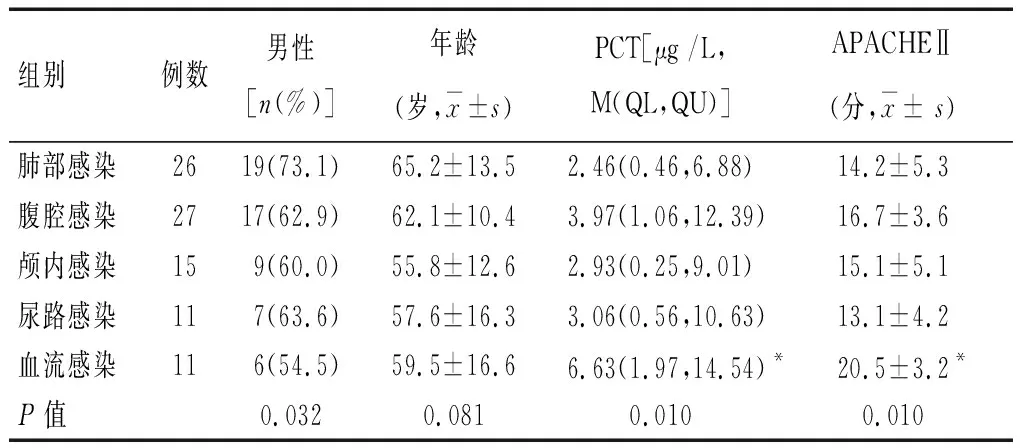
表2 不同感染部位基本资料和检测结果比较
*P<0.01,与其他组比较。
不同感染病原菌之间,患者PCT水平和疾病严重程度的比较(表3):共培养出病原菌46株,以阴性菌为主,占65%。阳性菌主要为金黄色葡萄球菌4例,溶血葡萄球菌1例,链球菌1例;阴性菌主要为大肠埃希菌10例,鲍曼不动杆菌8例,其他(包括铜绿假单胞菌、肺炎克雷伯菌等)12例;真菌主要是白色念珠菌6例,曲霉菌3例,热带假丝酵母菌1例。组间比较患者性别有统计学意义(P<0.05),年龄差异无统计学意义(P>0.05),PCT水平、APACHEⅡ评分差异无统计学意义(P>0.05)。

表3 不同感染病原菌基本资料和检测结果比较
3 讨论
危重病人病情评估往往需要评分工具全面评估患者各个器官功能来综合评定,如APACHE评分、感染相关器官衰竭评分系统(SOFA)评分。这些评估工具经多年研究论证适用于ICU患者的评估[4]。但随着PCT作为细菌感染的生物学标记的临床应用增加和研究的积累,PCT已成为传统评分工具的很好补充,动态监测PCT的变化趋势可以判断病情进展情况[5-7]。本研究结果显示,PCT水平在不同严重程度感染患者中存在统计学意义,血流感染相对其他部位感染PCT值有统计学意义,在不同类别病原菌感染中无统计学意义。
PCT在多种感染状态下对病情严重程度具有评估价值。在普通病房可疑细菌感染患者中监测PCT,感染组血清PCT水平明显高于非感染[(3.948±2.175)ng/mLvs. (1.379±1.267)ng/mL,P= 0.045],感染组脓毒症、严重脓毒症、脓毒性休克和多脏器功能衰竭各亚组患者随病情加重PCT水平明显增高,所有患者血清PCT水平与APACHEⅡ评分呈正相关(r=0.930,P<0.01)[8]。在下呼吸道感染老年患者中监测PCT,病情轻、中、重度组PCT水平有统计学意义[(2.4±1.0)ng/mLvs.(4.8±2.1)ng/mLvs.(6.7±2.4)ng/mL,P<0.01][9]。在糖尿病足感染患者中监测PCT,感染程度轻、中、重度组PCT水平有统计学意义[(172.32±112.65)pg/mLLLvs.(401.26±145.25)pg/mLvs.(867.22±213.43)pg/mL,P<0.05][10]。本研究结果与上述文献一致,研究对象为重症患者,所测PCT值更高。
重症医学科是各类感染的高发地,相对于血流感染,其他器官感染通过症状体征和影像学检查容易明确感染部位。血流感染由于临床表现缺乏特异性,容易漏诊或误诊。血培养是诊断血流感染的金标准,但需要较长时间,受穿刺部位污染、假阳性等因素的影响,同时也需要排除其他部位的感染。本研究表明,相对其他部位感染,PCT水平在血源性感染中显著升高。既往研究[11]表明PCT对血流感染诊断具有一定敏感性和特异性,PCT联合CRP能提高血流感染诊断的敏感性和特异性[12],与本研究结果一致。但针对感染部位的研究[13]表明,腹腔感染组PCT水平显著高于肺部感染组(P<0.05)。结果的差异可能与其纳入腹腔感染相对肺部感染导致全身炎症反应更严重有关。
PCT对于病原菌种类的鉴别,急诊临床应用专家共识组认为PCT水平主要与病原菌类型、感染严重程度以及全身炎症反应的严重程度有关[14]。一些研究[15]认为,PCT对于革兰阴性菌、革兰阳性菌脓毒症的鉴别有一定的作用,革兰阴性组PCT受试者特征操作AUC 0.926,明显高于革兰阳性菌脓毒症组患者的0.807,差异有统计学意义(P<0.05)。PCT鉴别革兰阳性菌和革兰阴性菌感染的Cut-off值为1.25 μg/L,此时曲线下面积分别为0.671,阳性预测值为88.6%,灵敏度和特异性为69.7%和72%[16]。侵袭性真菌感染时PCT可以增高,局灶性感染时很少增高,对真菌感染的诊断价值有限[14]。但随着针对真菌感染的PCT水平的研究逐年增加,发现在不同真菌感染中PCT的水平也存在着不同程度的差异。在白色假丝酵母菌、热带假丝酵母菌等真菌感染中,随着疾病危重程度的升高,PCT水平逐渐增高,组间有显著差异,但不同真菌菌株间无显著差异[17]。本研究通过细菌真菌的联合比较,PCT对病原菌种类没有鉴别意义。可能与研究对象、样本例数有关,最终结论还需大样本、多中心的临床研究加以验证。
性别对感染影响的研究相对较少。有国外研究[18]表明,性别对感染发生的影响可能是由于男性患者更容易伴随有高血压、脂质代谢异常等基础疾病。本研究中性别在不同组别中的差异也没有一致的结论。普遍认为,老年人由于机体功能的逐渐衰退,免疫功能降低,对抗外界应激的反应能力下降,因此感染容易发生。但年龄在不同感染组别中的差异尚缺乏相关研究作比较。
综上所述,对于ICU感染患者,血清PCT水平可以提示感染的严重程度,对血流感染有一定鉴别价值。PCT作为细菌感染的一个生物学标记,除了细菌感染之外,还有很多疾病、很多因素会导致PCT水平增高,如外科手术、创伤、肾功能等[19]。在评估重症感染,除了监测PCT,还是应结合患者的临床表现、影像学、实验室检查以及病原学结果来进行综合诊断。
[1] Jacobs JW,Lund PK,Potts JT,etal.Procalcitonin is a glycoprotein[J].J Biol Chem,1981,256(6):2803-2807.
[2] Christ-Crain M,Muller B.Procalcitonin in bacterial infections-hype,hope more or less? [J].Swiss Med Wkly,2005,135(31):451-460.
[3] Dellinger RP,Levy MM,Rhodes A,etal.Surviving Sepsis Campaign Guidelines Committee including The Pediatric Subgroup:Surviving Sepsis Campaign:international guidelines for management of severe sepsis and septic shock,2012[J].Intensive Care Med,2013,39:165-228.
[4] Knaus WA,Draper EA,Wagner DP,etal.APACHE Ⅱ:a severity of disease classification system[J].Crit Care Med,1985,13(10):818-829.
[5] 黄伟平,黄澄,温妙云,等.脓毒性休克患者降钙素原的变化规律及其与预后的关系[J].中华危重病急救医学,2013,25(8):467-470.
[6] 王杰,刘少华.感染性休克患者血清降钙素原与APACHEⅡ评分的相关性[J].实用医学杂志,2013,29(8):1274-1275.
[7] 曾文美,毛璞,黄勇波,等.脓毒症预后影响因素分析及预后价值评估[J].中国中西医结合急救杂志,2015,22(2):118-123.
[8] 宋邵华,田惠玉,杨秀芬.降钙素原在可疑细菌感染患者疾病严重程度的早期预警价值[J].内科急危重症杂志,2016,22(1):56-57.
[9] 王敏,郑世良,程善光.降钙素原和C反应蛋白对老年人下呼吸道感染病情严重程度及预后评估的价值[J].中国全科医学,2012,15(15):1695-1697.
[10] 金剑虹,洪郁芝,徐新鹏,等.血清CRP与PCT在糖尿病足感染病情严重程度及预后评估价值研究[J].中华医院感染学杂志,2016,26(24):5616-5618.
[11] 张有江,王欢,罗燕萍,等.定量降钙素原测定在血流感染诊断中的应用[J].军医进修学院学报,2010,31(12):1219-1221.
[12] 汤瑾,许静,王坚镪,等.降钙素原联合C 反应蛋白检测在血流感染早期临床诊断的应用[J].检验医学,2013,28(8):662-665.
[13] 陈瑶,宋青,康红军,等.降钙素原在腹腔感染中的诊断价值[J].中华医院感染学杂志,2012,22(8):1629-1630.
[14] 降钙素原急诊临床应用专家共识组.降钙素原(PCT)急诊临床应用专家共识[J].中华急诊医学杂志,2012,21(9):944-951.
[15] 刘英其.血清降钙素原在不同种类细菌脓毒症的早期鉴别诊断价值[J].中华医院感染学杂志,2013,23(3):500-502.
[16] 张群,胡晓波.降钙素原在革兰阳性菌和革兰阴性菌感染鉴别诊断中的价值探讨[J].检验医学,2015,30(11):1113-1118.
[17] 魏万昆,万程彬,张毅.不同真菌感染对降钙素原的差异与疾病预后的关系[J].中华医院感染学杂志,2015,25(9):1937-1939.
[18] Bǎlan H,Popescu L.“Gender specific medicine”:a focus on gender-differences in hypertension[J].Rom J Intern Med,2014,52(3):129-141.
[19] Tang BM,Eslick GD,Craig JC,etal.Accuracy of procalcitonin for sepsis diagnosis in critically ill patients:systematic review and metaanalysis[J].Lancet Infect Dis,2007,7(3):210-217.

