糖基化亚硝基牦牛血红蛋白制备及工艺优化研究
贡佳欣,唐善虎,刘星汶,王 柳,范 藝
(西南民族大学生命科学与技术学院成都 610041)
牦牛血是牦牛屠宰加工过程中主要的副产物之一,可以提供很好的蛋白和色素资源[1-2],但长期以来牦牛血液并未受到重视,大都作为废弃物排放掉,不仅使资源大量浪费还造成严重的环境污染[3].牦牛血液中血红蛋白含量高[4],若能有效利用丰富的牦牛血资源制备亚硝基血红蛋白,用于替代亚硝酸盐,降低产品中亚硝酸盐残留量,既可增加产品中蛋白质、铁等成分含量,又可使产品拥有诱人的玫瑰色[5].亚硝基血红蛋白结构并不稳定,易发生降解使产品褪色[6-7],因此在一定条件下通过美拉德反应让蛋白与多糖形成糖基化亚硝基血红蛋白,可提高其溶解性、光照和热稳定性等功能特性[8].杨锡洪[9]研究了糖的浓度、pH、加热温度和时间等条件对糖基化反应的作用效果,发现pH对糖基化反应的作用最大.李飞等[10]探讨了不同光照和贮藏条件对糖基化亚硝基血红蛋白稳定性的影响,发现光照后色素的氧化程度下降,并发现氧化剂H2O2对蛋白质稳定性有较大的影响.
目前,采用牦牛血制备糖基化亚硝基血红蛋白尚未见报道,也未见研究糖基化亚硝基牦牛血红蛋白稳定性报道.本研究用牦牛血制备亚硝基牦牛血红蛋白,优化制备工艺、考察不同壳聚糖添加量、pH值、加热温度以及加热时间对糖基化反应的影响.
1 材料与方法
1.1 试验材料
牦牛血采自红原牦牛屠宰厂.本研究中所使用的化学试剂包括亚硝酸钠、壳聚糖、柠檬酸钠、氯化钠、异抗坏血酸、盐酸萘乙二胺、甲基红指示剂、溴甲酚绿指示剂、亚甲基蓝指示剂、硫酸铜、硫酸钾、亚铁氰化钾、乙酸锌、硼砂、对氨基苯磺酸、氢氧化钠、盐酸、硫酸、硼酸、95%乙醇均为化学分析纯.
1.2 主要仪器
Centrifuge 5804离心机(Eppendorf公司);电子天平(梅特勒-托利多仪器有限公司);AOE翱艺分光光度计(翱艺仪器上海有限公司);MP511型实验室pH计(上海三信仪表厂);MDF-U4086S超低温冰箱(三洋电器有限公司);ALPHA 1-4 LSC冷冻干燥机(LyoShuttle Drive Martin Christ公司);JJ-1精密定时电动搅拌器(江苏省金坛市荣华仪器制造有限公司);DHG-9240A电热恒温鼓风恒温干燥箱(上海精宏实验设备有限公司);超级恒温水浴锅(国华HH-6数显恒温水浴锅);Kjeltec 2200自动凯氏定氮仪(瑞士Foss公司).
1.3 糖基化亚硝基血红蛋白制备工艺
根据杨锡洪[9]和李飞[10]报道的糖基化亚硝基血红蛋白制备方法,稍作修改制定牦牛血制备糖基化亚硝基血红蛋白工艺如下:
牦牛血→抗凝→洗涤→溶涨破壁→离心→弃沉淀,取上清液→制备亚硝基血红蛋白→糖基化→真空冷冻干燥→糖基化亚硝基血红蛋白成品
1.3.1 制取抗凝牦牛血液
1 000 mL新鲜牦牛血中加入5.0 g柠檬酸钠并轻轻搅拌,保持低温条件迅速运回实验室,过滤除去杂物.
1.3.2 提取牦牛血细胞
在3 000 r/min离心条件下,离心抗凝血15 min,弃去上清液.生理盐水(0.9%NaCl水溶液)与血液等体积混匀,以3 000r/min离心15 min,取下部沉淀,重复2次,得到洗干净的红细胞.
1.3.3 牦牛血细胞的破壁
采用本实验室常用的溶胀法,加入4体积蒸馏水对红细胞进行破裂处理,磁力搅拌30 min,充分释放血红蛋白.60℃水浴加热血红蛋白溶液30 min,4 000 r/min离心15 min,弃沉淀,得纯度较高血红蛋白溶液.
1.3.4 牦牛亚硝基血红蛋白的制备
取100 mL血红蛋白溶液,加入异抗坏血酸钠0.360 g,亚硝酸钠0.080 g,HCl调节溶液pH至6.0,60℃反应20 min,再于3 000 r/min离心15 min,取上清液,得亚硝基血红蛋白溶液.
1.4 牦牛糖基化亚硝基血红蛋白的制备工艺优化
1.4.1 单因素试验
单因素试验根据杨锡洪[9]的试验方法,考察不同壳聚糖添加量、pH值、加热温度及加热时间对制备出的亚硝基血红蛋白糖基化反应的影响.
(1)壳聚糖添加量对糖基化反应的影响
取10%的亚硝基血红蛋白溶液10 mL,分别按照3:1、2.5:1、2:1、1.5:1、1:1 加入 2%浓度的壳聚糖溶液,调节混合液pH为5.5,55℃下低速搅拌,加热20 min后定容至100 mL,3 000 r/min离心15 min,取上清液,以吸光度为评价指标,于A540nm下比色,确定最佳壳聚糖添加量.
(2)pH值对糖基化反应的影响
取10%的亚硝基血红蛋白溶液10 mL,加入2%浓度壳聚糖溶液2.5 mL,调节混合液pH为5.0、5.5、6.0、6.5和7.0,55℃下低速搅拌,加热20 min后定容至100 mL,3 000 r/min离心15 min,取上清液,以吸光度为评价指标,于A540nm下比色,确定最佳pH值.
(3)加热温度对糖基化反应的影响
取10%的亚硝基血红蛋白溶液10 mL,加入2%浓度壳聚糖溶液2.5 mL,调节混合液pH为5.5,分别于35、40、45、50、55、60 ℃条件下加热 20 min,定容至100 mL,3 000 r/min离心15 min,取上清液,以吸光度为评价指标,于A540nm下比色,确定最佳反应温度.
(4)加热时间对糖基化反应的影响
取10%的亚硝基血红蛋白溶液10 mL,加入2%浓度壳聚糖溶液2.5 mL,调整为 pH5.5,在 55℃水浴条件下分别加热 5、10、15、20、25、30、35、40 min,定容至100 mL,3 000 r/min离心15 min,取上清液,以吸光度为评价指标,于A540nm下比色,确定最佳反应时间.
1.4.2 正交试验设计
在壳聚糖添加量、加热温度、加热时间和pH值单因素试验结果,经过数据分析筛选后,采用L9(34)表设计4因素3水平正交试验,优化糖基化反应工艺条件.
1.4.3 糖基化亚硝基牦牛血红蛋白理化特性
(1)蛋白质含量的测定
根据GB 5009.5-2010提供的凯氏定氮法进行蛋白质含量测定.
(2)亚硝酸盐残留量的测定
亚硝酸盐残留量采用GB 5009.33-2010建议的盐酸奈乙二胺法测定.
(3)水分测定
采用GB 5009.3-2010常温烘箱干燥法测定水分.
(4)灰分的测定
灰分含量根据GB/T 5505-2008测定.
1.4.4 统计分析
所有样本处理重复3次,数据分析使用SPSS V19.0软件包,采用ANOVA进行方差分析和显著性检验,采用Duncan法进行多重比较,使用Excel 2010软件做图表.
2 结果与讨论
2.1 单因素试验
2.1.1 壳聚糖添加量对糖基化的影响
在pH值为6.0,水浴温度为55℃,加热时间为20 min条件下,考察不同浓度壳聚糖溶液对糖基化反应的影响.结果表明,不同壳聚糖添加量对糖基化亚硝基血红蛋白的吸光度有显著影响(P<0.05).由图1可知,反应产物的吸光度随壳聚糖加入量的增加不断缓慢上升.反应在亚硝基血红蛋白浓度低的情况下更易进行,但蛋白浓度过低使后期干燥处理效果不理想,相反浓度过高时,在加热条件下,肽链会充分伸展聚集,糖基化反应不完全[11].牦牛血中血红蛋白含量高于猪血中血红蛋白含量,所需的壳聚糖添加量大于猪血糖基化亚硝基血红蛋白壳聚糖添加量(5:1)[9].综合糖基化效果和成本两个因素,最终选择糖基化的壳聚糖含量为6.67 mL(1.5:1).
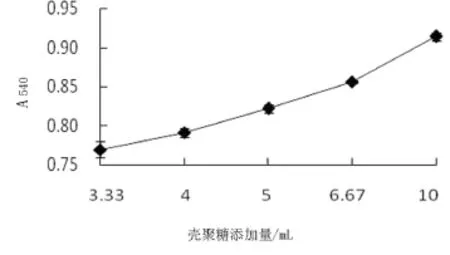
图1 壳聚糖添加量对糖基化反应的影响Fig.1 Effect of chitosan addition on the glycosylation reaction
2.1.2 pH值对糖基化的影响
在水浴温度55℃,2%浓度壳聚糖溶液3.33 mL,加热时间为20 min条件下,考察不同pH值对糖基化反应的影响.结果表明,不同pH值对糖基化亚硝基血红蛋白的吸光度有显著影响(P<0.05).如图2所示,当pH值为6.0时,产物的吸光度最大,糖基化效果最佳,pH>6.0后吸光度开始下降.pH值会影响蛋白质分子的水解和酸碱性质,从而影响蛋白质-水的相互作用[12].pH值是影响蛋白质稳定性的因素之一,蛋白质在等电点时最稳定,这时,蛋白质所带净电荷较少,分子内部排斥力较小,可结合少部分的水,蛋白质变性的可能性大大增加[13];在静电作用影响下,带净负电荷的蛋白质和多糖可生成可溶性蛋白质-多糖复合物,此时,蛋白质分子正电荷区域与阴离子多糖相互吸引[14].pH值为6.0时,糖基化效果最好,可能是因为pH值对蛋白质稳定性和大分子间相互作用力有影响.
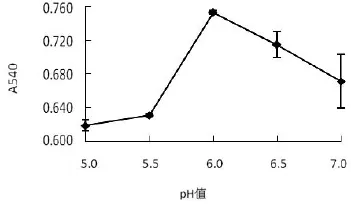
图2 pH值对糖基化反应的影响Fig.2 Effect of pH value on the glycosylation reaction
2.1.3 加热温度对糖基化的影响
在pH值为6.0,2%浓度壳聚糖溶液3.33 mL,加热时间为20 min条件下,考察不同水浴温度对糖基化反应的影响.结果表明,改变加热温度对糖基化亚硝基血红蛋白的吸光度有显著的影响(P<0.05).如图3所示,在水浴温度为55℃时,吸光度达到最高,糖基化效果最佳,温度在45℃吸光度下降可能是因为低温下形成的多糖-蛋白共价复合物有更好的稳定性[8].温度在55℃后吸光度下降,可能是因为随着温度升高,蛋白质变性降低了溶液中产物的浓度,而使吸光度降低.因此选择水浴温度为55℃.
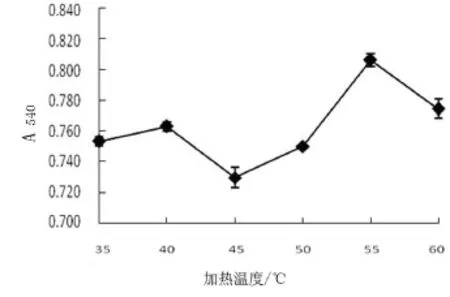
图3 加热温度对糖基化反应的影响Fig.3 Effect of temperature on the glycosylation reaction
2.1.4 加热时间对糖基化的影响
在pH值为6.0,2%浓度壳聚糖溶液3.33 mL,水浴温度为55℃条件下,考察不同加热时间对糖基化反应的影响.结果表明,改变加热时间对糖基化亚硝基血红蛋白的吸光度有显著的影响(P<0.05).如图4所示,加热时间为30 min,吸光度最高,糖基化效果最佳,加热时间在5 min~20 min时吸光度基本保持不变,在20 min~30 min之间吸光度上升,在30 min~40 min时吸光度有所下降.在30 min之前,糖基化反应不完全,超过30 min,未参与反应的热稳定性差的亚硝基血红蛋白可能会发生变性,产物浓度降低,测出的吸光度也偏低[15].由于牦牛血中血红蛋白含量高于猪血中血红蛋白含量,糖基化反应所需时间增加,选择加热时间为30 min.
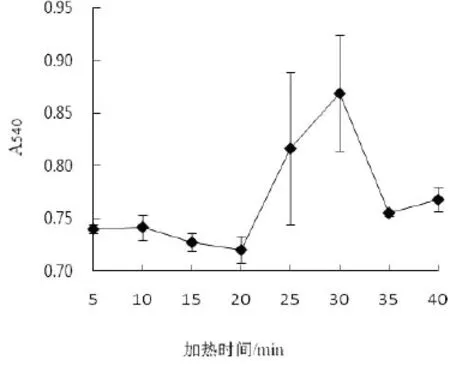
图4 不同加热时间对糖基化反应的影响Fig.4 Effect of heating time on the glycosylation reaction
2.2 正交试验
2.2.1 糖基化条件正交优化
由表1极差分析D>C>B>A可知,各因素对亚硝基血红蛋白糖基化反应的影响顺序为pH值>加热时间>加热温度>壳聚糖添加量.单因素试验和正交试验结果表明,制备糖基化亚硝基血红蛋白工艺的组合为A1B2C3D2,即最佳反应条件为pH6.0,加热温度55℃,加热时间 35 min,壳聚糖溶液添加量为6.67 mL.

表1 L9(34)正交试验结果Table 1 L9(34)orthogonal test results
2.2.2 正交试验各因素趋势图分析
四种因素对糖基化亚硝基血红蛋白的形成影响见图5.由图5可知,在壳聚糖溶液添加量为5 mL时,糖基化亚硝基血红蛋白的吸光度为最大值0.692,吸光度的整体趋势是吸光度不断下降.所以,试验水平应选择壳聚糖溶液添加量为5 mL,即A1.当加热温度为55℃时,糖基化亚硝基血红蛋白的吸光度达到最大值0.718,吸光度呈现先上升后下降的趋势.试验水平应选择加热温度为55℃,即B2.加热时间增加,该蛋白的吸光度渐渐上升,当加热时间为35 min时吸光度最大,为0.785.所以,仅从此图分析可得,试验水平因选择加热时间为35 min,即C3.当pH值为6.0时,糖基化亚硝基血红蛋白的吸光度最大达到0.827,吸光度的整体趋势是吸光度不断下降.所以,试验水平应选择pH值为6.0,即D2.综上所述,最优水平为A1B2C3D2,各因素最优条件分别为壳聚糖溶液添加量5 mL、加热温度55℃、加热时间35 min、pH值6.0.
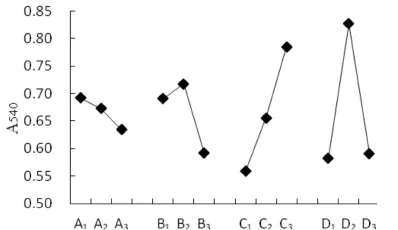
图5 正交各因素趋势图Fig.5 Diagram of orthogonal factor trend
2.3 糖基化亚硝基牦牛血红蛋白得率
参照杨锡洪[9]的试验方法,选择真空冷冻干燥法制备粉末状色素产品,1 750 mL糖基化亚硝基血红蛋白溶液经过真空冷冻干燥后,产品总质量为37.324 g.计算糖基化亚硝基血红蛋白得率为0.021 g/mL.
2.4 糖基化亚硝基牦牛血红蛋白理化特性
经过测定,糖基化亚硝基牦牛血红蛋白各项理化指标见表2.

表2 糖基化亚硝基牦牛血红蛋白理化特性Table 2 Physicochemical properties of yak glycosylated nitroso-hemoglobin
从表2看出,干燥后的产品组成为蛋白质54.64%、水分18.36%、灰分18.54%和亚硝酸钠0.009 mg/kg,蛋白质含量高,亚硝酸钠残留含量较低低,符合国家标准,可作为食用红色素应用于食品加工中.
3 结论
本实验探讨壳聚糖溶液添加量、反应温度、反应时间以及pH值这4个因素对亚硝基血红蛋白糖基化的影响,影响结果的各因素主次顺序为pH值>加热时间>加热温度>壳聚糖溶液添加量.pH为主要影响因素,其次为反应时间.综合分析实验结果可知,亚硝基血红蛋白糖基化的最优组合为壳聚糖溶液添加量为5.0 mL,pH 6.0,加热温度55℃,加热时间35 min.
产品的组成为蛋白质含量 54.64%、水分18.36%、灰分 18.54%和亚硝酸钠 0.009 mg/kg,溶解在水中,可作为食用红色素用于食品加工.
[1] 于海燕,罗永康.牦牛血理化特性的研究[J].2007(06):33-35.
[2] 朱森阳,汪国和,王志鹏.畜禽血液资源的开发利用进展[J].养殖与饲料,2007(01):67-69.
[3] 王华清,来进君,段培琪,等.青海牦牛血液资源的研究现状及开发利用[J].青海畜牧兽医杂志,2016(02):43-44.
[4] 卢福山,张才俊.高原型牦牛8项血液指标的测定[J].青海畜牧兽医杂志,2006,36(4):3-4.
[5] TICHIVANGANA J Z,MORRISSEY P A,BUCKLEY D J.Acceptability of nitrite- free bacon[J].Irish Food Sci and Tech,1984(8):99-104.
[6] SHAHIDI F,PEGGR B.Novel synthesis of cooked cured-meat pigment[J].Food Science,1991,56(3):1205-1212.
[7] SHAHIDI F,PEGGR B.Preparation of the cooked cured-meat pigment,dinitrosyl- ferrohemochrome,from hemin and nitric oxide[J].Food Science,1985,50:272-273.
[8] KATO Y,WATANABE K,SATO Y.Effect of maillard reaction on some physical propertois of oval- bumin[J].Food Science,1981,46(6):1835-1839.
[9] 杨锡洪.以血红蛋白制备腌制色素替代亚硝酸钠发色的研究[D].无锡:江南大学,2005.
[10] 李飞,隋新,刘红娟,等.糖基化亚硝基血红蛋白的稳定性及其在猪肉脯中的应用研究[J].农产品加工,2015,(04):9-14.
[11] 齐军茹,杨晓泉,彭志英.蛋白-多糖共价复合作用研究进展[J].食品工业科技,2003(11):85-87+84.
[12] 夏延斌.食品化学[M].北京:中国农业出版社,2004.
[13] 刘成国,陈瑶,王冬冬,等.糖基化亚硝基血红蛋白制备工艺优化[J].食品科学,2011,32(16):93-97.
[14] 熊拯,郭兴凤,谈天.蛋白质—阴离子多糖相互作用研究进展[J].粮食与油脂,2006(10):15-17.
[15] 陈瑶.糖基化亚硝基血红蛋白的制取及其应用研究[D].长沙:湖南农业大学,2011.

