用LAMP法快速鉴别熟制牦牛肉饼中的猪肉和鸡肉成分
唐善虎,李 雪,王 柳
(西南民族大学生命科学与技术学院,四川 成都 610041)
LAMP技术是Notomi等[1]人于2000年提出的一种新的核酸扩增技术,该方法依赖于2对特异性引物和一种具有链置换活性的DNA聚合酶(Bst DNA聚合酶),在等温条件下扩增靶序列进行鉴定.该法具有特异性强、灵敏度高、检测时间短和操作设备简单的特点,在食源性微生物的快速检测研究方面具有极强的可推广性.Nagamine等[2]于2002年通过增加了2条环引物(Loop F,Loop B)对LAMP法进一步改进,提高了LAMP法的扩增效率.目前LAMP技术已经逐步用于各种微生物的检测研究,尤其是在食品安全领域的应用.袁耀武等[3]采用LAMP对单核细胞增生性李斯特氏菌进行检测,经过1h扩增,该检测方法的灵敏度达到7.3×101cfu/mL,人工污染鸡肉中的检出限为8.9×101cfu/g.鲁曦等[4]以乳粉中的阪崎肠杆菌为研究对象,采用LAMP法扩增45 min,检测灵敏度为100 fg.LAMP法也可以用于食品转基因成分的检测.兰青阔等[5]建立了转基因抗虫和耐除草剂玉米Bt11 LAMP检测体系,其灵敏度为常规定性PCR的20倍.我们在国内首次将LAMP法用于加工肉制品中掺假鉴定[6],杨丽霞等[7]报道了LAMP法与实时荧光定量PCR结合的方法鉴别新鲜牛羊猪肉样本中的猪肉.在国外,Minhaz等[8]比较了LAMP法和电化学传感器对部分动物肉的鉴别效果.在食品行业,市场上存在掺假或用欺诈性手段替代加工原料的情况,主要是产品深加工过程,在珍贵原料肉或高价肉类中掺杂低价格的原料肉[2-3],如牛羊肉中掺杂猪、鸡或鸭肉等[4].将不同肉类种类混合加工成产品,如果不标明,就会误导消费者,甚至于损害消费者身体健康.因此,对肉类食品的鉴定是一项非常有意义的工作.
牦牛肉是高原特有的无污染绿色食品,其营养价值和商用价值都较高.目前,市场存在普通肉类掺杂到牦牛肉制品的情况,严重损害了消费者的利益,甚至危及到宗教信仰.因此,有必要寻找一种简单快速的方法鉴定牦牛肉制品是否有掺假或被其它肉品替代情况.在肉制品加工过程中,肉类原材料要经过绞碎、斩拌、蒸煮、熏烤、高温灭菌等加工过程,肉制品中蛋白质结构发生改变、变性或被破坏[9],通过蛋白质特性鉴别肉类品种掺假的可靠性较差.高温加工过程对于DNA的影响也较大,会导致DNA链断裂,影响DNA的分子检测[9].但是,如果被检测的目的片段未被完全破坏,就有可能建立LAMP体系对牦牛肉品进行鉴定.本试验目的在于建立一种快速鉴别牦牛肉制品中猪肉和鸡肉的LAMP法,并对加工过程中混入一定量的鸡肉和猪肉的检测下限进行了研究,以期从试验中获得一套理想、廉价、快速的方案对牦牛肉饼中掺杂的鸡、猪肉进行鉴定,为牦牛肉制品中动物源性成分的鉴定提供理论依据.
1 材料与方法
1.1 材料与试剂
牦牛后腿肉(主要是股四头肌)购于四川红原县本地屠宰场;鸡肉、猪肉购于成都本地好又多超市;DNA提取试剂盒、dNTPs和MgCl2购于大连宝生物工程有限公司;Bst DNA ploymerase large fragment购自New England Biolab公司;甜菜碱(Betaine)购自北京天泽公司;DNA Marker 100bp ladder购自天根生化科技(北京)有限公司.
1.2 仪器与设备
本研究使用的设备和仪器有Thermocouple测热仪(德国Ebro公司);恒温水浴锅HH6(国华电器);电热恒温鼓风干燥箱DHG-9203A(上海一恒);低温离心机 Centrifuge 5417R Eppendorf(Germany);离心机Mini Spain plus Eppendorf(Germany);超纯水系统Milli-Q MilliPO RE(France);凝胶成像系统 GEL DOC2000,BIO-RAD(America)及其他辅助设备.
1.3 方法与步骤
1.3.1 牦牛肉、鸡肉和猪肉饼的制备及DNA的提取
牦牛后腿肉在-20℃保藏,在室温解冻,去筋腱、脂肪,用绞肉机绞碎,制成直径65 mm厚度为12 mm的圆形模块.将制成的牦牛肉模块在170℃烤制到中心温度70℃[10]后,在室温下放置至冷却.鸡肉和猪肉饼的做法同上.从上述3种肉饼的中间部位取样100 mg,采用试剂盒的方法提取组织中的DNA,作为LAMP反应的模板.
1.3.2 引物设计
根据Ghovvati等[11]的研究结果,通过对牦牛、鸡和猪的序列进行比对分析,确定了这三种不同种属动物的特异性基因,并通过http://primerexplorer.jp/e在线软件分别针对牦牛的16S rRNA,鸡的12S rRNA和猪的12S rRNA-tRNA Val进行引物设计,由英潍捷基(上海)贸易有限公司合成.设计的引物序列见表1.

表1 鸡、猪和牦牛鉴别的引物序列Table 1 Primer sequences for identification of chicken,pork and yak meat
1.3.3 LAMP反应体系
LAMP反应体系总体积为25μL,主要包括:betaine浓度为 0.8 mol/L,Mg2+浓度为 4 mmol/L,dNTP浓度为1.4 mmol/L,10 ×buffer为 2.5μL,FIP、BIP 浓度为 0.8 μmol/L,F3、B3浓度为 0.1 μmol/L,LF、LB浓度为0.4 μmol/L,Bst DNA polymerase large fragment为8U,模版DNA为2μL,剩下的体积用灭菌水补齐.63℃恒温扩增60 min,80℃ 5 min结束.2%琼脂糖凝胶电泳100V 30 min.
1.3.4 LAMP引物特异性的检测
将所设计的引物分别对3种肉饼的DNA模板进行LAMP扩增,并将扩增产物进行电泳分析,观察电泳结果,验证所设计的引物特异性.
1.3.5 牦牛肉饼中掺杂的鸡肉、猪肉的检出限的检测
鸡肉和猪肉按照表2比例分别掺杂在牦牛肉饼中,并进行烤制.肉饼的制作和烤制及DNA的提取参照本文中的1.2.1的方法步骤,检出限的确定采用
1.2.3LAMP反应体系.
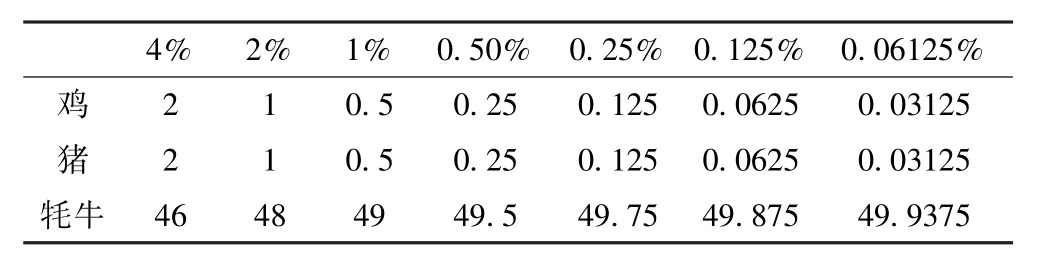
表2 掺杂在牦牛肉中鸡、猪肉的比例Table 2 Proportions of chicken and pork mixing in the yak meat
2 结果与分析
2.1 LAMP引物特异性检测
利用LAMP扩增分别对所设计的牦牛、鸡和猪肉的引物进行特异性检测.所设计的牦牛的引物进行LAMP扩增,只有牦牛肉扩增出特异性片段,而其他的肉类扩增结果显示为阴性,如图1所示,可见该方法具有良好的特异性.鸡和猪的引物特异性结果分别如图2、图3所示,也同样具有良好的特异性.掺杂其他肉类的牦牛肉饼在进行LAMP检测时,含有其他2种肉类的DNA不会对检测对象的引物起到干扰作用.
2.2 检出限
2.2.1 鸡肉的检出限
掺杂了鸡肉的牦牛肉饼参照1.2.1的方法进行烤制,然后用LAMP法进行检测,结果如图4所示.利用试剂盒的方法提取牦牛肉饼中DNA进行LAMP扩增的时候,当鸡肉含量为4% ~0.25%试均有特异性条带,当鸡肉含量为0.125% ~0.0625%时没有特异性条带.说明,本研究建立的LAMP检测方法对掺杂的鸡肉检出限为0.25%,该方法具有较低的检出限.
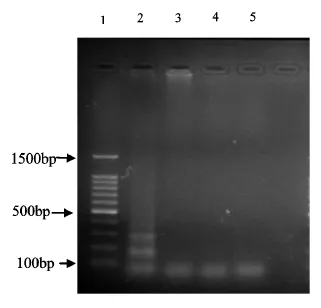
图1 LAMP反应牦牛引物特异性结果Fig 1 Results for the specificity of the yak primers for LAMP
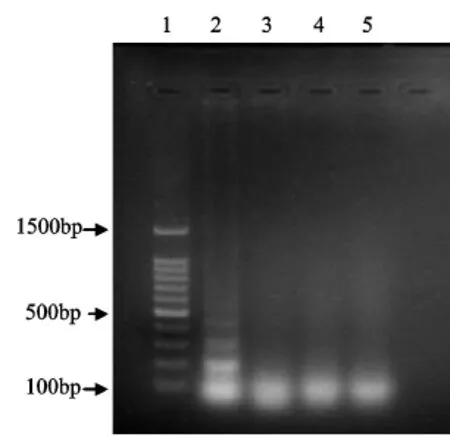
图2 LAMP反应鸡引物特异性结果Fig 2 Results for the specificity of the chicken primers for LA MP
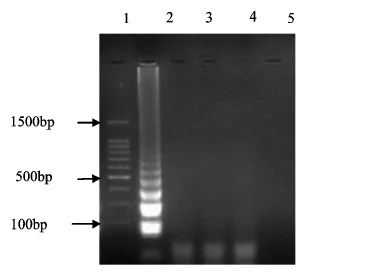
图3 LAMP反应猪引物特异性结果Fig 3 Results for the specificity of the pork primers for LAMP
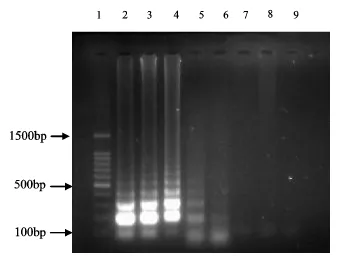
图4 牦牛肉饼中掺杂的鸡肉的检出限结果Fig 4 Results for the detection limit of chicken mixing in the yak meat
2.2.2 猪肉的检出限
参照2.2.1的方法,对掺杂猪肉的牦牛肉饼进行了LAMP检出限的检测,结果如图5所示.图5中2~7泳道均有目的梯形条带,而8泳道没有目的条带,说明采用该LAMP法对掺杂猪肉的检出限为0.125%.
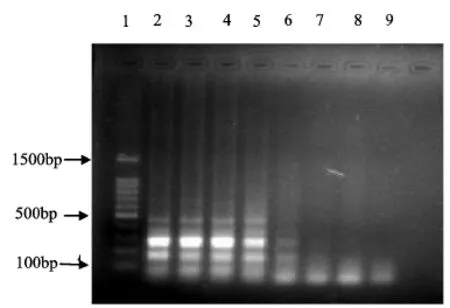
图5 牦牛肉饼中掺杂的猪肉的检出限结果Fig 5 Results for the detection limit of pork mixing in the yak meat
3 讨论
线粒体基因组具有种内高度保守性,在物种鉴别上被广泛应用[12].线粒体DNA具有较强的抗腐蚀性,并大量存在于组织细胞中,仅少量的样品也足以提供检测所需模板,因此从线粒体DNA水平上鉴别肉制品具有较高的可行性.何建文等[9]研究表明经过深加工处理的牦牛肉产品的核基因组DNA可以扩增到300bp左右的基因片段,足以对深加工产品进行检测分析.本研究中牦牛肉饼经过170℃高温烤制后DNA被破坏,而所设计的牦牛、猪和鸡引物的目的片段大小分别为193bp、187bp和214bp,均能通过试剂盒方法提取DNA模板后扩增出目的条带,印证了何建文等[9]的观点.
采用LAMP法对牦牛肉饼中掺杂的鸡肉和猪肉的检出限分别为0.25%和125%,比采用一般PCR方法检测[13-15]有很多优越性.在100mg牦牛肉饼样品中含有0.25mg猪肉或0.125mg鸡肉可以在2小时内检出,表明该方法灵敏度较高,并且特异性较好,具有准确、快捷和简便的特点.该方法不需要昂贵的PCR仪,在不要求高精密设备的条件下可在短时间内报告结果,具有很好的推广价值,因此,采用LAMP法检测肉品中是否掺有其他肉类具有较实用的价值.但是由于LAMP灵敏度较高,很容易造成扩增产物的污染,若在生产中采用凝胶电泳法和荧光染料法进行扩增产物的鉴定,则对环境的要求较高,即分区操作,必须每一区的仪器设备专用,并不适合在基层中推广.Wataru等[16]和Yukiko等[17]在微生物检测时采用的实时浊度仪根据LAMP反应中生成副产物白色硫酸镁沉淀,造成光强度差异来进行判断,在检测过程中不需要将盖子打开,能有效地控制污染,更为适合在基层推广.本研究首次报道了LAMP法在牦牛肉制品掺假检测,为市场肉类管理、肉品鉴别以及检测提供了可借鉴的方法和理论基础.
[1] NOTOMI T,OKAYAMA H,MASUBUCHI H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12):E63.
[2] NAGAMINE K,HASE T,NOTOMI T.Accelerated reaction by loop-mediated isothermal amplification using loop primers[J].Molecular and Cellular Probes,2002,16(3):223-229.
[3] 袁耀武,张亚爽,马晓燕,等.LAMP检测单核细胞增生性李斯特氏菌的研究[J].中国食品学报,2009,9(03):168-173.
[4] 鲁曦,师宝忠,王彬,等.LAMP法检测乳粉中的阪崎肠杆菌[J].现代食品科技,2010,26(05):540-543.
[5] 兰青阔,王永,赵新,等.转基因玉米LAMP检测体系的建立及应用[J].华北农学报,2010,25(04):49-52.
[6] 唐善虎,李雪,郝小倩.特定肉制品的LAMP法检测试剂盒及检测方法[P].国家发明专利,2012,申请号:201210187031.3.
[7] 杨丽霞,付淑君,彭新凯.环介导等温扩增法检测牛羊肉中的猪肉成分[J].食品与机械,2013,29(5):63-65.
[8] AHMED MU,HASAN Q,HOSSAIN MM,et al.Meat species identification based on the loop-mediated isothermal amplification and electrochemical DNA sensor[J].Food Control,2010(21):599-605.
[9] 何建文,韩建林,罗玉柱.利用不同方法从深加工牦牛肉产品中提取基因组DNA效果的比较[J],生物技术通报,2010(10):162-167.
[10] 唐善虎,王柳,余小贞,等.添加不同用量花生仁粉的重组牦牛肉饼的理化和感官特性研究[J].食品科学,2010,31(19):174-178.
[11] GHOVVATI S,NASSIRI MR,MIRHOSEINI SZ,et al.Fraud identification in industrial meat products by multiplex PCR assay[J].Food Control 2009(20):696-699.
[12] GIRISH PS,ANJANEYULU ASR,VISWAS KN,et al.Sequence analysis of mitochondrial 12S rRNA gene can identify meat species[J].Meat Science,2004,66(3):551-556.
[13] 杨宝华,宗卉,林庆燕,等.用分子生物学方法鉴别检测动物源性饲料中的牛羊源性成分[J].中国畜牧杂志,2002(01):3-5.
[14] 陈冬,柏凡,周明亮,等.基于线粒体12S rRNA基因鉴别混合牛肉及制品的牛种来源[J].遗传,2008(08):1008-1014.
[15] LAHIFF S,GLENNON M,LYNG J,et al.Real-time polymerase chain reaction detection of bovine DNA in meat and bone meal samples[J].Journal of Food Protection,2002,65(7):1158-1165.
[16] WATARU Y,MASANORI I,RYUJI K,et al.Development of a loopmediated Isothermal amplification assay for sensitive and rapid detection of Vibrio parahaemolyticus[J].BMC Microbiology,2008,8:163-170.
[17] HARA-KUDO Y,YOSHINO M,KOJIMA T,et al.Loop-mediated isothermal amplification for the rapid detection of Salmonella[J].FEMS Microbiology Letters,2005(253):155-161.

