miR-34a-5p对HaCaT细胞增殖及其靶基因Notch1表达的影响
朱 杰 王慧琴 赵宗峰 张 慧 康晓静 吴卫东
银屑病是一种常见的慢性炎症性皮肤病,是临床表型、遗传、环境和免疫因素相互作用的结果。四十多年的临床和基础研究阐明了银屑病的许多潜在致病机制。目前已有研究证明miR-34a-5p参与细胞自噬和细胞衰老的调节[1-3],且miR-34a-5p及其靶基因Notch1在银屑病皮损中的表达呈正相关性[4],然而miR-34a-5p对人角质形成细胞生物学性状的影响尚不清楚,故本实验在前期研究基础上进一步验证miR-34a-5p对HaCaT细胞增殖的影响,以及对靶基因Notch1调控情况的研究。
1 材料与方法
1.1 材料 miR-34a-5p模拟物、抑制物及SiRNA均有Qiagen公司设计合成,HaCaT细胞株(购自于上海富衡生物科技有限公司培养的银屑病患者外周正常皮肤角质细胞),DMEM培养基,胎牛血清(德国Gibco公司),0.25%的胰酶,转染试剂、RNA抽提试剂盒(均购于Qiagen公司),CO2培养箱,倒置显微镜,荧光定量PCR仪。
1.2 实验方法
1.2.1 细胞培养 用含有10%胎牛血清的DMEM培养基培养HaCaT细胞,待HaCaT细胞生长至80%~90%融合时,用胰酶将培养的细胞制备成单细胞悬液,用于后续实验。
1.2.2 优化转染试剂浓度 如表1配置3组转染复合物,转染后2 h在倒置荧光显微镜下观察转染前后细胞的死亡率、转染效率,选出最佳转染浓度。

表1 根据SiRNA选择最佳转染试剂浓度
1.2.3 MTT(CCK-8试剂)检测转染后HaCaT细胞的增殖活力 制备HaCaT单细胞悬液1.5~3.5×104/mL,每孔200 μL接种于96孔培养板,置37℃、5% CO2培养箱培养,细胞贴壁后,根据优化的转染试剂浓度分5组进行转染:mimic组、NC组、inhibitor组、inhibitor NC组、空白对照组(只添加培养基),每组设6个复孔,分别培养6、24、48、72 h后终止培养。避光条件下每孔加入CCK-8溶液20 μL,继续孵育2 h,在酶标仪上测定450 nm波长处的吸光度值(OD值),实验重复3次,以时间为横坐标,OD值为纵坐标,绘制生长曲线并计算细胞增殖活力,细胞活力=(处理组-空白对照组)/(NC组-空白对照组)×100%。
1.2.4 提取细胞总RNA 共设4组进行转染,即mimic组,NC组,inhibitor组,inhibitor NC组。根据优化的转染浓度配置转染复合物进行转染,转然后48 h,用miRNeasy Mini kit分别抽提4组细胞的总RNA。
1.2.5 反转录荧光定量(RT-qPCR) 根据miScript-II-RT-Kit-EN-反转录试剂盒说明书,将4组RNA分别反转录成cDNA,每组设置三个复孔,以GAPDH为内参扩增Notch1.通过PCR仪的系统软件得出内参基因和目的基因的Ct值,再计算出4组的△Ct值,△△Ct值以及2-△△Ct,比较4组间基因表达的差异。
2 结果
2.1 miR-34a-5p对人HaCaT细胞活力的影响 MTT法检测结果表明,与转染空白对照组相比,在不同时间点不同浓度的mimic组MTT实验OD值均有升高,转然后48 h,mimic组、inhibitor组、inhibitor NC组HaCaT细胞的增殖活力分别为:39.7%、15.7%、20.7%,与NC组(21.3%)相比,差异有统计学意义(P<0.05)。实验结果显示转然后mimic组HaCaT细胞增殖活力明显增强,inhibitor组HaCaT细胞增殖活力下降,NC组和inhibitor NC组HaCaT细胞增殖活力与空白对照组相比无明显变化。
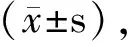

a:转染前 b:转染后2小时 c:转染后2小时荧光显微镜下
根据图a和图b比较转染前后死亡细胞数,评估细胞死亡率<10%,根据图b和图c比较转染后普通显微镜及荧光显微镜下转染成功细胞数,评估转染效率>75%,故当转染试剂为3 μL时,即可达最优转染效率。
图1 HiPerFect Reagent 3 μL时,转染前后细胞情况
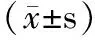
表2 转染后各组Notch1的表达量
3 讨论
最新的研究表明银屑病有一个特定的miRNA表达谱,miRNA-217、181 b、146 a等均参与银屑病发生发展的调控[5-7]。本课题组前期研究显示与正常皮损相比miRNA-34a在银屑病皮损组织中表达增高,表现为表皮全层高表达[4]。miRNA-34a通过次氮基三乙酸铁诱导氧化应激促进癌组织中血管再生,且miRNA-34a有促进细胞增殖的作用[8],这与银屑病皮损中血管迂曲扩张、细胞过度增殖的特点相一致,并与本实验结果相符。本实验结果表明,转染了miRNA-34a-5p mimic的HaCaT细胞增殖活力明显增强,转染了miRNA-34a-5p inhibitor的HaCaT细胞增殖活力明显下降,两组与NC组相比差异有统计学意义(P<0.05),提示miRNA-34a-5p能促进HaCaT细胞增殖。
Notch1是miRNA-34a-5p靶基因之一。参与调控细胞的基因调控机制,包括细胞命运决定、干细胞维持、增殖、分化和存活[9,10]。文献报道Notch1在正常组织和银屑病皮损中均有表达,但在银屑病皮损中表达更高,Notch1在细胞核表达可以加剧银屑病恶化[11]。故Notch1参与银屑病发生发展的调控。本实验结果显示,HaCaT细胞转染后,mimic组和inhibitor组Notch1表达量分别为2.78±1.30和0.37±0.46,与NC组相比,差异有统计学意义(P<0.05)。由此推测miRNA-34a-5p参与对Notch1的调控作用,miRNA-34a在人HaCaT细胞中有上调Notch1的作用。综上所述,miRNA-34a可促进人HaCaT细胞增殖,上调Notch1 mRNA表达,故miRNA-34a促进HaCaT细胞增殖的机制可能与Notch1表达上调有关。
由此推测,下调miRNA-34a-5p以抑制下游靶基因Notchl表达,可能对银屑病的发展过程有一定的抑制作用。以miRNA-34a-5p为靶点来进行研究,有望为寻常型银屑病的发病机制及治疗的研究提供一个新的思路,为本课题组进一步的研究奠定了基础。
[1] Bernard A, Klionsky DJ. Defining the membrane precursor supporting the nucleation of the phagophore[J]. Autophagy,2014,10(1):1-2.
[2] Wiggins JF, Ruffino L, Kelnar K, et al. Development of a lung cancer therapeutic based on the tumor suppressor microRNA-34[J]. Cancer Res,2010,70(14):5923-5930.
[3] Lodygin D, Tarasov V, Epanchintsev A, et al. Inactivation of miR-34a by aberrant CpG methylation in multiple types of cance[J]. Cell Cycle,2008,7(16):2591-2600.
[4] 吴卫东, 陈春丽,赵宗峰,等.寻常型银屑病患者皮损中miRNA-34a及其靶基因Notch1的表达及意义[J].皮肤性病诊疗学杂志,2015, 22: 423-427.
[5] Zhu HG, Hou LY, Liu JJ, et al. MiR-217 is down-regulated in psoriasis and promotes keratinocyte differention via targetiong GRHL2[J]. Science Direct,2016,471:169-176.
[6] Feng C, Bai M, Yu NZ, et al. MicroRNA-181b negulates the proliferation of human epidermal keratinocytes in psoriasis through targeting TLR4[J]. Cell,2017,21(2):278-285.
[7] Srivastava A, Nikamo P, Lohcharoenkal W, et al. MicroRNA-146a suppresses IL-17-mediated skin inflammation and is genetically associated with psorasis[J]. J Auergy Clin Immunol,2017,139(2):550-561.
[8] Khokon KD, Yi Z, Yu TL, et al. Association of microRNA-34a overexpression with proliferation is cell type-dependent[J]. Cancer Science,2007, 98:1845-1852.
[9] Jacques T, Paticia R, Bertrand F, et al. Notch signalling is linked to epidermal cell differentiation level in basal cell carcinoma, psoriasis and wound healing[J]. BMC Dermatol,2002,2(7):1-12 .
[10] Tami O, Susumu T, Tatsuya T, et al. Notch signaling may be involved in the abnormal differentiation of epidermal keratinocytes in psoriasis[J]. Acta Histochem Cytochem,2014,47:175-183.
[11] Asmaa GA, Alaa HM, Amany S, et al. Up-regulation of Notch-1 in psoriasis: an mmunohistochemical study[J]. Ann Diagn Pathol,2012, 16: 177-184.

