口服6种益生菌的混合制剂对哮喘小鼠气道炎症的影响及其机制
马婧一,张 娟,李秋红,孙 新
(空军军医大学西京医院儿科,西安 710032;*
支气管哮喘是一种以Th2型免疫反应为主的多种细胞及细胞组分参与的慢性呼吸系统疾病,严重威胁人类健康,消耗大量医疗卫生资源[1,2]。全球约有3亿哮喘患者,并且患病率仍在上升。在不同年龄人群中,儿童哮喘患病率上升明显[3]。然而目前哮喘的发病机制尚未完全阐明。调节性T细胞(Tregs)是独立的CD4+T细胞亚群,Tregs通过与效应T细胞相互作用和/或分泌抑制性细胞因子如TGF-β、IL-10等发挥抗炎作用及免疫负调控的作用[4]。因此,Tregs在维持免疫耐受和抑制过敏性炎症反应过程中发挥了至关重要的作用。Tregs数量减少或功能异常可能成为哮喘的发病机制之一。哮喘主要通过糖皮质激素等药物治疗,患者依从性差,疗效不甚满意,且不良反应严重[5,6]。益生菌是指活的、在摄入一定数量后对宿主有益的微生物,主要包括乳酸杆菌、双歧杆菌、肠球菌、非致病性大肠埃希菌以及酵母菌等[7]。近年来,研究表明益生菌能够调节肠道微生物,维持肠道屏障的完整性,调节局部和全身免疫反应,维持免疫系统稳态,抑制炎症性免疫反应。临床已成功将其应用于辅助预防和治疗感染性疾病、炎症性肠病及过敏性疾病[8-10]。然而益生菌对哮喘的治疗作用及机制尚不明确。本研究通过建立小鼠哮喘模型,观察6种益生菌混合对哮喘气道炎症的影响,探讨其在哮喘治疗中的机制是否与Tregs有关,以期为临床哮喘的防治提供实验室依据。
1 材料与方法
1.1 主要试剂及仪器
卵清蛋白OVA(美国Sigma公司),氢氧化铝(天津市天力化学试剂公司),小鼠IL-4 ELISA试剂盒(Mouse IL-4 ELISA Kit,美国ReyBiotech公司,检测范围0-200 pg/ml),小鼠IL-5 ELISA试剂盒(Mouse IL-5 ELISA Kit,美国ReyBiotech公司,检测范围0-500 pg/ml),小鼠IL-10 ELISA试剂盒(Mouse IL-10 ELISA Kit,美国ReyBiotech公司,检测范围0-5 000 pg/ml),小鼠IL-13 ELISA试剂盒(Mouse IL-13 ELISA Kit,美国ReyBiotech公司,检测范围0-2 000 pg/ml),空压雾化器(欧姆龙大连有限公司),自动酶标检测仪(美国Bio-Rad公司),流式细胞仪BD FACSCalibur(BD Biosciences)。
1.2 益生菌的混合制剂的制备及保存
本实验所用益生菌为6种益生菌的混合制剂,菌粉的活菌含量为5×1010CFU/g。包括格氏乳杆菌(Lactobacillusgasseri,LK001),占40%;唾液乳杆菌(Lactobacillus salivariusi,LK002),占20%;约氏乳杆菌(Lactobacillus johnsonii,,LK003),占15%;副干酪乳杆菌(Lactobacillus paracasei, LK004),占5%,罗伊氏乳杆菌(Lactobacillus reuteri, LK005),占5%;动物双歧杆菌(Bifidobacterium animalis, LK011),占15%。菌粉由宁波绿康康复科技有限公司提供。益生菌菌粉保存于-20 ℃冰箱中。称取菌粉1 g,将其溶解于10 ml PBS溶液中,并进行两次倍比稀释,配制成浓度5×107CFU/ml的混合益生菌溶液。
1.3 实验动物及小鼠哮喘模型的建立
SPF级6-8周雄性BALB/c小鼠60只,体质量为21-25 g,购自空军军医大学实验动物中心,动物生产许可证号:SCXK(陕)2014-002。将小鼠随机分成三组,每组20只。分别为正常对照组(control),哮喘模型组(OVA)和治疗组(OVA+LK)。OVA组和OVA+LK组小鼠于第0,14,28,42天给予含有100 μg OVA和1.5 mg Al(OH)3的生理盐水溶液腹腔注射致敏,从第21天开始到第46天,使用1%OVA溶液对小鼠进行雾化激发,每次雾化持续30 min,每周3次。正常对照组用生理盐水进行腹腔注射及雾化吸入。治疗组小鼠于第0-46天,每天8:00给予5×107CFU/ml混合益生菌溶液灌胃,每只200 μg/d。正常对照组和哮喘组小鼠给予PBS溶液灌胃。
1.4 BALF收集及白细胞分类计数
每只小鼠给予2%的戊巴比妥钠溶液(0.045 ml/g)腹腔注射麻醉,切开小鼠颈部皮肤,钝性分离颈部肌肉及结缔组织,暴露气管。用自制穿刺针气管插管并连接1 ml注射器,用4 ℃预冷PBS灌洗全肺肺泡,每次0.8 ml,充分回收至少0.6 ml,反复3次。将收集的BALF于4 ℃,1 200 r/min,离心10 min。收集上清,-20 ℃保存。用1 ml无菌PBS溶液重悬沉淀,涂片,瑞氏染色,白细胞分类计数。
1.5 HE染色观察小鼠肺组织病理变化
收集肺泡灌洗液之后,解剖小鼠,取每组小鼠的左下肺叶,4%多聚甲醛溶液固定,梯度乙醇脱水、石蜡包埋、切片,常规HE染色并在光镜下观察小鼠肺组织病理改变。
1.6 ELISA检测BALF中细胞因子水平
按照ELISA试剂盒使用说明检测BALF中IL-4、IL-5、IL-10、IL-13细胞因子,使用酶标仪在450 nm处测定OD值并进行浓度计算,比较不同组小鼠BALF中4种细胞因子水平差异。
1.7 流式细胞仪检测Tregs比例变化
摘取小鼠所有肺引流淋巴结,移至200目滤网上,用1 ml注射器尾部顺时针研磨,用流式液冲洗研磨后的组织并收集研磨液于离心管中,4 ℃,1 000 r/min,离心5 min,弃上清,加入1 ml流式液,制备肺引流淋巴结单细胞悬液并计数。将单细胞悬液转移至对应编号的流式管中,每管100 μl,每管细胞数目为106-107个。加入CD4-PerCP,CD25-APC(BioLegend),冰上避光孵育15-20 min,流式液洗2次,1 000 r/min,离心5 min,去上清,每管加入1 ml固定液固定45-60 min,用破膜液洗2次(每次加入2 ml破膜液),1 000 r/min,离心5 min,去上清,重悬细胞于100 μl破膜液中,加入Foxp3-PE(BioLegend)室温避光孵育至少30 min,用流式液洗2次,1 000 r/min,离心5 min,去上清,重悬细胞于0.3 ml流式液,待检测。
1.8 统计学分析
2 结果
2.1 小鼠行为学观察
模型组20只小鼠,在统计节点时死亡1只小鼠,其中16只小鼠在雾化过程中都出现了烦躁不安,搔抓头面部,呼吸急促,腹部抽搐,安静少动等哮喘急性发作的症状,认为造模成功。对照组及治疗组小鼠未见明显异常行为。
2.2 小鼠肺组织病理变化
肺组织HE染色结果显示,正常对照组小鼠肺泡结构完整,气道周围无明显炎症细胞浸润;哮喘组进行组织学染色的10只小鼠中9只小鼠肺组织出现明显病理改变,肺部炎症反应明显,部分肺泡壁断裂破坏,互相融合,气道周围及肺泡内炎症细胞明显增多;治疗组小鼠肺部炎症反应减轻,肺部炎症细胞浸润明显减少(见图1)。
2.3 BALF中炎症细胞变化
与正常对照组相比,哮喘小鼠BALF中嗜酸粒细胞(P<0.001)、中性粒细胞(P<0.000 1)和淋巴细胞(P<0.05)明显增多;治疗组小鼠与哮喘模型组小鼠相比,BALF中嗜酸粒细胞(P<0.001)、中性粒细胞(P<0.000 1)和淋巴细胞(P<0.05)明显减少(见表1,图2)。

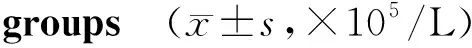

组别n嗜酸粒细胞中性粒细胞淋巴细胞巨噬细胞 对照组70.64±0.142.25±0.380.83±0.470.76±0.21 模型组72.43±0.28**6.48±0.14***2.13±0.25*1.22±0.35 治疗组70.72±0.33##3.13±0.31###0.92±0.24#0.83±0.18
与对照组比较,*P<0.05,**P<0.01,***P<0.001;与模型组比较,#P<0.05,##P<0.01,###P<0.001
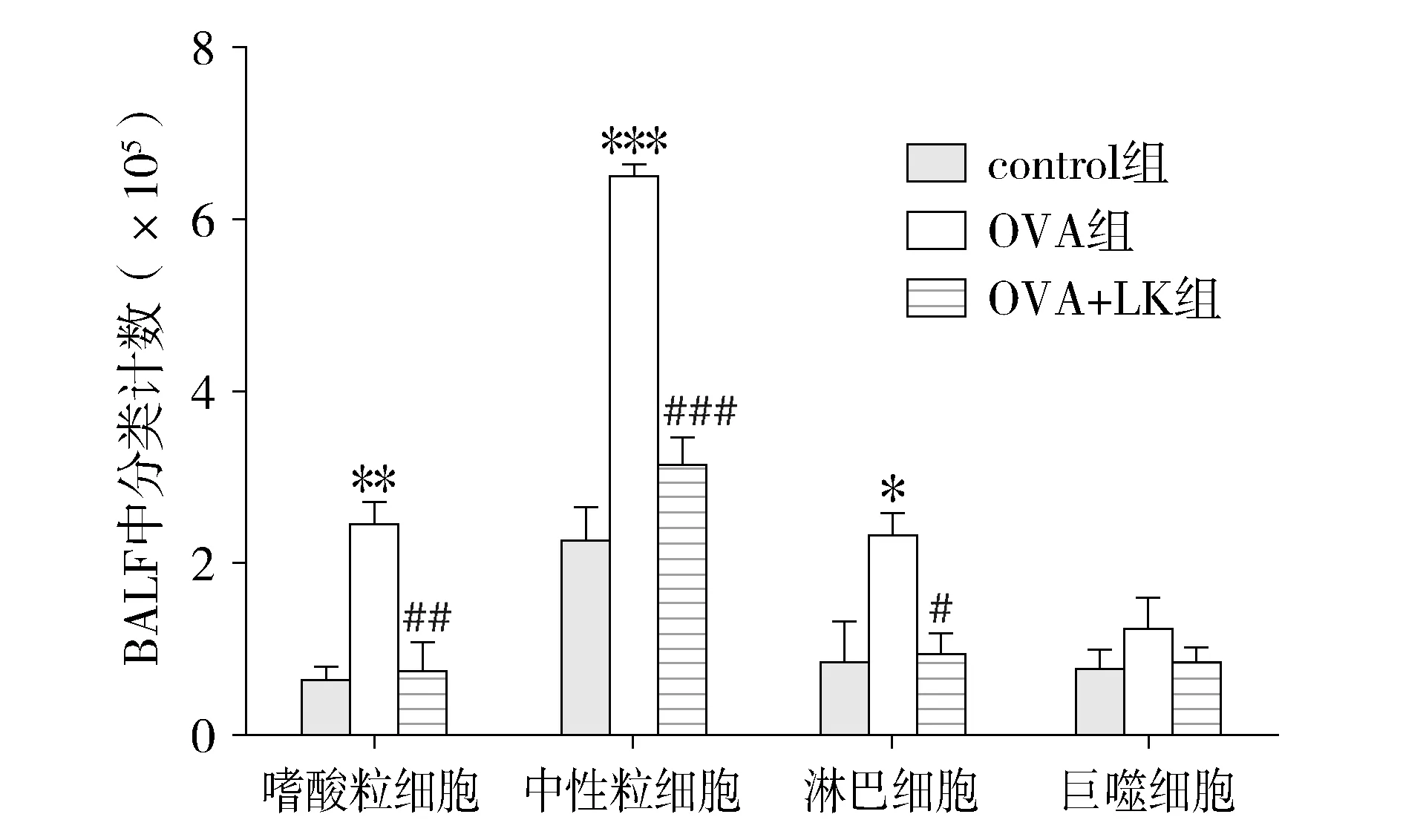
与control组比较,*P<0.05,**P<0.001,***P<0.000 1与OVA组比较,#P<0.05,##P<0.001,###P<0.000 1图2 小鼠肺泡灌洗液(BALF)白细胞分类计数结果Figure 2 Differential count of leukocytein bronchoalveolar lavage fluid(BALF)
2.4 BALF中细胞因子水平变化
与正常对照组比较,哮喘模型组小鼠BALF中Th2型细胞因子IL-4(P<0.05)、IL-5(P<0.05)、IL-13(P<0.05)水平明显升高,IL-10水平明显降低(P<0.05);治疗组相比于哮喘模型组BALF IL-4(P<0.01)、IL-5(P<0.05)、IL-13(P<0.05)水平明显降低,IL-10水平明显升高(P<0.01,见表2,图3)。
2.5 小鼠肺引流淋巴结中Tregs比例变化
流式细胞检测结果显示,哮喘组小鼠肺引流淋巴结中Tregs在CD4+T细胞中比例呈下降趋势;治疗组小鼠与哮喘组小鼠相比,肺引流淋巴结中Tregs在CD4+T细胞中比例明显升高(P<0.01,见图4,5)。



组别n IL-4 IL-5IL-10 IL-13 对照组52.2371±1.5966 26.5509±9.7263140.0845±34.217419.9110±13.4267 模型组67.4272±3.1063* 54.7833±22.5316*80.0767±23.0539*39.6491±13.4652* 治疗组72.5983±2.4846## 27.8799±6.8445#165.1693±40.8904##21.3559±10.6087#
与对照组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01

与对照组(control)相比,*P<0.05;与哮喘模型组(OVA)相比,#P<0.05,##P<0.01图3 小鼠肺泡灌洗液(BALF)中IL-4,IL-5,IL-10,IL-13的浓度Figure 3 Concentrations of IL-4, IL-5, IL-10, IL-13 in bronchoalveolar lavage fluid (BALF) of mice
3 讨论
支气管哮喘是一种常见的以多种炎症细胞浸润、气道高反应性、可逆性的气流受限为特征的慢性气道炎症性疾病。哮喘的患病率呈逐年上升的趋势,目前中国约有2 000万人罹患哮喘。哮喘流行病学调查结果显示,我国儿童哮喘患病率较10年前又有所增加。城市0-14岁儿童哮喘现患率为0.42%-5.73%,平均为2.32%,累计患病率为0.48%-7.57%,平均为3.02%[11-12]。目前哮喘的发病机制尚未被完全阐明,哮喘尚不能被完全根治,只能通过药物治疗达到控制状态。因此,研究哮喘的发病机制,寻找哮喘治疗新途径新靶点对于哮喘的防治具有重大意义。
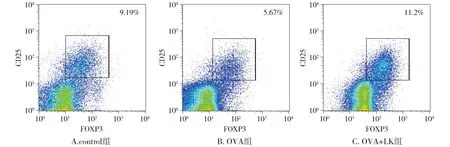
图4 Tregs占CD4+T细胞比例的流式图Figure 4 Fluorescence-activated cell sorting plots of the proportion of Tregs in CD4+T cells

与OVA组比较,**P<0.01图5 肺引流淋巴结中Tregs占CD4+T细胞的比例Figure 5 Comparison of the proportion of Treg cells in CD4+T cells of lung-draining lymph nodes
按菌株来源和作用方式,益生菌可分为原籍菌、共生菌和真菌[13]。原籍菌来源于人体肠道菌群,如双歧杆菌、乳杆菌、粪链球菌等,可通过直接补充原籍菌调节肠道菌群、改善肠道屏障功能、维持免疫系统稳态,预防和治疗过敏性炎症疾病。近年来,临床和实验室研究表明益生菌可以调节肠道菌群,抑制包括哮喘在内的多种过敏性疾病的发生和发展[14-16]。研究表明,哮喘的免疫学发病机制主要为Th1/Th2比例失衡,在树突状细胞、支气管上皮细胞及其分泌的细胞因子如胸腺基质淋巴细胞生成素(TSLP)等的作用下,初始T细胞(Th0)向Th2型细胞分化增加,导致Th2细胞数量增多和功能亢进,分泌大量Th2型细胞因子如IL-4,IL-5,IL-13,促进嗜酸性粒细胞、中性粒细胞等炎症细胞聚集和浸润,造成嗜酸性粒细胞为主的炎症反应,同时Th2型细胞在淋巴结中与B细胞相互作用,诱导B细胞转化为浆细胞,分泌大量IgE抗体,引发变态反应[5]。本实验HE染色结果显示,5种乳酸杆菌和一种双歧杆菌的混合益生菌可以减轻哮喘引起的肺部炎症细胞浸润,减轻哮喘引起的气道慢性炎症;混合益生菌制剂治疗后,BALF中嗜酸粒细胞(P<0.001)、中性粒细胞(P<0.000 1)和淋巴细胞(P<0.05)明显减少,进一步说明益生菌治疗能够抑制哮喘小鼠的气道炎症,减少嗜酸性粒细胞、中性粒细胞、淋巴细胞等炎性细胞浸润。治疗组相比于哮喘模型组BALF IL-4(P<0.01)、IL-5(P<0.05)、IL-13(P<0.05)水平明显降低,说明益生菌治疗能够抑制哮喘小鼠的Th2型免疫反应,对哮喘具有较好的治疗作用。
Tregs是T淋巴细胞中表达CD4、CD25以及转录因子Foxp3的一类细胞亚群,其正常功能对于保持自身抗原耐受、限制慢性炎症、调节淋巴细胞增殖的稳态以及防止自身免疫性疾病的发生都必不可少,Tregs通过表达可溶性或膜结合的抑制性分子调节抗原引起的T细胞适应性免疫应答,从而抑制过敏性炎症[4]。研究表明,Tregs可以通过分泌抑制性细胞因子IL-10、TGF-β和IL-35发挥免疫抑制功能[17-19]。Eduardo Mendes等[20]发现口服双歧杆菌(Bifidobacterium longum51A)可以增加去卵巢的哮喘小鼠BALF中Tregs比例。Jang等[21]的研究表明,乳酸杆菌(Lactobacillus Rhamnosus)对哮喘小鼠的保护作用与脾脏中Tregs增加有关。本研究结果表明,口服6种混合益生菌增加了肺引流淋巴结中Tregs在CD4+T细胞中的比例,促进了BALF中抑制性细胞因子IL-10的产生,与上述研究结果相一致。混合益生通过诱导肺组织Tregs产生,促进Tregs表达抑制性细胞因子,从而抑制抗原引起的效应性T细胞增殖和Th2型细胞因子的产生,抑制肺部过敏性炎症。
综上所述,本研究表明口服6种混合益生菌可以改善哮喘小鼠气道过敏性炎症,减少BALF中炎症细胞数量,抑制Th2型细胞因子表达,同时混合益生菌能够诱导肺引流淋巴结中Tregs的产生,促进相关抑制性细胞因子IL-10的表达,发挥免疫负调控的作用,抑制抗原引起的过敏性炎症,对哮喘具有良好的治疗作用,可能成为哮喘治疗的新方法。
参考文献:
[1] Galli SJ, Tsai M, Piliponsky AM. The development of allergic inflammation[J]. Nature, 2008, 454(7203): 445-454.
[2] Fahy JV. Type 2 inflammation in asthma-present in most, absent in many[J]. Nat Rev Immunol, 2015, 15(1):57-65.
[3] 刘传合,陈育智.儿童哮喘流行病学及防治现状分析[J].中国实用儿科杂志,2013,28(11):809-811.
[4] Noval Rivas M, Chatila TA. Regulatory T cells in allergic diseases[J].J Allergy Clin Immunol, 2016, 138(3):639-652.
[5] Martinez FD,Vercelli D.Asthma[J].Lancet,2013,382(9901):1360-1372.
[6] 洪建国.哮喘治疗研究进展[J].临床儿科杂志,2008,26(1):9-11.
[7] Guarner F, Schaafsma GJ. Probiotics[J]. Int J Food Microbiol, 1998, 39(3):237-238.
[8] Kalliomäki M, Salminen S, Poussa T,etal. Probiotics and prevention of atopic disease: 4-year follow-up of a randomized placebo-controlled trial[J]. Lancet, 2003, 361(9372):1869-1871.
[9] Saez-Lara MJ, Gomez-Llorente C, Plaza-Diaz J,etal. The role of probiotic lactic acid bacteria and bifidobacteria in the prevention and treatment of inflammatory bowel disease and other related diseases: a systematic review of randomized human clinical trials[J]. Biomed Res Int, 2015, 2015:505878.
[10] Kotzampassi K, Giamarellos-Bourboulis EJ. Probiotics for infectious diseases: more drugs, less dietary supplementation[J]. Int J Antimicrob Agents, 2012, 40(4):288-296.
[11] 全国儿童哮喘防治协作组.中国城区儿童哮喘患病率调查[J].中华儿科杂志,2003,41(2):123-127.
[12] 全国儿科哮喘协作组,中国疾病预防控制中心环境与健康相关产品安全所.第三次中国城市儿童哮喘流行病学调查[J].中华儿科杂志,2013,51(10):729-735.
[13] 郑跃杰,黄志华,刘作义,等.微生态制剂儿科应用专家共识[J].中国实用儿科杂志,2011,26(1):20-24.
[14] Wang X, Hui Y, Zhao L,etal. Oral administration of Lactobacillus paracasei L9 attenuates PM2.5-induced enhancement of airway hyperresponsiveness and allergic airway response in murine model of asthma[J]. PLoS One, 2017, 12(2):e0171721.
[15] Forsythe P, Inman MD, Bienenstock J. Oral treatment with live Lactobacillus reuteri inhibits the allergic airway response in mice[J]. Am J Respir Crit Care Med, 2007, 175(6):561-569.
[16] Huang YJ, Marsland BJ, Bunyavanich S,etal. The microbiome in allergic disease: current understanding and future opportunities-2017 PRACTALL document of the American Academy of Allergy, Asthma & Immunology and the European Academy of Allergy and Clinical Immunology[J]. J Allergy Clin Immunol, 2017, 139(4):1099-1110.
[17] Kitani A, Fuss I, Nakamura K,etal. Transforming growth factor (TGF)-beta1-producing regulatory T cells induce Smad-mediated interleukin 10 secretion that facilitates coordinated immunoregulatory activity and amelioration of TGF-beta1-mediated fibrosis[J]. J Exp Med, 2003, 198:1179-1188.
[18] Nakamura K, Kitani A, Fuss I,etal. TGF-1 plays an importantrole in the mechanism of CD4+CD25+regulatory T cell activity in both humans and mice[J]. J Immunol, 2004, 172:834-42.
[19] Collison LW, Workman CJ, Kuo TT,etal. The inhibitory cytokineIL-35 contributes to regulatory T-cell function[J]. Nature, 2007, 450:566-569.
[20] Mendes E, Acetturi BG, Thomas AM,etal. Prophylactic supplementation of Bifidobacterium longum 51A protects mice from ovariectomy-induced exacerbated allergic airway inflammation and airway hyperresponsiveness[J]. Front Microbiol, 2017, 8:1732.
[21] Jang SO, Kim HJ, Kim YJ,etal. Asthma prevention by Lactobacillus Rhamnosus in a mouse model is associated withCD4+CD25+Foxp3+T cells[J]. Allergy Asthma Immunol Res, 2012, 4(3):150-156.
——中国益生菌信息与技术交流平台

