脂肪基质干细胞促进脂肪移植后血管化的研究
吕成鹏,倪 华,马 锐,李 龙,刘 斌,刘彦普
(1陕西省人民医院口腔科,西安 710068;2空军军医大学口腔医院口腔颌面外科;3空军军医大学口腔医院组织工程研发中心;4西安市儿童医院麻醉科;5深圳市南山区蛇口人民医院口腔科;6空军军医大学口腔医院动物实验中心;*通讯作者,E-mail:Liuyanpu@fmmu.edu.cn)
1893年Neuber提出自体脂肪移植概念,1911年Bruning对这种方法进行改良,运用注射方法进行脂肪移植。脂肪移植在整形和重建领域曾广受欢迎,然而,移植后的脂肪吸收(20%-90%)限制了脂肪移植的运用,学者们认为脂肪吸收与移植脂肪组织血管化不佳有关[1,2]。Zuk等[3]首先证实从脂肪组织中能够获取血管基质成分(stromal vascular fraction,SVF),其具有间充质干细胞的多项分化能力和CD分子表型,随后被命名脂肪基质干细胞(adipose derived mesenchymal stem cells,ADSCs)。ADSCs能被成功地诱导成为脂肪细胞、成软骨细胞、肝脏细胞、心肌细胞、成骨细胞和神经元细胞[4-9],ADSCs的多向分化潜能被运用到神经修复、急性心梗治疗等多个领域[5,10-12]。本实验利用脂肪基质干细胞的多向分化能力,探讨其对于移植脂肪后血管化的影响。
1 材料及方法
1.1 实验动物
6月龄新西兰大白兔3只,体质量2.5-3 kg,由空军军医大学口腔医院实验动物中心提供。6周龄裸鼠6只,雌性,由空军军医大学实验动物中心提供和饲养。移植后裸鼠分为两组:对照组(脂肪颗粒+生理盐水)和实验组(脂肪颗粒+ADSCs)。
1.2 主要试剂及仪器
高糖DMEM与胎牛血清来源于Gibco公司,Ⅰ型胶原酶、β-甘油磷酸钠来源于Sigma公司,3-异丁基-1-甲基黄嘌呤(IBMX)、吲哚美辛、茜素红来源于Peprotech公司,小鼠抗兔CD31-IgG单克隆抗体来源于Abcam公司,抗小鼠DAB免疫组化试剂盒来源于博奥生公司;B型超声诊断仪来源于深圳维尔德公司,显微镜为Leica RM2126。
1.3 ADSCs的分离培养
取新西兰兔,3%戊巴比妥钠按照1 ml/kg从耳缘静脉给药,待完全麻醉后用电推脱毛;切去双侧腹股沟及颈背部的皮下脂肪,仔细清除包被脂肪外的筋膜和血管,PBS反复冲洗,去除红细胞;剪碎切取的脂肪组织,用DMEM高糖配制1%Ⅰ型胶原酶37 ℃消化1 h;1 000 r/min离心5 min,弃上清。加入DMEM培养基(含双抗,10%胎牛血清,292 mg/L的谷氨酰胺,50 mg/L的Vitamin C)重悬浮;接种于25 cm2培养瓶中,5%CO2,37 ℃饱和湿度培养,3 d后换液,后隔日换液;5-7 d后按照1 ∶2比例传代,第二代细胞以1 ∶3传代。
1.4 多向分化诱导能力的检测
通过成脂和成骨诱导来鉴定ADSCs的多向分化能力。成脂诱导:取第3代的ADSCs细胞,以1×105/cm2密度接种于1.2 cm×1.2 cm的盖玻片上,细胞密度达80%以后加入成脂诱导培养基,每3 d换1次液,7 d后行油红O染色。成骨诱导:取第3代的ADSCs细胞,以1×105/cm2密度接种于1.2 cm×1.2 cm的盖玻片上,细胞密度达80%以后加入成骨诱导培养基,每3 d换1次液,4周后行茜素红染色。油红O染色:4%的多聚甲醛固定15 min,PBS洗3遍,60%异丙醇淋洗。浸入油红O染液10 min,60%异丙醇分色至背景无色,双蒸水洗1遍,苏木精复染,晾干,甘油明胶封片,镜检。茜素红染色:4%的多聚甲醛固定15 min,PBS洗3遍,加1%茜素红溶液,37 ℃染色30 min,双蒸水洗去多余的染料,晾干,甘油明胶封片,镜检。
1.5 脂肪移植物的制备及移植方法
3%戊巴比妥钠1 ml/kg,从兔耳缘静脉注射;待兔麻醉后,固定,消毒铺巾;切去双侧颈背部和腹股沟处的脂肪,放入无菌培养皿中;用PBS冲洗两次,修剪去除多余的血管和纤维结缔组织;用无菌手术剪将脂肪组织切割成为直径为1 mm3的颗粒。实验组每个样本ADSCs为1×106个。
用1 ml的针管18号白色针头吸取脂肪移植物;在裸鼠背部皮下利用针头潜行分离,注射脂肪复合体,采用同体对照试验,每只裸鼠4个注射位点,对照组及实验组各12个标本,每个点注射0.3 ml脂肪移植物。
1.6 B超体积测量方法
通过B超检测对移植脂肪进行测量。其中介质为水,测量始终由1位固定医生执行以减少系统误差。测量指标为脂肪组织的横径、纵径和厚度,通过计算公式:1/2abc(a横径、b纵径、c厚度)来计算体积[13]。在第1,2,4,6周进行测量。存活率(%)=术后各个时间点的脂肪体积/术后当天脂肪体积。
1.7 CD31免疫组化及微血管密度分析
CD31染色步骤按照操作说明书进行,DAB显色,其中PBS替代CD31抗体作阴性对照。运用image pro plus 6.0(IPP)软件,分析1,2,4,6周CD31染色免疫组化图片(×200)。从照相、显微镜、相机排除误差。随机选取每个时间点5张图片进行测量分析。测量图片的area sum为5034313,用每次测量的area sum/5034313(%)即为获得的微血管密度[14,15]。
1.8 统计学分析
统计分析运用PASW Statistics 18.0软件,对移植后脂肪的存活率和微血管密度进行分析。分析方法:运用重复测量的方差分析来评价对照组与实验组体积随时间变化的总体区别,运用t检验分析两组间血管密度差异。
2 结果
2.1 脂肪基质干细胞(ADSCs)的原代培养及多向分化潜能的鉴定
原代培养的ADSCs在8 h开始逐渐贴壁,24 h完全贴壁,72 h换液,细胞呈短梭形、多角形,传代后逐渐变成均一的长梭形,传至第5代,细胞生长旺盛。取第3代的细胞进行成脂、成骨诱导。加入成脂诱导液后,细胞开始变为多角形,3 d后细胞内可见较小的脂滴形成,7 d时脂滴变大。油红O染色见脂肪滴染色呈红色阳性(见图1A、B)。加入成骨诱导液后3 d,细胞逐渐变成短梭形,4周后茜素红染色阳性(见图1C、D)。培养的脂肪基质干细胞(ADSCs)具有多向分化能力。
2.2 脂肪基质干细胞(ADSCs)对脂肪移植生存率的影响
第1,2,4,6周的脂肪移植物大体肉眼观察见图2。实验移植裸鼠均存活,脂肪移植物健康,无感染及排斥反应发生。随时间变化,裸鼠背部脂肪移植物随时间移植物体积逐渐缩小。第6周时,实验组移植物体积明显大于对照组。
B超对第1,2,4,6周的移植脂肪物体积变化(见图3)进行测量,并计算其存活率。从B超测量结果可以看出对照组与实验组的存活率随时间延长逐渐降低,其中以第2-4周降幅最大,第6周时实验组的存活率明显高于对照组(P<0.05,见表1)。另外,运用重复测量的统计学分析比较对照组与实验组之间的差异,实验组与对照组的存活率有显著差异(P=0.006)。脂肪基质干细胞提高了脂肪移植的生存率。

A.可见细胞中有脂滴形成;B.油红O染色可见红色脂滴;C,D.ADSCs成骨诱导后的茜素红染色阳性图1 脂肪基质干细胞(ADSCs)的成脂、成骨诱导 (×100)Figure 1 Differentiation of ADSCs to adipogenesis and osteogenesis (×100)
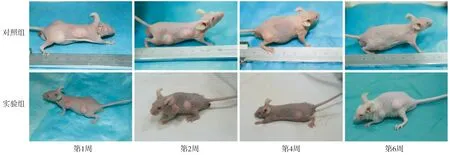
图2 对照组与实验组在1,2,4,6周大体观察Figure 2 The gross observation of nude mice in two groups at week 1, 2,4 and 6 after transplantation
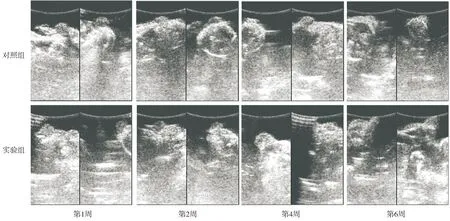
图3 对照组与实验组在第1,2,4,6周B超测量脂肪移植物体积变化情况Figure 3 The volume of fat graft tested by B-ultrasound at week 1, 2,4 and 6 after transplantation
表1对照组与实验组在第1,2,4,6周移植脂肪存活率(%)
Table1Thesurvivalrateoffatgraftatweek1,2,4and6aftertransplantation(%)

组别1周2周4周6周对照组82.98±8.1162.86±9.6021.39±8.9614.29±5.71实验组83.48±4.9167.38±8.0438.23±5.9929.23±3.61
实验组与对照组移植脂肪存活率经重复测量分析,P=0.006<0.05
2.3 脂肪基质干细胞(ADSCs)对脂肪移植血管化的影响
CD31为一种细胞间黏附分子,常常表达在白细胞、血小板和血管内皮细胞上。CD31阳性结果表现为黄色或棕褐色点状或管腔样结构。对不同组分的脂肪移植复合体在1,2,4,6周进行了CD31染色(见图4),运用Image pro plu 6.0软件对图片进行血管密度检测。从第1周至第6周,两组血管密度均随时间逐渐增加(见表2);第1,2,6周,两组间血管密度相差不大;第4周时,实验组血管密度(21.73%±1.02%)高于对照组(16.77%±1.37%),两组间差异具有统计学意义(P<0.05)。

图4 对照组与实验组在第1,2,4,6周时CD31免疫组化染色 (×200)Figure 4 The CD31 immunohistochemisty of fat graft at week 1, 2 ,4 and 6 after transplantation (×200)
表2对照组与实验组在不同时间的血管密度比较(%)
Table2Themicro-vascularizationdensityincontrolgroupandexperimentalgroupatweek1,2,4and6aftertransplantation(%)

组别1周2周4周6周对照组5.26±0.938.85±0.7716.77±1.3723.30±2.67实验组5.06±0.688.56±0.8421.73±1.02*23.92±3.36
与对照组比较,*P<0.05
3 讨论
脂肪移植的吸收问题一直困扰着临床医生,其吸收率的不确定性使整形科医生只能用少量多次或过量注射来对抗脂肪移植后的吸收[16,17];脂肪吸收一般被认为与移植后血管化不佳有关[18]。那么如何促进脂肪移植后的血管化?目前血管化组织工程的策略主要集中在细胞因子、种子细胞及支架材料这三方面[19,20],细胞因子如VEGF、血管生成素能够促进移植后的血管化[21,22]。Zuk等[3]报道了脂肪组织中存在一种多能干细胞,由于它的存量丰富可以被用来修复自体组织损伤。脂肪基质干细胞曾被定义为脂肪组织中的基质细胞或者非成脂细胞。过去,它被认为是脂肪前体细胞(脂肪祖细胞),最近的研究显示它具有多向分化的潜能,在合适的条件下ADSCs能够被诱导成为成脂细胞、软骨细胞、肌细胞、神经细胞、成骨细胞和内皮细胞[23]。脂肪基质干细胞(ADSCs)由于其多向分化的潜能被临床医生广泛的关注。脂肪基质干细胞比骨髓基质干细胞更容易获得,细胞量比骨髓干细胞更多[24]。500 ml的骨髓提取出的骨髓干细胞才能够满足干细胞治疗的量,而3-6 g的脂肪组织就能够提取出105个细胞,在两周内能够扩增20倍。脂肪基质干细胞能够分泌许多有功能的生长因子和细胞因子[25,26]。脂肪基质干细胞能够产生多种促进血管生成的细胞因子(血管生成素、VEGF、HGF、bFGF和B-NGF)[26,27]。体外实验证明这些细胞因子能够促进缺氧状态下内皮细胞的存活[28]。目前的血管化组织工程主要从细胞因子、干细胞和支架材料这三方面解决血管化的问题,细胞因子如VEGF、血管生成素能够显著提高移植物的血管化。
实验通过原代培养方法获得ADSCs,通过对第3代细胞进行诱导,其能够向成脂、成骨方向分化。将培养的ADSCs用于脂肪移植,并对移植物进行B超检测,发现其能够显著提高脂肪移植的生存率,在第1,2,4,6周,脂肪基质干细胞组的生存率大于对照组。之后课题组对移植物进行血管密度检测,通过对CD31免疫组化的IPP检测,发现在随着时间推移血管密度逐渐增加,在第4周时实验组血管密度显著高于对照组。脂肪移植后,移植物会出现明显的吸收情况,脂肪基质干细胞可能通过分泌细胞因子及多向分化,提高脂肪移植物的生存率,减少脂肪移植后吸收的量;脂肪移植后,移植物出现组织的重塑和改建,在第4周时,脂肪基质干细胞组的血管密度显著高于对照组;推测脂肪基质干细胞能够促进移植物的血管生成,从而提高脂肪移植的生存率,相关分子机制还有待进一步研究。
参考文献:
[1] Kølle SFT, Fischer-Nielsen A, Mathiasen AB,etal. Enrichment of autologous fat grafts with ex-vivo expanded adipose tissue-derived stem cells for graft survival: a randomised placebo-controlled trial[J]. Lancet, 2013, 382(9898):1113-1120.
[2] Klein AW, Elson ML. The history of substances for soft tissue augmentation[J]. Dermatol Surg, 2000,26(12):1096-1105.
[3] Zuk PA, Zhu M, Ashjian P,etal. Human adipose tissue is a source of multipotent stem cells[J]. Mol Biol Cell, 2002,13(12):4279-4295.
[4] Mehrabani D, Babazadeh M, Tanideh N,etal. The Healing Effect of Adipose-Derived Mesenchymal Stem Cells in Full-thickness Femoral Articular Cartilage Defects of Rabbit[J]. Int J Organ Tran, 2015,6(4):165-175.
[5] Mizuno H,Tobita M,Orbay H,etal. Adipose-derived stem cells as a novel tool for future regeneration medicine[J]. Springer Netherlands, 2014, 12 (5): 165-174.
[6] Yin L, Zhu Y, Yang J,etal. Adipose tissue-derived mesenchymal stem cells differentiated into hepatocyte-like cells in vivo and in vitro[J]. Mol Med Rep, 2015,11(3):1722-1732.
[7] Battista JAD, Shebaby W, Kizilay O,etal. Proliferation and differentiation of human adipose-derived mesenchymal stem cells (ASCs) into osteoblastic lineage are passage dependent[J]. Inflamm Res, 2014,63(11):907-917.
[8] Aji K, Maimaijiang M, Aimaiti A,etal. Differentiation of Human Adipose Derived Stem Cells into Smooth Muscle Cells Is Modulated by CaMKIIγ[J].Stem Cells Int,2016,2016(19):1-9.
[9] Carbone A, Valente M, Annacontini L,etal. Adipose-derived mesenchymal stromal (stem) cells differentiate to osteoblast and chondroblast lineages upon incubation with conditioned media from dental pulp stem cell-derived osteoblasts and auricle cartilage chondrocytes[J]. J Biol Regul Homeost Agents, 2016,30(1):111-122.
[10] Zhu YG, Feng XM, Abbott J,etal. Human Mesenchymal Stem Cell Microvesicles for Treatment of E.coli Endotoxin-Induced Acute Lung Injury in Mice[J]. Stem Cells, 2014,32(1):116-125.
[11] Li CY, Wu XY, Tong JB,etal. Comparative analysis of human mesenchymal stem cells from bone marrow and adipose tissue under xeno-free conditions for cell therapy[J]. Stem Cell Res Ther, 2015,6(1):55.
[12] 王莹,赵斯达,李文媛,等.脂肪源性干细胞移植对脑缺血再灌注损伤大鼠HIF-1α和HIF-3α表达的影响[J].山西医科大学学报,2011,42(9):719-722.
[13] Minn KW, Min KH, Chang H,etal. Effects of fat preparation methods on the viabilities of autologous fat grafts[J].Aesthet Plast Surg, 2010,34(5):626-631.
[14] Yang M, Baranov E, Li XM,etal. Whole-Body and Intravital Optical Imaging of Angiogenesis in Orthotopically Implanted Tumors[J]. P Natl Acad Sci USA, 2001,98(5):2616-2621.
[15] Bourlev V, Volkov N, Pavlovitch S,etal. The relationship between microvessel density, proliferative activity and expression of vascular endothelial growth factor-A and its receptors in eutopic endometrium and endometriotic lesions[J]. Reproduction, 2006,132(3):501-509.
[16] Zhao YF, Hai-Xia LI, Dong HH,etal. Clinical experience of autologous fat transplantation for augmentation mammoplasty[J]. Chinese J Aesthet Med, 2015,24(24):9-11.
[17] Simonacci F, Bertozzi N, Grieco MP,etal. Autologous fat transplantation for breast reconstruction: A literature review[J]. Ann Med Surg, 2016,12(C):94.
[18] Rico ADG, Fontdevila J, Rico ADG,etal. Autologous fat transplantation: an updated overview[J]. Brit J Oral Max Surg, 2014,52(8):e60.
[19] Li S, Sengupta D, Chien S. Vascular tissue engineering: from in vitro to in situ[J]. Wires Syst Biol Med, 2014,6(1):61-76.
[20] Gui L, Niklason LE. Vascular Tissue Engineering: Building Perfusable Vasculature for Implantation[J]. Curr Opin Chem Eng, 2014, 3:68-74.
[21] Jiang X,Xiong Q,Xu G,etal.VEGF-Loaded Nanoparticle-Modified BAMAs Enhance Angiogenesis and Inhibit Graft Shrinkage in Tissue-Engineered Bladder[J]. Ann Biomed Eng, 2015,43(10):2577-2586.
[22] Natasha G, Tan A, Gundogan B,etal. Tissue engineering vascular grafts a fortiori: looking back and going forward[J]. Expert Opin Biol Ther, 2015,15(2):231-244.
[23] Lau, Schrimpf S, Klingenberg C,etal. Evaluation of autologous tissue sources for the isolation of endothelial cells and adipose tissue-derived mesenchymal stem cells to pre-vascularize tissue-engineered vascular grafts[J]. Bionanomaterials, 2015,16(4):309-321.
[24] Ivanovatodorova E, Bochev I, Mourdjeva M,etal. Adipose tissue-derived mesenchymal stem cells are more potent suppressors of dendritic cells differentiation compared to bone marrow-derived mesenchymal stem cells[J]. Immunol Lett, 2009,126(1-2):37-42.
[25] Han-Tsung Liao,Chien-Tzung Chen,etal. Osteogenic potential: comparison between bone marrow and adipose-derived mesenchymal stem cells[J]. World J Stem Cell, 2014,6(3):288.
[26] Park JB, Jin SL, Cho BP,etal. Adipose tissue-derived mesenchymal stem cells cultured at high cell density express brain-derived neurotrophic factor and exert neuroprotective effects in a 6-hydroxydopamine rat model of Parkinson’s disease[J]. Genes Genom, 2015,37(2):213-221.
[27] 何东宁,吕春堂,金岩.兔骨髓基质干细胞的分离、扩增和生物学特性检测[J].山西医科大学学报,2006,37(5):481-483.
[28] Engel FB.Stem Cell Secretome and Paracrine Activity[M]. Aargau, Switzerland: Springer International Publishing,2016.

