人ANGPTL7蛋白生物信息学分析
胡 斌,牛志伟,李 琳
(山西医科大学基础医学院生物制药教研室,太原 030001;*
血管生成素样蛋白(angiopoietin-like proteins,ANGPTLs)是一类与血管生成素(angiopoietin,ANG)结构类似的分泌性糖蛋白家族,成员包括ANGPTL1-8八个亚型[1]。除ANGPTL8缺乏纤维蛋白原样结构域外,该家族成员中ANGPTL1-7均具有N端的卷曲-卷曲结构域和C端的纤维蛋白原样结构域[2]。虽然,ANGPTLs能够对血管的生成产生调节作用,但与ANG的调节作用不同的是,ANGPTLs不能够与血管生成素受体Tie2或Tie1结合[3-5]。研究显示,ANGPTLs成员(1,2,3,4,6)具有潜在的调节血管生成的作用[6,7],同时也表现出对炎症诱导、脂代谢及糖代谢的调节作用[8-10]。
ANGPTL7最初在角膜的基质层中被发现,因此又被称为CDT6(cornea derived transcript 6)[11]。人类的ANGPTL7 mRNA主要在神经组织、圆锥角膜、小梁网、黑色素瘤与子宫内膜癌组织中表达[5]。作为WNT/β-catenin信号途径中的潜在靶标,ANGPTL7也被认为是再生医学和肿瘤学领域的潜在研究目标[2]。研究显示,ANGPTL7在青光眼的病理生理过程中发挥一定的功能。例如,ANGPTL7蛋白浓度在青光眼患者的眼房水中较正常人高[12]。另外,ANGPTL7在小梁网细胞中过表达会改变小梁网细胞外基质成分的变化,引起小梁网细胞的功能失调,导致眼内压升高。而眼内压的升高是导致青光眼的主要因素[13]。近年来,有研究显示ANGPTL7通过P38 MAPK信号通路在RAW264.7巨噬细胞中促进炎性表型[14]。
生物信息学是以解决生物医学问题为核心,系统分析并注释医学数据的分析方法。在Ostlund等[15]2010年研究中,筛选出了1 891个与已知癌基因高度连接的基因,验证并汇总了较为可信的癌症相关候选基因列表,对药物靶标和标志物的发现具有提示作用。关于人ANGPTL7蛋白生物信息学分析尚未进行,该研究采用生物信息学方法对人ANGPTL7蛋白的结构和功能进行分析,为探究ANGPTL7蛋白的生物学功能,为其作为青光眼治疗、再生医学、生理代谢及肿瘤研究的靶点提供依据。
1 材料与方法
1.1 人类ANGPTL7基因及氨基酸序列
从GeneBank中获得人类ANGPTL7基因编码区序列及氨基酸序列(Genebankno.NC-000001.11)。
1.2 方法
对人类ANGPTL7基因编码蛋白的氨基酸序列、系统进化、蛋白质特性、功能结构域、修饰位点、二级结构、三级结构以及相互作用蛋白进行分析与预测。分析所用网站及软件见表1。
表1生物信息学分析网站及软件
Table1WebsiteandSoftwareforbioinformaticsanalysis
2 结果
2.1 人ANGPTL7蛋白同源性
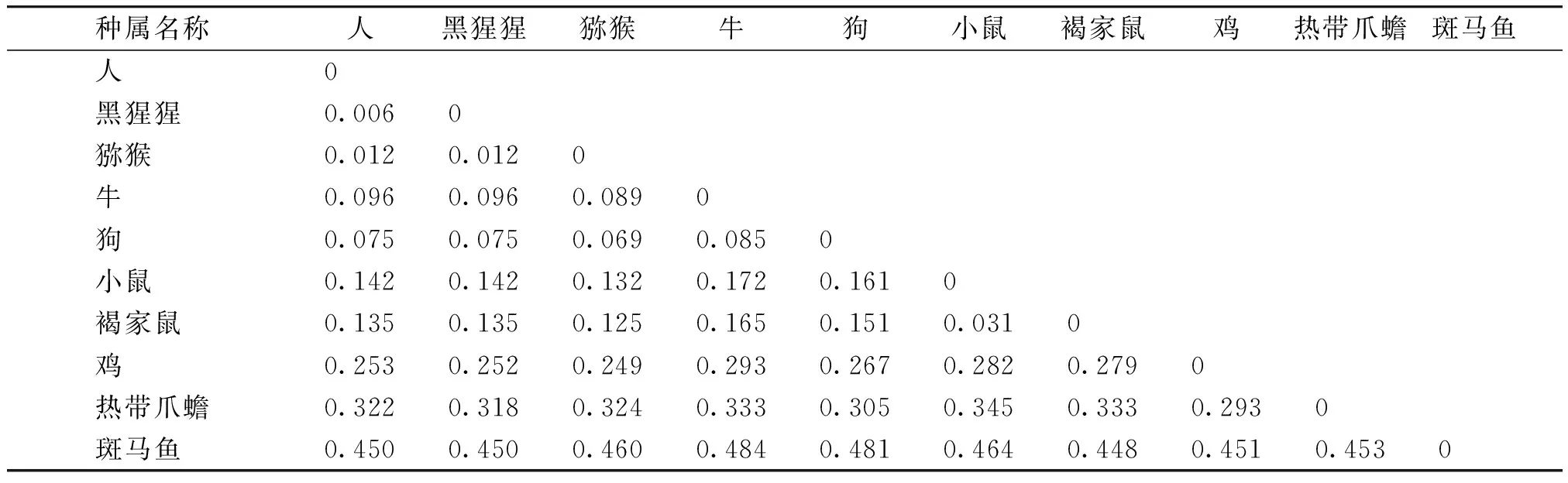
搜索NCBI数据库可知,人ANGPTL7基因位于1号染色体短臂上(1p36.22),大小为6 693 bp,具体位置为chr1:11189289-11195981,包含5个外显子区域和4个内含子区域,其编码蛋白由346个氨基酸组成。人ANGPTL7蛋白与黑猩猩、猕猴、牛、狗、小鼠、褐家鼠、鸡、热带爪蟾及斑马鱼中同源蛋白的相似性为99.4%,98.8%,90.7%,92.2%,88.9%,89.2%,77.5%,74.9%,67.1%。
利用DNAMAN 8.0软件对10个物种的蛋白序列进行同源性比对(见图1),并用MEGA 5.10软件中基于序列同源性的邻接法(neighbor-joining,NJ)构建ANGPTL7蛋白遗传进化关系树(见图2)。从进化树中可以看到,在进化过程中,人和黑猩猩及猕猴的亲缘关系最近。家畜类,牛与狗的亲缘关系较近,聚为一类,小鼠与褐家鼠的亲缘关系较近,聚为一类。其他物种的亲缘关系都较远,单独聚为一类。进化距离分析结果显示,人与黑猩猩的遗传距离最小,为0.006;其次为猕猴,遗传进化距离为0.012;与斑马鱼的进化关系最远,遗传距离为0.450(见表2)。

Homo sapiens人;Pan troglodytes黑猩猩;Macaca mulatta猕猴;Bos taurus牛;Canis lupus familiaris狗;Mus musculus小鼠;Rattus norvegicus褐家鼠;Gallus gallus鸡;Xenopus tropicalis热带爪蟾;Danio rerio斑马鱼图2 不同物种ANGPTL7蛋白系统进化树Figure 2 Phylogenetic tree of ANGPTL7 from different species
2.2 人ANGPTL7蛋白的理化性质
在线网站expasy分析显示,人ANGPTL7基因编码346个氨基酸,分子式为C1774H2727N493O530S18,相对分子量为40 018.23,理论等电点为7.98。其脂溶系数为71.85,总平均疏水系数为(grand average of hydropathicity,GRAVY)为-0.639,其值为负,预测结果表明人ANGPTL7蛋白为亲水性蛋白。其不稳定系数为32.27,其值小于40,分析结果表明人类ANGPTL7蛋白为稳定性蛋白。
表2不同物种ANGPTL7蛋白进化距离
Table2EvolutiondistanceofANGPTL7indifferentspecies
种属名称人黑猩猩猕猴牛狗小鼠褐家鼠鸡热带爪蟾斑马鱼 人0 黑猩猩0.0060 猕猴0.0120.0120 牛0.0960.0960.0890 狗0.0750.0750.0690.0850 小鼠0.1420.1420.1320.1720.1610 褐家鼠0.1350.1350.1250.1650.1510.0310 鸡0.2530.2520.2490.2930.2670.2820.2790 热带爪蟾0.3220.3180.3240.3330.3050.3450.3330.2930 斑马鱼0.4500.4500.4600.4840.4810.4640.4480.4510.4530
表中数据表示10个物种间ANGPTL7蛋白的进化距离对人类ANGPTL7蛋白亲水性/疏水性进行预测,结果如图3所示,其中第16位I(Ile)疏水性最强(+3.456),第276位K(Lys)亲水性最强(-2.978),该蛋白在5-23区域存在明显的疏水性区域,亲水性氨基酸的数量远多于疏水性氨基酸的数量,结果表明其为亲水性蛋白,与理化性质分析结果一致。
通过TMHMM 2.0对该蛋白的跨膜区进行预测,结果见图4,该蛋白的1-6位氨基酸位于细胞内,7-26位氨基酸形成一个典型的跨膜螺旋区,27-346位氨基酸位于细胞外,与该蛋白疏水性区域分析结果基本一致。
SignalP 4.1在线软件对该蛋白信号肽的预测结果显示(见图5),mean-s的值为0.554,其值大于0.5,结果表明该蛋白为分泌性蛋白,即该蛋白存在信号肽序列,1-26位氨基酸最有可能为信号肽,且剪切点位于26-27位之间。

Hphob./Kyte&Doolittle表示计算基于K-D法的蛋白质疏水性;分值高于0为疏水性氨基酸,低于0为亲水性氨基酸图3 人ANGPTL7氨基酸序列的疏/亲水性预测Figure 3 Predicted hydrophobicity/hydrophilicity of the amino acid sequence of human ANGPTL7

蓝色表示位于膜内部,红色表示跨膜区,玫红色表示位于膜外部图4 ANGPTL7跨膜区预测Figure 4 Transmembrane structure prediction of human ANGPTL7

C-score为剪切位点分值(C值),S-score为信号肽分值(S值),Y-score为综合剪切点分值(Y值)图5 ANGPTL7信号肽序列预测Figure 5 Signal peptide prediction of human ANGPTL7
2.3 人ANGPTL7蛋白结构及功能位点
利用SMART在线软件对人类ANGPTL7蛋白的结构域进行分析,图6结果显示,该蛋白在39-119位氨基酸处有一卷曲-卷曲(coiled-coil)结构域,在126-342位氨基酸处有一纤维蛋白原样结构域(FBG)。

蓝色(7-26位氨基酸)为跨膜螺旋区,绿色(39-119位氨基酸)为卷曲-卷曲结构域,紫色(126-342位氨基酸)为纤维蛋白原样结构域(FBG)图6 人ANGPTL7蛋白结构域预测Figure 6 Protein domain prediction of human ANGPTL7
在真核生物的细胞分裂、信号转导等过程中,磷酸化及去磷酸化具有重要的作用。通过NetPhos 3.1 Server对人ANGPTL7蛋白进行磷酸化位点预测,选择预测值大于0.5,结果显示,在该蛋白结构中,有34个潜在的磷酸化位点,包括21个丝氨酸磷酸化位点、7个苏氨酸磷酸化位点以及6个酪氨酸磷酸化位点(见图7)。

图7 人ANGPTL7蛋白功能位点预测Figure 7 Functional sites prediction of human ANGPTL7
利用在线软件NetNGlyc 1.0 Server和NetOGlyc 4.0 Server分别进行N-糖基化位点和O-糖基化位点的预测,均选择预测值大于0.5,结果显示该蛋白有3个潜在的N-糖基化位点,分别位于第58,253和267位氨基酸处;有7个潜在的O-糖基化位点,分别位于第34,119,121,123,124,269,272位氨基酸处(见图7)。
通过网站Prabi对人ANGPTL7蛋白的二级结构进行预测,结果显示该蛋白二级结构的主要类型为α-螺旋(alpha helix),共147个占42.49%,无规则卷曲(random coil)98个占28.32%,β-转角(beta turn)32个占9.25%,延伸链(extended strand)69个占19.94%。二级结构分布情况见图8。
本研究基于RaptorX网站采用同源模建法分析人类ANGPTL7蛋白的三级结构,结果见图9。从预测结果看,三级结构主要成分为α-螺旋,与二级结构预测结构一致。
2.4 人ANGPTL7蛋白亚细胞定位、组织表达特异性及GO
通过Compartments在线软件进行亚细胞定位分析,结果显示,有97.4%的可能性定位于细胞外,可能为分泌性蛋白,与信号肽预测结果一致。

蓝色为α-螺旋,红色为延伸链,绿色为β-转角,玫红色为无规则卷曲图8 人ANGPTL7蛋白二级结构预测Figure 8 Secondary structure prediction of human ANGPTL7

图9 人ANGPTL7蛋白三级结构预测Figure 9 Tertiary structure prediction of human ANGPTL7
通过NCBI的UniGene数据库进行EST分析,结果表明ANGPTL7 mRNA在人体16个部位均有表达,如表3所示,在眼睛中拷贝数为253,表达量最高,其次为脂肪组织与神经。
利用AmiGO 2对人ANGPTL7蛋白进行基因本体注释(gene ontology,GO),结果显示,该蛋白位于细胞外区域(Extracellular region GO:0005576),与亚细胞定位结果一致;分子功能表现为蛋白质结合活性(protein binding GO:0005515);参与氧化应激应答过程(response to oxidative stress GO:0006979)。
2.5 蛋白相互作用
使用String 10.5对人ANGPTL7进行蛋白质相互作用预测,置信度设置为0.400,数量限制为10个以内,构建人ANGPTL7蛋白相互作用网络。结果显示,与人ANGPTL7蛋白可能存在相互作用的有8个蛋白(见图10),其名称及氨基酸数目见表4。其中,与人ANGPTL7存在相互作用的蛋白主要为参与脂质代谢的含Patatin样磷脂酶结构域(Patatin-like phospholipase domain containing,PNPLA)蛋白家族成员,即PNPLA2、PNPLA3、PNPLA5。值得关注的是,相互作用网络中还包括与血管组装和形态发生相关的转录因子CASZ1(castor zinc finger 1)。
表3人ANGPTL7基因在人体不同组织中的表达量预测
Table3PredictionoftheexpressionofhumanANGPTL7indifferenttissuesofthehumanbody

组织名称转录量(/106TPM)基于TPM的浓度该基因EST数/组织总EST数眼睛25353/208840脂肪组织771/12866神经641/15535垂体腺601/16526皮肤5612/210759肾上腺301/32940肌肉28 3/106371乳腺26 4/151230子宫25 6/232093结缔组织20 3/149072气管191/51780脑18 20/1092688卵巢9 1/101488肺5 2/334815前列腺5 1/189536睾丸2 1/435204
TPM:transcripts per million;EST:Expressed Sequence Tag

图10 人ANGPTL7蛋白相互作用预测Figure 10 Prediction of proteins interacted with human ANGPTL7
表4与人ANGPTL7蛋白相互作用可能性较大的8种蛋白
Table4EightproteinsmostlikelytointeractwithhumanANGPTL7

蛋白质名称 蛋白质全名氨基酸数目得分C1orf127Chromosome 1 open reading frame 1278230.572CASZ1Castor zinc finger 117590.507NEURL1BNeuralized homolog 1B (Drosophila)5550.499NEURLNeuralized homolog(Drosophila)5740.499PNPLA2Patatin-like phospholipase domain containing 25040.456PNPLA3Patatin-like phospholipase domain containing 34810.456PNPLA5Patatin-like phospholipase domain containing 54290.456RALGPS2Ral GEF with PH domain and SH3 binding motif 25830.420
得分表示人ANGPTL7蛋白与本行所列蛋白发生相互作用的可能性
3 讨论
本文通过生物信息软件对人ANGPTL7蛋白进行了分析及预测,结果表明ANGPTL7为分泌到细胞外的可溶性蛋白,ANGPTL7mRNA在眼睛中表达量最大。人ANGPTL7蛋白存在于角膜的基质层中,其结构类似于血管生成素,但功能有所不同。Peek等[16]2002年研究证明,从角膜提取的人ANGPTL7蛋白可能以糖基化状态存在,作为血管生成负调节因子阻止角膜血管的形成,同时通过诱导血管的大量纤维化使肿瘤内部血管异常发育。本文中预测到了人ANGPTL7蛋白的多个糖基化修饰位点,且在88-142位氨基酸范围内的功能位点较为集中(见图7),预测该区段内的氨基酸对人ANGPTL7蛋白发挥其生物学功能有重要意义。蛋白质糖基化能够帮助蛋白质抵抗消化酶、赋予蛋白质信号转导的功能以及帮助蛋白质正确折叠等,具有重要的生物学意义。因此,人ANGPTL7蛋白的糖基化修饰及降解与其血管生成负调节作用发挥之间的关系有待于进一步探讨。
Charpentier等[17]2013年的研究证实,与人ANGPTL7蛋白预测有相互作用的CASZ1通过直接调控EGFL7/RhoA介导的途径促进血管组装和形态发生。由此可见,人ANGPTL7蛋白与CASZ1在血管组装和形态发生过程中发挥着相反的作用,而二者之间相互作用的验证及对血管生成的调节作用值得我们进一步研究。
从预测结果来看,与人ANGPTL7蛋白有相互作用的蛋白有1/3为含Patatin样磷脂酶结构域(PNPLA)蛋白家族成员,即PNPLA2、PNPLA3、PNPLA5。PNPLA2蛋白与PNPLA3蛋白具有同源性。Jenkins等[18]2004年的研究表明,PNPLA2具有三酰甘油水解酶和酰基甘油转酰基酶活性。Kollerits等[19]2009年相关研究证实,PNPLA3基因突变与总胆固醇、低密度脂蛋白水平显著相关。PNPLA3基因与非酒精性脂肪性肝病(NAFLD)的发生有关,Chinchilla-López等[20]的研究发现,墨西哥人群中的PNPLA3多态性与NAFLD显着相关。Liu等[21]2017年的研究中利用CRISPR/Cas9技术构建PNPLA5基因沉默的SD大鼠,表现出甘油三酯(TG)、血清总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)水平升高和低密度脂蛋白胆固醇(LDL-C)水平降低。充分说明PNPLA2、PNPLA3、PNPLA5在脂肪代谢中的重要性。此外,Abu-Farha等[22]2017年的研究表明,肥胖者的血浆及脂肪组织中人ANGPTL7蛋白浓度较高,且运动后浓度降低,说明人ANGPTL7蛋白可能作为脂肪代谢中的下游蛋白分子,而受其他分子的调节。因此,人ANGPTL7蛋白与含Patatin样磷脂酶结构域(Patatin-like phospholipase domain containing,PNPLA)蛋白家族成员之间的相互作用及在人体脂肪代谢中的作用有待进一步研究,以期为脂肪代谢异常引起的疾病治疗提供借鉴意义。
该研究采用生物信息学方法分析了人ANGPTL7蛋白的理化性质、功能位点、高级结构、生物学功能、组织特异性、亚细胞定位、系统进化关系、蛋白相互作用等。进化分析表明,人ANGPTL7与黑猩猩的亲缘关系最近,遗传距离为0.006。分析结果表明,人ANGPTL7为位于细胞外的稳定的可溶性分泌蛋白,存在跨膜结构及信号肽。含有潜在的磷酸化位点、N-糖基化位点及O-糖基化位点,其N-端为卷曲-卷曲结构域,C-端为纤维蛋白原样结构域,二级结构主要为α-螺旋。蛋白功能主要表现为蛋白质结合活性,参与氧化应激应答过程,ANGPTL7 mRNA在眼睛、脂肪组织及神经组织中高表达。与人ANGPTL7存在相互作用的蛋白主要为参与脂质代谢的含Patatin样磷脂酶(patatin-like phospholipase,PNPLA)结构域蛋白家族成员。推测该蛋白在血管形成和组装过程中的负调节作用与糖基化修饰位点有关,且该蛋白可能参与人体脂质代谢过程。该研究为人ANGPTL7基因相关疾病治疗靶点及药物研发提供一定的依据。
参考文献:
[1] Mattijssen F, Kersten S. Regulation of triglyceride metabolism by Angiopoietin-like proteins[J]. Biochim Biophys Acta, 2012, 1821(5):782-789.
[2] Santulli G. Angiopoietin-like proteins: a comprehensive look[J]. Front Endocrinol (Lausanne), 2014, 5:4.
[3] Kim I, Kim HG, Kim H,etal. Hepatic expression, synthesis and secretion of a novel fibrinogen/angiopoietin-related protein that prevents endothelial-cell apoptosis[J]. Biochem J, 2000, 346(Pt 3):603-610.
[4] Camenisch G, Pisabarro MT, Sherman D,etal. ANGPTL3 stimulates endothelial cell adhesion and migration via integrin alpha vbeta 3 and induces blood vessel formation in vivo[J]. J Biol Chem, 2002, 277(19):17281-17290.
[5] Katoh Y,Katoh M.Comparative integromics on Angiopoietin family members[J]. Int J Mol Med, 2006, 17(6):1145-1149.
[6] Oike Y, Ito Y, Maekawa H,etal. Angiopoietin-related growth factor (AGF) promotes angiogenesis[J]. Blood, 2004, 103(10):3760-3765.
[7] Hato T, Tabata M, Oike Y. The role of angiopoietin-like proteins in angiogenesis and metabolism[J]. Trends Cardiovasc Med, 2008, 18(1):6-14.
[8] Ono M, Shimizugawa T, Shimamura M,etal. Protein region important for regulation of lipid metabolism in angiopoietin-like 3 (ANGPTL3): ANGPTL3 is cleaved and activated in vivo.[J]. J Biol Chem, 2003, 278(43):41804-41809.
[9] Oike Y,Akao M,Yasunaga K,etal. Angiopoietin-related growth factor antagonizes obesity and insulin resistance[J]. Nat Med, 2005, 11(4):400-408.
[10] Xu A, Lam MC, Chan KW,etal. Angiopoietin-like protein 4 decreases blood glucose and improves glucose tolerance but induces hyperlipidemia and hepatic steatosis in mice[J]. Proc Natl Acad Sci U S A, 2005, 102(17):6086-6091.
[11] Peek R, van Gelderen BE, Bruinenberg M,etal. Molecular cloning of a new angiopoietinlike factor from the human cornea[J]. Invest Ophthalmol Vis Sci, 1998, 39(10):1782-1788.
[12] Kuchtey J, Källberg ME, Gelatt KN,etal. Angiopoietin-like 7 secretion is induced by glaucoma stimuli and its concentration is elevated in glaucomatous aqueous humor[J]. Invest Ophthalmol Vis Sci, 2008, 49(8):3438-3448.
[13] Rozsa FW, Reed DM, Scott KM,etal. Gene expression profile of human trabecular meshwork cells in response to long-term dexamethasone exposure[J]. Mol Vis, 2006, 12:125-141.
[14] Qian T, Wang K, Cui J,etal. Angiopoietin-Like Protein 7 promotes an inflammatory phenotype in RAW264.7 macrophages through the P38 MAPK signaling pathway[J]. Inflammation, 2016, 39(3):974-985.
[15] Ostlund G, Lindskog M, Sonnhammer EL. Network-based identification of novel cancer genes[J]. Mol Cell Proteomics, 2010, 9(4):648-655.
[16] Peek R, Kammerer RA, Frank S,etal. The angiopoietin-like factor cornea-derived transcript 6 is a putative morphogen for human cornea[J]. J Biol Chem, 2002, 277(1):686-693.
[17] Charpentier MS, Christine KS, Amin NM,etal. CASZ1 promotes vascular assembly and morphogenesis through the direct regulation of an EGFL7/RhoA-mediated pathway[J]. Dev Cell, 2013, 25(4):132-143.
[18] Jenkins CM, Mancuso DJ, Yan W,etal. Identification, cloning, expression, and purification of three novel human calcium-independent phospholipase a2 family members possessing triacylglycerol lipase and acylglycerol transacylase activities[J]. J Biol Chem, 2004, 279(47):48968-48975.
[19] Kollerits B, Coassin S, Beckmann ND,etal. Genetic evidence for a role of adiponutrin in the metabolism of apolipoprotein B-containing lipoproteins[J]. Hum Mol Genet, 2009, 18(23):4669-4676.
[20] Chinchilla-López P,Ramírez-Pérez O,Cruz-Ramón V,etal. More evidence for the genetic susceptibility of Mexican population to nonalcoholic fatty liver disease through PNPLA3[J]. Ann Hepatol, 2018, 17(2):250-255.
[21] Liu Y, Gao Q, Zhang X,etal. PNPLA5-knockout, rats induced by CRISPR/Cas9 exhibit abnormal bleeding and lipid level[J]. J Integr Agr, 2017, 16(1):169-180.
[22] Abu-Farha M, Cherian P, Alkhairi I,etal. Plasma and adipose tissue level of angiopoietin-like 7 (ANGPTL7) are increased in obesity and reduced after physical exercise[J]. PLoS One, 2017, 12(3):e0173024.

