玻璃体腔注射雷珠单抗联合FP-7Ahmed青光眼引流阀植入术治疗新生血管性青光眼的疗效观察
宗良敏 曹二兵
新生血管性青光眼(neovascular glaucoma,NVG)是以新生血管为特征的一类难治性青光眼,其发病率约占所有难治性青光眼的30%以上[1]。眼压急剧升高是导致NVG患者视功能不可逆性损害的主要原因[2]。对于Ⅲ期NVG而言,药物治疗常难以控制眼压,故其治疗仍以手术治疗为主[3]。FP-7Ahmed青光眼引流阀植入术是临床治疗NVG的常用术式,但虹膜表面新生血管在术中和术后极易出血,造成滤过口和引流通道堵塞,从而导致手术失败[4]。血管内皮生长因子(vascular endothe-lial growth factor,VEGF)过表达是诱导新生血管形成的主要机制[5]。因此,眼内注射抗VEGF药物为NVG治疗提供了更好的选择。雷珠单抗作为新型的抗VEGF药物被逐渐应用于新生血管性眼病治疗[6-7]。但雷珠单抗联合FP-7Ahmed青光眼引流阀植入术治疗NVG尚缺乏可靠的循证医学证据。本研究旨在探讨玻璃体腔注射雷珠单抗联合FP-7Ahmed青光眼引流阀植入术治疗NVG的安全性及有效性,以期为临床提供依据。
1 对象和方法
1.1 对象 选取2016年1月至2017年1月江苏省人民医院眼科收治的采用玻璃体腔注射雷珠单抗联合FP-7Ahmed青光眼引流阀植入术治疗的NVG患者36例(38眼)作为观察组,选取同期仅给予FP-7Ahmed青光眼引流阀植入术治疗的NVG患者34例(35眼)作为对照组。纳入标准:(1)年龄≥18岁;(2)明确NVG诊断,且NVG临床分期为Ⅲ期;(3)所有最大抗青光眼用药数目下眼压仍高于22mmHg。排除标准:(1)眼内肿瘤所致的继发性NVG;(2)不能耐受玻璃体腔内注射雷珠单抗或FP-7Ahmed青光眼引流阀植入术者;(3)眼部手术史者;(4)结膜瘢痕化。两组患者性别、年龄、眼压、视力、原发病等一般情况比较差异均无统计学意义(均P >0.05),见表 1。

表1 两组患者一般情况比较
1.2 方法
1.2.1 对照组 给予FP-7Ahmed青光眼引流阀植入术治疗。20g/L利多卡因表面麻醉,分离并固定外直肌,剪开肌间膜暴露巩膜至赤道后,0.4g/L丝裂霉素C棉片贴敷拟放置引流盘处巩膜表面5min,200ml平衡盐溶液反复冲洗术区,将FP-7Ahmed青光眼引流阀(美国新世界医疗公司,批号 F0817,注册证编号:20153223709)置入术野,测试引流阀引流畅通后,将引流盘固定于巩膜,且其前端距角膜缘8~10mm,23G针头沿角膜缘穿刺入前房,注入适量粘弹剂,将引流管口修剪成45°,引流管斜面与虹膜平行于前房穿刺口插入前房2mm,将外引流管固定于巩膜面,取异体巩膜覆盖并缝合。术后托吡卡胺滴眼液滴眼2次/d,普拉洛芬滴眼液滴眼4次/d,妥布霉素地塞米松滴眼液滴眼4次/d。术后随访6个月。
1.2.2 观察组 给予玻璃体腔注射雷珠单抗联合FP-7Ahmed青光眼引流阀植入术治疗。雷珠单抗玻璃体腔注射方法如下:术前1h托吡卡胺滴眼液滴眼散瞳,患者取仰卧位,盐酸奥布卡因滴眼液滴眼3次行表面麻醉,常规消毒铺巾,开睑器撑开术眼,依次用碘伏、0.9%氯化钠溶液冲洗术区,垂直于巩膜面在颞下方距角巩膜缘后3.5~4.0mm进针,0.05ml雷珠单抗注射液(瑞士诺华制药瑞士公司,注册证编号:S20110085,2011-12-31)缓慢推注,术毕结膜囊涂典必殊眼膏并包眼,次日起左氧氟沙星眼液4次/d、普拉洛芬眼液4次/d连续滴眼。注药后1周行FP-7Ahmed青光眼引流阀植入术,方法同对照组。术后随访6个月。
1.3 观察指标 (1)虹膜表面新生血管消退情况:观察患者治疗后虹膜表面新生血管消退情况。(2)眼压:分别于术前和术后1d、7d、1个月、3个月、6个月,采用拓普康非接触式眼压计检测患者眼压变化。(3)视力:分别于术前及术后6个月,采用国际标准视力表检测患者视力。视力提高:术后较术前视力提高1行及以上;视力无改变:术后较术前视力无变化;视力下降:术后较术前视力下降1行及以上。(4)并发症:包括前房出血、引流管堵塞、角膜水肿、前房渗出、浅前房和低眼压,统计患者手术并发症发生率。
1.4 统计学处理 采用SPSS 20.0统计软件。计量资料以表示,组间比较采用两独立样本t检验;计数资料组间比较采用χ2检验和Mann-Whitney U检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者虹膜表面新生血管消退情况比较 观察组38眼,玻璃体腔内注射雷珠单抗后,35眼(92.1%)虹膜表面新生血管在2~9d内完全消退;3眼(7.9%)虹膜表面绝大部分新生血管消退,残存少许粗大新生血管。对照组所有患者虹膜表面仍可见新生血管。
2.2 两组患者手术前后眼压比较 两组患者术前眼压比较差异无统计学意义(P>0.05)。观察组患者术后1d、7d、1个月、3个月和6个月眼压均显著低于对照组(均P<0.05),见表 2。
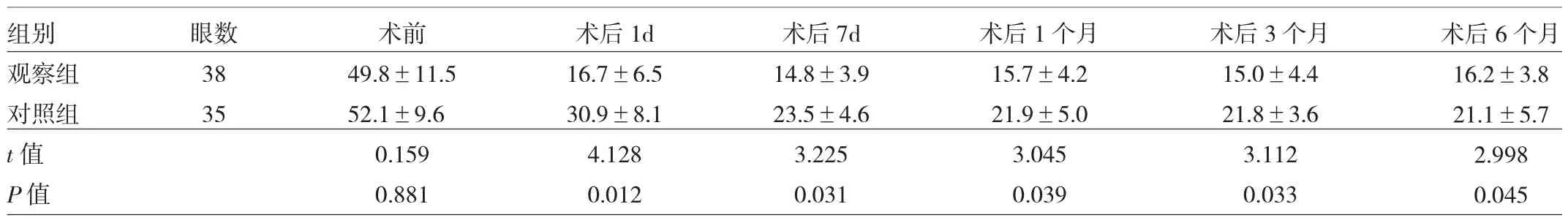
表2 两组患者手术前后眼压比较(mmHg)
2.3 两组患者术后6个月视力比较 观察组术后6个月视力较对照组显著改善(P<0.05),见表3。

表3 两组患者术后6个月视力比较[例(%)]
2.4 两组患者手术并发症发生率比较 两组患者角膜水肿、前房渗出、浅前房和低眼压发生率比较差异均无统计学意义(均P>0.05)。观察组患者前房出血和引流管堵塞发生率均显著低于对照组(P<0.05),见表4。

表4 两组患者术后6个月视力比较[例(%)]
3 讨论
NVG的发病机制较为复杂,多认为与视网膜缺血缺氧引起的包括VEGF等在内的多种促血管生长因子过表达有关。促血管生长因子大量分泌可诱发眼内新生血管形成,当新生血管延及前房角时,前房角随着纤维血管膜收缩逐渐变窄,引起房角周边虹膜前粘连,造成房水外流受阻,进而导致眼压持续性升高[8]。因此,控制眼压、抑制血管新生是NVG治疗的关键所在。
青光眼引流物植入是临床常见的NVG治疗方案。FP-7Ahmed青光眼引流阀作为前房引流装置的代表产品,植入后可显著降低眼压,且其单向压力敏感控制阀门可避免引流阀植入后所致的房水过度引流,从而有效降低术后低眼压、浅前房等并发症的发生风险,被广泛应用于NVG临床治疗[9]。但单纯采用FP-7Ahmed青光眼引流阀植入术治疗NVG的效果并不理想,其成功率仅为61.3%~73.1%[10-11]。其原因与手术所致新生血管出血,引起前房出血,造成滤过口和引流通道堵塞,导致眼压无法降低有关[12]。本研究结果显示,对照组患者术后前房出血和引流管堵塞发生率较高,提示单纯采用FP-7Ahmed青光眼引流阀植入术治疗NVG存在较高的前房出血和引流管堵塞风险。
雷珠单抗是第二代人源化抗VEGF重组鼠单克隆抗体片段,具有选择性结合VEGF的作用,抑制血管内皮细胞增殖,从而发挥抗新生血管生成作用。Luke等[13]通过临床研究证实,眼内注射雷珠单抗可抑制虹膜表面新生血管形成,防止纤维血管膜收缩所造成的前房角粘连,甚至关闭。Elmekawey等[14]研究发现,小梁切除术前行玻璃体腔注射雷珠单抗可提高NVG手术疗效,其中手术部分成功率(需联合抗青光眼药物)为40.0%,手术完全成功率为53.3%。上述研究表明,玻璃体腔注射雷珠单抗是提高NVG手术疗效的重要辅助治疗手段。本研究结果显示,观察组前房出血和引流管堵塞发生率较对照组显著降低。术前玻璃体腔注射雷珠单抗虽不具备降低眼压的作用,但可促使虹膜新生血管消退,减少引流阀植入术中、术后出血,避免滤过口和引流通道堵塞,为实施FP-7Ahmed青光眼引流阀植入术提供了良好的基础。本研究结果显示,观察组术后眼压较对照组显著降低,同时术后视力较对照组显著改善,提示相较于单纯FP-7Ahmed青光眼引流阀植入术,玻璃体腔注射雷珠单抗联合FP-7Ahmed青光眼引流阀植入术治疗NVG的效果更佳,与徐金华等[15]结论一致。究其原因,可能与玻璃体腔注射雷珠单抗与房水中VEGF特异性结合,抑制虹膜新生血管形成,尽可能保留甚至提高患者残留视功能,并降低手术相关并发症,改善手术疗效有关。
综上所述,采用玻璃体腔注射雷珠单抗联合FP-7Ahmed青光眼引流阀植入术治疗NVG具有可靠的安全性,可减少手术并发症,降低眼压,提高患者残留视力。
[1]Chen S,Zhou M,Wang W,et al.Levels of angiogenesis-related vascular endothelial growth factor family in neovascular glaucoma eyes[J].Acta Ophthalmologica,2015,93(7):556-560.doi:10.1111/aos.12624.
[2]ArcieriES,Paula JS,Jorge R,et al.Efficacy and safety of intravitrealbevacizumab in eyes with neovascular glaucoma undergoing ahmed glaucoma valve implantation:2‐year follow‐up[J].Acta Ophthalmologica,2015,93(1):1-6.doi:10.1111/aos.12608.
[3]Min T,Yang F,Ying W,et al.Efficacy of intravitreal ranibizumab combined with Ahmed glaucoma valve implantation for the treatment of neovascular glaucoma[J].Bmc Ophthalmology,2016,16(1):7-10.doi:10.1186/s12886-016-0183-7.
[4]Ma KT,Yang JY,Kim JH,et al.Surgical results of Ahmed valve implantation with intraoperative bevacizumab injection in patients with neovascular glaucoma[J].Journal of Glaucoma,2012,21(5):331-336.doi:10.1097/IJG.0b013e31820e2fd0.
[5]Nagendran ST,Finger PT.Anti-VEGF intravitreal bevacizumab for radiation-associated neovascular glaucoma[J].Ophthalmic Surgery Lasers&Imaging Retina,2015,46(2):201-203.doi:10.3928/23258160-20150213-08.
[6]徐晓萍,许霞,吴国海.两种方法治疗难治性青光眼疗效分析[J].浙江医学,2010,32(4):572-573.
[7]张一,刘哲丽,张含,等.玻璃体内注射雷珠单抗治疗病理性近视脉络膜新生血管[J].国际眼科杂志,2015,2(3):381-385.doi:10.3980/j.issn.1672-5123.2015.3.01.
[8]刘勇,平功勋.贝伐单抗与雷珠单抗联合Ahmed阀植入治疗NVG的对照研究[J].国际眼科杂志,2015,15(12):2114-2119.doi:10.3980/j.issn.1672-5123.2015.12.24.
[9]Netland PA,Ishida K,Boyle JW.The Ahmed Glaucoma Valve in patients withand withoutneovascularglaucoma[J].JournalofGlaucoma,2010,19(9):581-586.doi:10.1097/IJG.0b013e3181ca7f7f.
[10]Yildirim N,Yalvac IA,Ozer A,et al.A comparative study between diode laser cyclophotocoagulation and the Ahmed glaucoma valve implant in neovascular glaucoma:a long-term follow-up[J].Journal of Glaucoma,2009,18(3):192-195.doi:10.1097/IJG.0b013e31817d235c.
[11]Shen CC,Salim S,Du H,et al.Trabeculectomy versus Ahmed Glaucoma Valve implantation in neovascular glaucoma[J].ClinicalOphthalmology,2011,1(2):281-286.doi:10.2147/OPTH.S16976.
[12]张少维,黄毅,李琴,等.全视网膜光凝联合Ahmed引流阀植入术及雷珠单抗玻璃体腔注射治疗新生血管性青光眼[J].中国眼耳鼻喉科杂志,2017,17(1):33-35.doi:10.14166/j.issn.1671-2420.2017.07.010.
[13]Luke J,Nassar K,Luke M,et al.Ranibizumab as adjuvant in the treatment of rubeosis iridis and neovascular glaucoma-results from a prospective interventionalcase series[J].Graefe's Archive for Clinical and Experimental Ophthalmology,2013,251(10):2403-2413.doi:10.1007/s00417-013-2428-y.
[14]Elmekawey H,Khafagy A.Intracameral ranibizumab and subsequent mitomycin C augmented trabeculectomy in neovascular glaucoma[J].Journal of Glaucoma,2014,23(7):437-440.doi:10.1097/IJG.0b013e3182946398.
[15]徐金华,王育良,林琳,等.玻璃体腔注射雷珠单抗联合Ahmed引流阀植入治疗新生血管性青光眼的疗效[J].江苏医药,2015,41(21):2550-2552.

