选择性雌激素受体调节剂对小鼠肥胖及脂代谢的作用
朱晶 傅晓华 张岭 金碧辉 舒静
代谢综合征是一组包含肥胖、高血糖、血脂异常等一系列疾病的临床症候群,绝经后女性发病率显著升高[1]。其核心是中心性肥胖和胰岛素抵抗(insulin resistance,IR)。研究显示绝经后雌激素缺乏会引起能量消耗降低、脂肪氧化能力下降、体重增加及内脏脂肪堆积[2-3]。雌激素替代治疗能有效改善或预防中心性肥胖和IR,降低代谢综合征的发生率[4-5]。这提示雌激素及其受体在绝经女性脂代谢异常中扮演着重要角色。然而,长期应用雌激素会增加乳腺癌、子宫内膜癌及血栓的风险。与有完整活性的天然雌激素不同,选择性雌激素受体调节剂(selective estrogen receptor modulators,SERMs)是指与雌激素受体高亲和力结合、作用有组织选择性特点的化合物[6]。SERMs可选择性作用于不同组织雌激素受体,起类似雌激素或抗雌激素作用。其中他莫昔芬作为经典SERMs,目前临床多用于雌激素受体阳性乳腺癌药物辅助治疗,但同时对骨骼、子宫及脂代谢有不同作用。近期也有研究显示,他莫昔芬可引起脂肪组织棕色化改变[7]。本研究旨在通过建立模型观察他莫昔芬对小鼠肥胖和脂代谢的影响,探讨SERMs在绝经女性肥胖及代谢综合征中的作用。
1 材料和方法
1.1 实验动物及模型建立 8周龄C57/BL6雌鼠32只,具有正常动情周期,由上海斯莱克实验动物有限公司提供,称重、清洁级标准饲养,饲养室温保持在22~27℃,湿度约50%。采用随机数字表法将小鼠分为假手术组、卵巢切除组、假手术他莫昔芬组、卵巢切除雌激素替代组4组,每组8只。各组处理方法:(1)假手术组小鼠腹腔注入0.3%戊巴比妥钠麻醉(0.25ml/10g),打开腹腔暴露卵巢不作处理,随即关闭腹腔;(2)卵巢切除组小鼠腹腔注入0.3%戊巴比妥钠麻醉后行双侧卵巢切除术;(3)假手术他莫昔芬组小鼠麻醉后行假手术,术后每周1次皮下注射他莫昔芬缓释剂0.1ml(江苏扬子江药业,他莫昔芬5mg碾碎,用注射级玉米油配置维持血清浓度4ng/ml);(4)卵巢切除雌激素替代组小鼠行双侧卵巢切除术后,皮下埋植 17β-雌二醇(E2)缓释剂(0.36mg,60d释放,美国IRA公司)。4组小鼠手术后给予高脂饮食(40%脂肪)喂养8周,每周称量体重和饲料消耗。
1.2 口服葡萄糖耐量试验 高脂饮食7周后,所有小鼠禁食12h,给予20%葡萄糖溶液(0.1ml/10g)灌胃,采用血糖仪减尾试纸测定血糖(ACCU-CHEK performa,美国罗氏公司),时间依次为 0、15、30、60、90 及 120min,梯形法计算时间-血糖AUC。0~120min AUC[mmol/L·h]=[(BG0+BG15)×0.25/2]+[(BG15+BG30)×0.25/2]+[(BG30+BG60)×0.5/2]+[(BG60+BG90)×0.5/2]+[(BG90+BG120)×0.5/2](BGx分别代表糖负荷后各时间点的血糖值)。
1.3 IR相关指标检测 高脂饮食8周后,所有小鼠再次禁食12h,二氧化碳安乐死后心脏穿刺采血0.7~0.8ml,3 000r/min 离心 10min,分离血清-80℃保存。日立7020全自动生化分析仪检测空腹血糖(FPG)水平,ELISA法(试剂盒购自武汉优尔生物公司)测定空腹胰岛素(FINS)水平,采用稳态模型评价法计算胰岛素抵抗指数(HOMA-IR):HOMA-IR=(FPG×FINS)/22.5。
1.4 血清E2水平和脂代谢指标测定 采用日立7020全自动生化分析仪测定 TG、TC、HDL-C及 LDL-C,ELISA法(试剂盒均购自武汉优尔生物公司)测定血清E2和脂联素(ADPN)水平。
1.5 脂肪组织称重 小鼠安乐死后取皮下脂肪组织(腹股沟脂肪)及内脏脂肪组织(子宫旁脂肪)称重记录。分别计算各组小鼠体重增加量、皮下脂肪/体重比值及内脏脂肪/体重比值。
1.6 统计学处理 采用SPSS 24.0统计软件。计量资料以表示,组间比较采用单因素方差分析,两两比较采用Sidak法。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠血清AUC、FINS、FPG及HOMA-IR比较卵巢切除组小鼠AUC值最大,与其他3组比较差异均有统计学意义(均P<0.05)。假手术他莫昔芬组小鼠AUC值小于假手术组(P<0.05),与卵巢切除雌激素替代组比较差异无统计学意义(P>0.05)。4组小鼠FINS和FPG水平比较差异均无统计学意义(均P>0.05)。进一步计算HOMA-IR,卵巢切除组小鼠HOMA-IR值较卵巢切除雌激素替代组显著升高(P<0.05),其余组间比较差异均无统计学意义(均P>0.05),见表1。

表1 各组小鼠血清AUC、FINS、FPG及HOMA-IR比较
2.2 各组小鼠血清E2水平比较 与卵巢切除组和假手术他莫昔芬组比较,假手术组和卵巢切除雌激素替代组小鼠E2水平均明显升高(均P<0.05),见表2。
2.3 各组小鼠血清脂代谢指标水平比较 假手术他莫昔芬组小鼠血清TC、HDL-C水平均为组间最低(均P<0.05);其血清TG水平较卵巢切除雌激素替代组明显上升(P<0.05),与其余组比较差异均无统计学意义(均P>0.05);其血清LDL-C水平较假手术组及卵巢切除雌激素替代组均明显上升(均P<0.05),与卵巢切除组比较差异无统计学意义(P>0.05);其血清ADPN水平较卵巢切除组显著升高(P<0.05),与其余组比较差异均无统计学意义(均P>0.05),见表3。

表2 各组小鼠血清E2水平比较
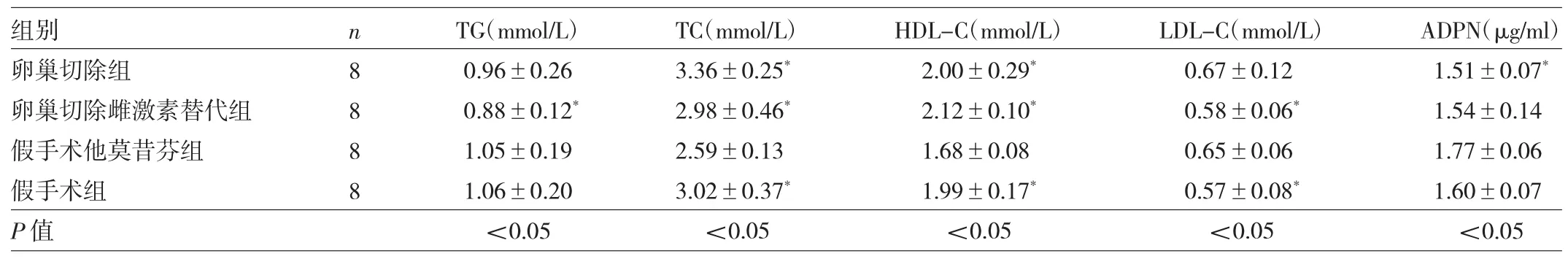
表3 各组小鼠血清脂代谢指标水平比较
2.4 各组小鼠体重增加量、皮下脂肪/体重比值及内脏脂肪/体重比值比较 经过8周高脂饮食喂养后,卵巢切除组小鼠体重增加量最为显著(均P<0.05),假手术他莫昔芬组小鼠体重增加量最少(均P<0.05)。进一步观察皮下脂肪/体重比值及内脏脂肪/体重比值,卵巢切除组皮下脂肪/体重比值及内脏脂肪/体重比值增加最多(均P<0.05),假手术他莫昔芬组皮下脂肪/体重比值及内脏脂肪/体重比值与卵巢切除雌激素替代组比较差异均无统计学意义(均P>0.05),见表4。

表4 各组小鼠体重增加量、皮下脂肪/体重比值及内脏脂肪/体重比值比较
3 讨论
绝经后女性由于雌激素缺乏,导致中心性肥胖、IR发病率显著上升,并进一步造成2型糖尿病、高脂血症、高血压等代谢综合征的发生,且互相作用,影响老年女性健康。临床上已经明确对绝经女性使用雌激素替代治疗能有效降低中心性肥胖及IR的发生[8]。但是由于雌激素作用的泛化性及乳腺癌、血栓风险,其临床应用一直受到限制。
SERMs是一类人工合成的化合物,具有组织选择性特点,即可选择性地作用于不同组织的雌激素受体,起类似雌激素或抗雌激素作用。本研究显示,卵巢切除组小鼠和假手术他莫昔芬组小鼠在同样的低雌激素状态下行高脂饮食喂养,前者体重明显升高,且皮下及内脏脂肪含量增加最多;相较之下,假手术他莫昔芬组小鼠体重增加量各组间最低,且皮下及内脏脂肪量也明显低于卵巢切除组小鼠,与卵巢切除雌激素替代组小鼠比较差异均无统计学意义。这提示他莫昔芬虽然显著降低循环雌激素水平,但与此同时,对于雌激素缺乏引起的体重增加及中心性肥胖有一定的改善作用,在体重控制上或许优于雌激素补充。
本研究中口服葡萄糖耐量试验也表明,卵巢切除后小鼠在低雌激素状态下,糖耐量明显受损,雌激素补充治疗后小鼠糖耐量改善;而假手术他莫昔芬组小鼠在低雌激素状态下糖耐量明显优于卵巢切除组小鼠,和卵巢切除雌激素替代组小鼠比较差异无统计学意义。该结果进一步提示:他莫昔芬或可改善雌激素缺乏引起的血糖升高及糖耐量受损,与雌激素一样,对于绝经后2型糖尿病的发生有一定的积极作用。本研究中,去卵巢、雌激素补充及他莫昔芬干预对血清FINS水平均无明显影响,进一步计算HOMA-IR显示,卵巢切除雌激素替代组小鼠HOMA-IR值明显下降,其余各组间比较差异均无统计学意义。考虑到本试验采用稳态模型评估IR水平,对餐后阶段的胰岛素敏感性反应不足;若同时存在小鼠糖耐量受损胰岛素分泌异常的情况,研究结果或许不够准确。
本研究显示假手术他莫昔芬组小鼠血清TC水平组间最低,这与Frolik等[9]既往的研究结果一致:他莫昔芬可显著降低血清TC水平,且相较于雌激素,其对TC的抑制作用更久。对于TG、HDL-C及LDL-C各研究显示结论并不一致。本研究显示假手术他莫昔芬组小鼠血清HDL-C水平组间最低,与其他各组比较差异均有统计学意义;此外,与卵巢切除雌激素替代组小鼠比较,假手术他莫昔芬组小鼠血清TG和LDL-C水平上升。Markopoulos等[10]对65例绝经后乳腺癌患者使用他莫昔芬后发现,他莫昔芬显著降低LDL-C水平,升高HDL-C水平,对TG水平无明显影响。Atalay等[11]研究认为他莫昔芬升高血清TG水平,对HDL-C水平无明显影响。本研究他莫昔芬显著升高小鼠血清ADPN水平,但与卵巢切除雌激素替代组小鼠比较差异无统计学意义。Ahl等[12]研究认为循环中ADPN水平与脂肪含量成反比,且肥胖个体的ADPN水平显著下降。本研究ADPN水平升高也进一步提示他莫昔芬在中心性肥胖及脂代谢中起重要作用。本研究由于他莫昔芬干预时间较短,样本量较少,对研究结果会造成一定影响。
综上所述,SERMs具有组织选择性作用特征及抗雌激素和类雌激素的双向作用。其在降低循环雌激素水平的同时,对于局部组织,如脂肪组织蓄积、再分布及血清脂代谢有一定的积极作用。相较于雌激素的泛作用性,在临床上具备广泛的应用前景。目前临床上应用较成熟的SERMs制剂主要用于改善绝经后女性骨代谢,在脂代谢上尚在探索阶段。进一步扩大样本,探索SERMs的作用机制,为绝经女性中心性肥胖和代谢综合征提供新的药物研发思路是今后研究的方向。
[1]Lobo RA.Metabolic syndrome after menopause and the role of hormones[J].Maturitas,2008,60(1):10-18.doi:10.1016/j.maturitas.2008.02.008.
[2]Litwak SA,Wilson JL,Chen W,et al.Estradiol prevents fat accumulation and overcomes leptin resistance in female high-fat diet mice[J].Endocrinology,2014,155(11):4447-4460.doi:10.1210/en.2014-1342.
[3]Vieira Potter VJ,Strissel KJ,Xie C,et al.Adipose tissue inflammation and reduced insulin sensitivity in ovariectomized mice occurs in the absence of increased adiposity[J].Endocrinology,2012,153(9):4266-4277.doi:10.1210/en.2011-2006.
[4]Polotsky HN,Polotsky AJ.Metabolic implications of menopause[J].Semin Reprod Med,2010,28(5):426-434.doi:10.1055/s-0030-1262902.
[5]Babaei P,Dastras A,Tehrani BS,et al.The effect of estrogen replacement therapy on visceral fat,serum glucose,lipid profiles and apelin level in ovariectomized rats[J].J Menopausal Med,2017,23(3):182-189.doi:10.6118/jmm.2017.23.3.182.
[6]Mirkin S,Pickar JH.Selective estrogen receptor modulators(SERMs):a review of clinicaldata[J].Maturitas,2015,80(1):52-57.doi:10.1016/j.maturitas.2014.10.010.
[7]Cai J,Li B,Wang J,et al.Tamoxifen prefabricated beige adipose tissue improves fat graft survival in mice[J].Plast Reconstr Surg,2018,141(4):930-940.doi:10.1097/PRS.0000000000004220.
[8]吕玲,方素华,宁玉梅.不同雌激素制剂及方案治疗绝经妇女的观察[J].浙江医学,2003,25(7):439-441.
[9]Frolik CA,Bryant HU,Black EC,et al.Time-dependent changes in biochemical bone markers and serum cholesterol in ovariectomized rats:effects of raloxifene HCl,tamoxifen,estrogen,and alendronate[J].Bone,1996,18(6):621-627.doi:10.1093/annonc/mdn545.
[10]Markopoulos C,Polychronis A,Dafni U,et al.Lipid changes in breast cancer patients on exemestane treatment:final results of the TEAM Greek substudy[J].Ann Oncol,2009,20(1):49-55.doi:10.1093/annonc/mdn545.
[11]Atalay G,Dirix L,Biganzoli L,et al.The effect of exemestane on serum lipid profile in postmenopausal women with metastatic breast cancer:a companion study to EORTC Trial 10951,'Randomized phase II study in first line hormonal treatment for metastatic breast cancer with exemestane or tamoxifen in postmenopausalpatients'[J].Ann Oncol,2004,15(2):211-217.
[12]Ahl S,Guenther M,Zhao S,et al.Adiponectin Levels Differentiate Metabolically Healthy vs Unhealthy Among Obese and Nonobese White Individuals[J].J Clin Endocrinol Metab,2015,100(11):4172-4180.doi:10.1210/jc.2015-2765.

