冬凌草甲素抑制破骨细胞分化的机制研究
雷新环 李芷嫣 黄微星 蔡国平 米爽 洪盾 章礼炜
骨质疏松症是由于骨重建过程中骨吸收和骨形成的平衡被打破,导致骨量下降,骨密度降低而引起的一系列临床症状。破骨细胞的数量和活性决定骨吸收的持续时间和发展速度,在骨质疏松症发生、发展中起着重要的作用[1-2]。既往体内外研究表明许多中药单体诸如淫羊藿等可通过抑制破骨细胞分化、促进成骨细胞矿化等途径治疗骨质疏松[3-4]。冬凌草甲素是一种二萜类化合物的中药单体,具有抗肿瘤、抗菌、抗炎等作用,但其能否影响破骨细胞分化目前尚不清楚[5]。本实验旨在研究中药单体冬凌草甲素抑制破骨细胞分化的作用及其可能的作用机制,为其治疗骨质疏松症提供理论依据。
1 材料和方法
1.1 实验动物 8周龄雌性C57BL/6小鼠购自上海斯莱克动物有限公司。
1.2 材料 冬凌草甲素(大连美仑生物技术有限公司,配制成200mM母液);巨噬细胞集落刺激因子(M-CSF)、NF-κB受体活化因子配体(RANKL)购自美国R&D公司;alpha MEM、FBS购自美国Gibco公司;CCK-8细胞增殖-毒性检测试剂盒、反转录试剂盒和qRT-PCR试剂盒购自上海碧云天生物技术有限公司;抗酒石酸酸性磷酸酶(TRAP)染色试剂盒购自美国sigma公司。
1.3 方法
1.3.1 骨髓巨噬细胞(bone marrow-derived macrophages,BMMs)的分离、培养及破骨细胞诱导 处死小鼠后分离出股骨和胫骨,用培养基冲出骨髓腔内的细胞后,将细胞转移至T75培养瓶中培养,培养基为含30ng/ml M-CSF的 alpha MEM(含 10%FBS),隔天换液,培养3~5d,获得BMMs。根据不同需要,BMMs传代种板,用含 50ng/ml RANKL、30ng/ml M-CSF的 alpha MEM 培养,隔天换液,直至分化为成熟的破骨细胞。
1.3.2 CCK-8法检测冬凌草甲素对BMMs增殖的影响 收集对数生长期的BMMs,种入96孔培养板中培养,细胞密度为8×103/孔,每板共30孔,分为对照组和9 组添加不同浓度(0.05、0.1、0.2、0.4、0.8、1.6、3.2、6.4和12.8μM)冬凌草甲素的药物组,每组3个复孔;在含30ng/ml M-CSF的 alpha MEM培养基中培养 48、72、96h。然后每孔加入10μl CCK-8溶液,在培养基内再次培养2h后使用酶标仪测定各孔450nm处吸光度(OD)值,实验重复3次,细胞存活率计算公式:细胞存活率=(对照组OD值-药物组OD值)/对照组OD值。
1.3.3 破骨细胞分化和TRAP染色 收集对数生长期的BMMs,种入96孔培养板中培养,细胞密度为1×104/孔,细胞在含 50ng/ml RANKL、30ng/ml M-CSF的 alpha MEM培养基中培养,对照组不加药,药物组浓度由前述CCK-8实验结果确定为0.8、0.4μM(排除冬凌草甲素对BMMs增殖的抑制作用),隔天换液。当对照组已经有明显的破骨细胞形成时培养终止,吸去培养基,用4%多聚甲醛每孔100μl固定细胞20min后,PBS缓冲液冲洗2遍,行TRAP染色,在倒置荧光显微镜下(100×和 200×)观察,计算 TRAP(+)且细胞核数目 3 个以上的破骨细胞数量目和铺展率并拍照分析,其中铺展面积使用ImageJ v.1.51软件计算,铺展率=铺展面积/同一视野总面积。
1.3.4 破骨细胞降钙素受体(CTR)、组织蛋白酶K(CTSK)、活性 T细胞核因子 c1(NFATc1)mRNA表达水平检测 采用qRT-PCR法。收集对数生长期的BMMs细胞,种入6孔培养板中培养,细胞密度为20×104/孔,细胞在含 50ng/ml RANKL、30ng/ml M-CSF的 alpha MEM培养基中培养,对照组不加药,药物组浓度为0.8、0.4μM,隔天换液至第4天。应用Trizol试剂提取细胞的总RNA并测定浓度后,逆转录合成cDNA。以GAPDH为内参,设计引物,GAPDH上游:5′-ACCCAGAAGACTGTGGATGG-3′,下 游 :5′-CACATTGGGGGTAGGAACAC-3′;CTR 上游:5′-TGCAGACAACTCTTG GTTGG-3 ′,下 游 :5′-TCGGTTTCTTCTCCTCTGGA-3′;CTSK 上游:5′-CTTCCAATACGTGCAGCAGA-3′,下 游 :5′-TCTTCAGGGCTTTCTCGTTC-3′;NFATc1 上游:5′-CCGTTGCTTCCAGAAAATAACA-3′,下 游 :5′-TGTGGGATGTGAACTCGGAA-3′。对待测样品的待测基因行qRT-PCR,反应体系为20μ(lSYBR Green Mister 10μl,正向引物 1μl,反向引物 1μl,cDNA 0.5μl,ddH2O 7.5μl),反应条件为 95℃ 5min,94℃ 30s,60℃ 30s,72℃ 60s,循环35次。结果表示及分析使用2-ΔΔCT法。
1.4 统计学处理 采用SPSS 18.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 破骨细胞鉴定 BMMs在含50ng/ml RANKL、30ng/ml M-CSF的alpha MEM培养基中培养6d后,用TRAP染色,对照组在倒置荧光显微镜下可见大量细胞为多个核细胞(≥3个),胞体较大,细胞形态不规则、边缘不规整,有伪足伸出,胞质中出现较多的紫红色颗粒,表明用BMMs成功诱导出破骨细胞。
2.2 冬凌草甲素抑制BMMs增殖 与对照组相比,经不同浓度冬凌草甲素处理48、72h后,浓度>6.4μM的冬凌草甲素有抑制BMMs增殖的作用,差异均有统计学意义(均P<0.05);经冬凌草甲素处理96h后,浓度>3.2μM的冬凌草甲素有抑制BMMs增殖的作用,差异均有统计学意义(均P<0.01),见图1和表1。
2.3 冬凌草甲素抑制破骨细胞分化成熟 由于96h CCK-8实验显示浓度>3.2μM冬凌草甲素对BMMs增殖有明显抑制作用,故笔者选用浓度低于3.2μM作为药物组筛选其是否可抑制破骨细胞的分化。在倒置相差显微镜下观察可见BMMs经6d M-CSF和RANKL共同诱导后行TRAP染色,对照组出现成熟肥大且细胞核>3个的破骨细胞,而药物组(0.4、0.8μM冬凌草甲素)中破骨细胞分化过程明显受到抑制。倒置相差显微镜下统计TRAP(+)且细胞核数目3个或3个以上的破骨细胞数量和铺展率,发现药物组破骨细胞数目和铺展率较对照组均明显减少(均P<0.01),并呈明显剂量依赖性,见图2(插页)、图3和表2。
2.4 各组破骨细胞CTR、CTSK、NFATc1 mRNA相对表达水平比较 与对照组相比,0.4、0.8μM冬凌草甲素药物组中CTR、CTSK、NFATc1的mRNA的表达水平均明显降低(均P<0.01),且呈剂量依赖性,见图4。
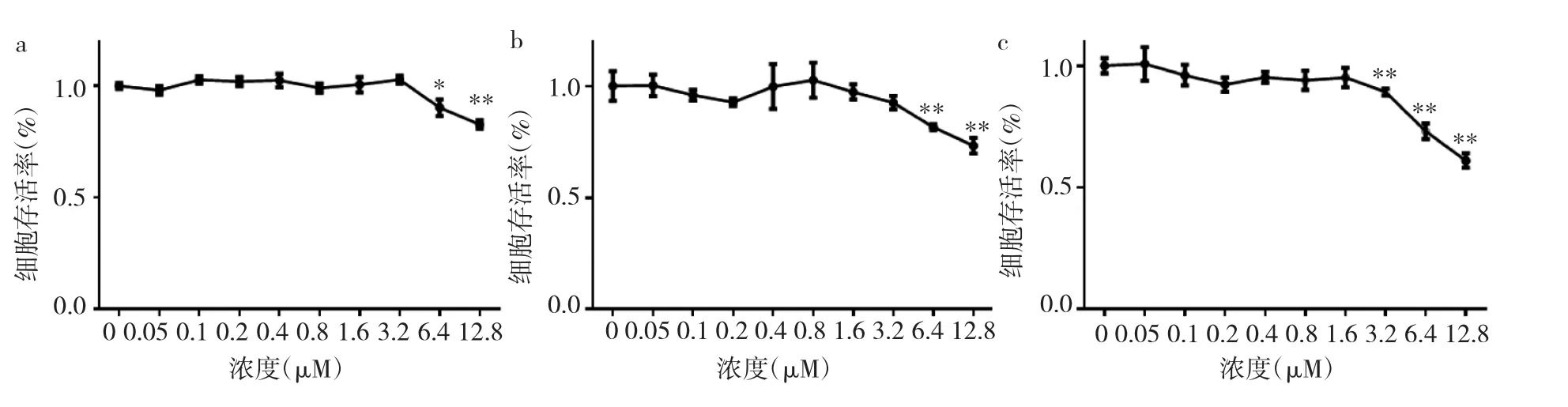
图1 BMMs经不同浓度冬凌草甲素处理48、72、96h后细胞存活率(a:BMMs经不同浓度冬凌草甲素处理48h;b:BMMs经不同浓度冬凌草甲素处理72h;c:BMMs经不同浓度冬凌草甲素处理96h;与对照组比较,*P<0.05,**P<0.01)
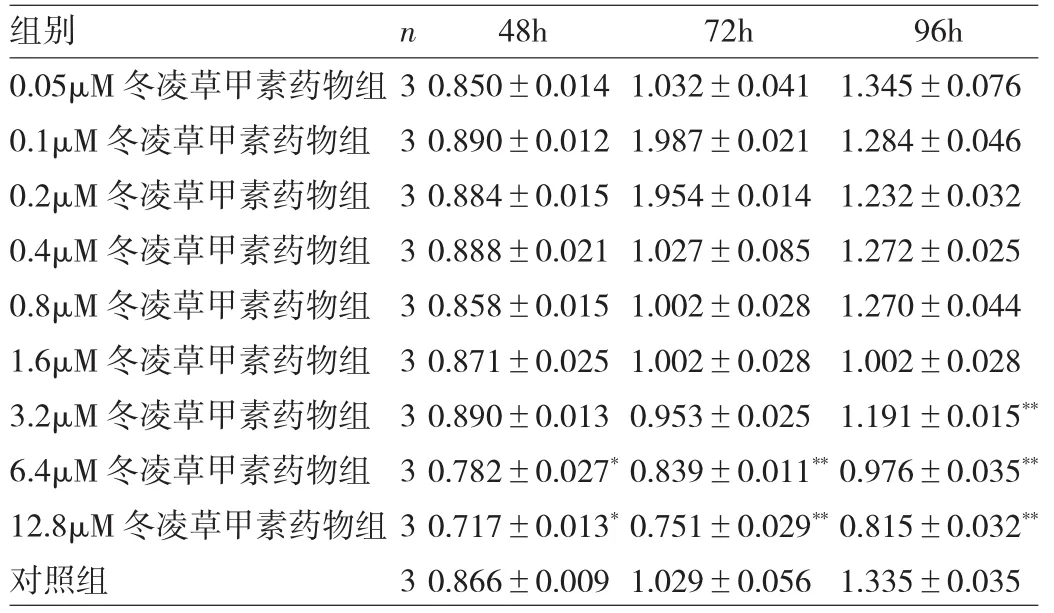
表1 BMMs经不同浓度冬凌草甲素处理48、72、96h后的OD值变化
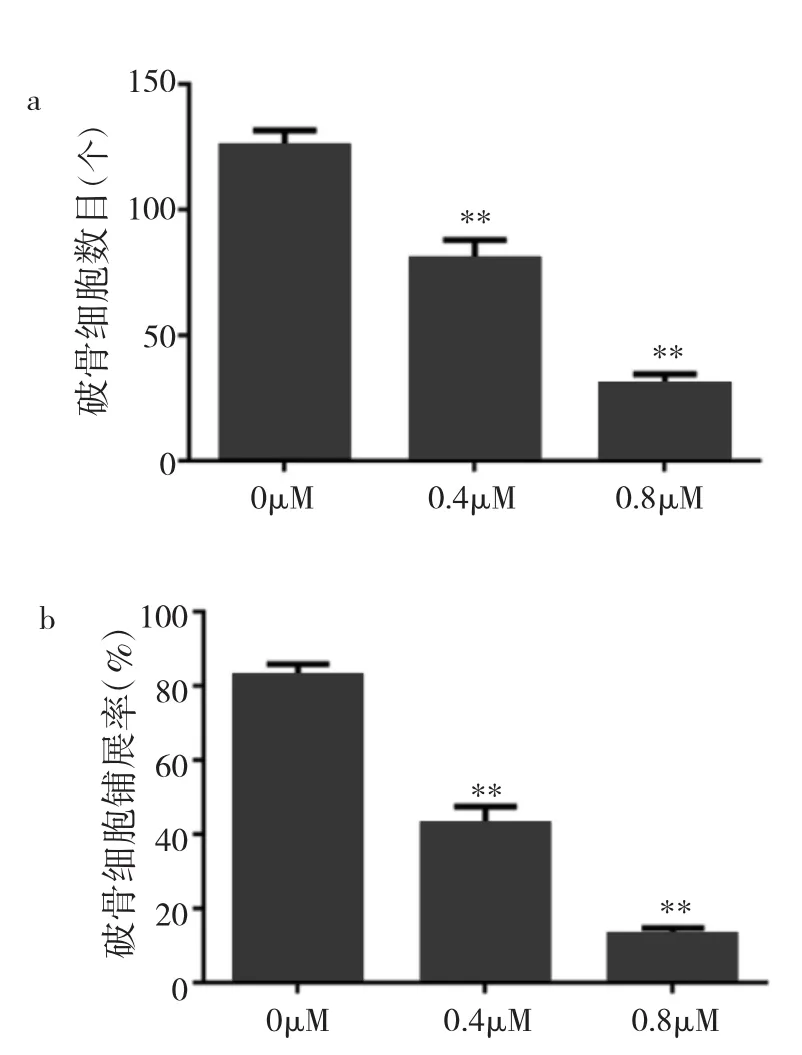
图3 经不同浓度冬凌草甲素处理后破骨细胞数目和铺展率比较(a:经不同浓度冬凌草甲素处理后破骨细胞数目比较;b:经不同浓度冬凌草甲素处理后破骨细胞铺展率比较;与对照组比较,**P<0.01)
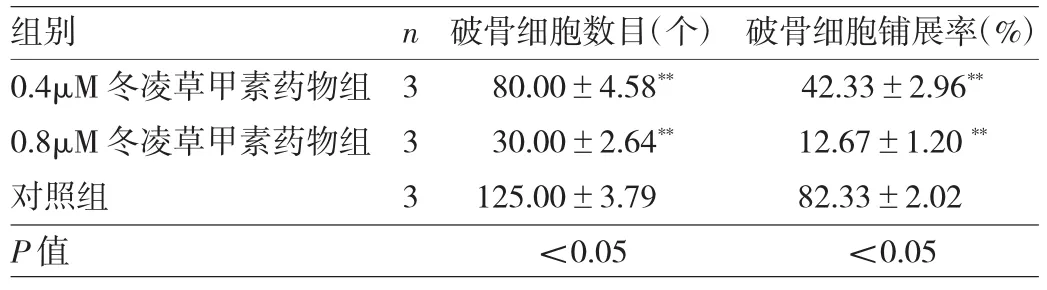
表2 经不同浓度冬凌草甲素处理后破骨细胞数目和铺展率的比较
3 讨论
骨质疏松症现已是老年人常见的慢性病之一,破骨细胞介导的骨吸收和成骨细胞介导的骨形成失衡,导致骨密度降低、骨量减少,是骨质疏松症的重要原因。干扰破骨细胞的分化、增殖、活化、凋亡的任一过程,均能影响破骨细胞的功能,导致骨吸收的增强或减弱[1,6]。因此,干扰破骨细胞的分化增殖是是抑制骨吸收的有效方法。
冬凌草甲素是从唇形科香菜属植物中分离出的一种二萜类天然有机化合物。冬凌草甲素因其具有良好的抑制肿瘤生长转移、抗血管生成、抑制免疫反应等作用被人们熟知[7-11]。本研究观察了冬凌草甲素对BMMs细胞增殖的影响及其在RANKL诱导下往破骨细胞分化的影响,结果表明冬凌草甲素能够使TRAP(+)破骨细胞数目和铺展率明显减少,qRT-PCR显示破骨细胞相关基因CTR、CTSK、NFATc1的mRNA表达水平也明显下调,上述结果显示冬凌草甲素对BMMs的增殖和破骨细胞的分化具有明显的抑制作用。
BMMs是破骨细胞的前体细胞,在50ng/ml RANKL、30ng/ml M-CSF等诱导因子的作用下分化成为破骨细胞。RANKL是破骨细胞分化成熟和维持功能的重要细胞因子,在骨重建中发挥着重要的作用,可以促进破骨细胞分化成熟,增加破骨细胞活性,阻止破骨细胞凋亡。目前发现的破骨细胞内与RANKL相关的信号转导通路主要有4条:NF-κB通路、MAPK通路、PI3K/Akt通路和CN/NFAT通路,且共同激活下游NFATc1转录因子[12-13]。CTR、CTSK、NFATc1是成熟破骨细胞特异性表达的重要基因,RANKL和M-CSF能与BMMs表面的RANK和M-CSF结合,激活NFATc1、NF-κB等转录因子,引起下游的链式反应,合成CTR、CTSK、TRAP等,并促进骨溶解[12-14]。
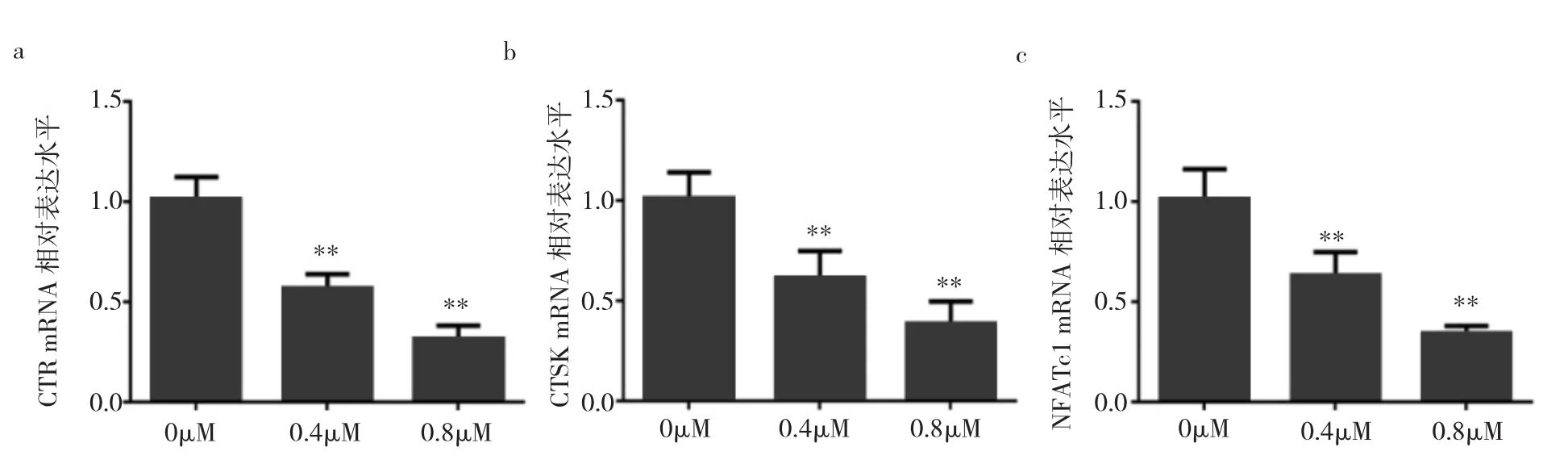
图4 不同浓度冬凌草甲素处理后CTR、CTSK、NFATc1mRNA相对表达水平(a:不同浓度冬凌草甲素处理后CTR mRNA相对表达水平;b:不同浓度冬凌草甲素处理后CTSK mRNA相对表达水平;c:不同浓度冬凌草甲素处理后NFATc1 mRNA相对表达水平;与对照组比较,**P<0.01)
综上所述,本研究显示冬凌草甲素对破骨细胞前体细胞BMMs的增殖及向破骨细胞的分化具有抑制作用,其可能的机制为冬凌草甲素可通过抑制破骨细胞相关基因CTR、CTSK、NFATc1的mRNA表达水平,起到防治破骨细胞相关疾病的作用。本实验仅在体外条件下研究了冬凌草甲素对破骨细胞增殖分化的影响,还需在动物体内行进一步的实验研究。
[1]Nakamura I,Takahashi N,Jimi E,et al.Regulation of osteoclast function[J].Mod Rheumatol,2012,22(2):167-177.doi:10.1007/s10165-011-0530-8.
[2]阮建伟,孔劲松,宫小康,等.骨质疏松症的生物标志物临床应用研究进展[J].浙江医学,2015,37(2):159-161.
[3]Wang Z,Wang D,Yang D,et al.The effect of icariin on bone metabolism and its potential clinical application[J].Osteoporos Int,2018,29(3):535-544.doi:10.1007/s00198-017-4255-1.
[4]Shao H,Shen J,Wang M,et al.Icariin protects against titanium particle-induced osteolysisand inflammatory responsein a mouse calvarial model[J].Biomaterials,2015(60):92-99.doi:10.1016/j.biomaterials.2015.04.048.
[5]戴一,仲飞.冬凌草甲素的结构修饰与生物活性研究进展[J].有机化学,2017,37(7):1701-1713.doi:10.6023/cjoc201702011.
[6]贺丽英,孙蕴,要文娟,等.2010-2016年中国老年人骨质疏松症患病率Meta分析[J].中国骨质疏松杂志,2016,22(12):1590-1596.doi:10.3969/j.issn.1006-7108.2016.12.019.
[7]张典瑞,任天池.冬凌草甲素的药学研究进展[J].中国药学杂志,2003,38(11):817-820.doi:10.3321/j.issn:1001-2494.2003.11.001.
[8]GuiZ,Luo F,Yang Y,etal.Oridonin inhibition and miR200b3p/ZEB1 axis in human pancreatic cancer[J].Int J Oncol,2017,50(1):111-120.doi:10.3892/ijo.2016.3772.
[9]Li X,Li X,Wang J,et al.Oridonin up-regulates expression of P21 and induces autophagy and apoptosis in human prostate cancer cells[J].Int J BiolSci,2012,8(6):901-912.doi:10.7150/ijbs.4554.
[10]Tian L,Xie K,Sheng D,et al.Antiangiogenic effects of oridonin[J].BMC Complement Altern Med,2017,17(1):192.doi:10.1186/s12906-017-1706-3.
[11]Yao Z,Xie F,Li M,et al.Oridonin induces autophagy via inhibition of glucose metabolism in p53-mutated colorectal cancer cells[J].Cell Death Dis,2017,8(2):e2633.doi:10.1038/cddis.2017.35.
[12]Asagiri M,Takayanagi H.The molecular understanding of osteoclast differentiation[J].Bone,2007,40(2):251-264.doi:10.1016/j.bone.2006.09.023.
[13]Kim JH,Kim N.Signaling pathways in osteoclast differentiation[J].Chonnam Med J,2016,52(1):12-17.doi:10.4068/cmj.2016.52.1.12.
[14]Xing L,Schwarz EM,Boyce BF.Osteoclast precursors,RANKL/RANK,and immunology[J].Immunological Reviews,2005,208(1):19-29.doi:10.1111/j.0105-2896.2005.00336.x.

