幽门螺杆菌对胃黏膜上皮细胞周期和自噬的影响
,
1.德阳市人民医院消化内科,四川 德阳 618000; 2.西安医学院第一附属医院检验科
【Abstract】ObjectiveTo investigate the effect of Helicobacter pylori (H.pylori) on gastric epithelial cell cycle and autophagy.MethodsGES-1 cells were treated withH.pylori, flow cytometry was used to detect cell apoptosis and cell cycle, cell proliferation was detected by MTT, Western blotting was used to detect protein LC3 Ⅱ, Beclin 1, apoptosis protein Bcl-2, CDK4 and Cyclin D1 expression levels.ResultsGES-1 cellsAvalue afterH.pylorifrom 0.41±0.03 increased to 0.62±0.05, the apoptosis rate from (5.25±0.47)% increased to (10.32±1.23)%, the proportion of cells in S phase from (26.47±2.45)% increased to (41.66±4.37)%, cell autophagy protein LC3 Ⅱ, Beclin 1 were increased, Bcl-2 protein was decreased, the levels of CDK4 and Cyclin D1 proteins were increased. Compared with normal cells without treatment, the difference was statistically significant (P<0.05).ConclusionH.pyloripromotes cell proliferation and apoptosis, the cell cycle is arrested in S phase, promoting autophagy.
【Keywords】 Helicobacter pylori; Gastric epithelial cell; Cell cycle; Autophagy
幽门螺杆菌(Helicobacter pylori,H.pylori)是慢性胃炎、消化性溃疡等发生的主要原因,且与胃癌的发生有关,H.pylori是人类重要的致癌因子,最初可以引起慢性非萎缩性胃炎,进而导致肠上皮化生,形成胃癌,根除H.pylori可以降低胃癌患病风险,在中国,约50%的人有不同程度的H.pylori感染[1-2]。研究[3-4]显示,H.pylori可以损伤胃黏膜上皮细胞,在H.pylori阳性患者的胃黏膜细胞中发现其增殖细胞核抗原增加,而胃黏膜上皮细胞过度增殖是发生癌变的重要病理学变化。自噬是细胞程序性死亡中的一种,在细胞受到病原微生物感染时,自噬也可以发挥免疫防御的作用,清除病原菌,在H.pylori感染的胃黏膜组织中,细胞自噬水平增加[5-6]。本研究以胃黏膜上皮细胞GES-1为研究对象,用H.pylori处理,探讨H.pylori对胃黏膜上皮细胞增殖、凋亡、细胞周期和自噬的影响,为以后通过调控细胞自噬、凋亡及增殖等途径预防H.pylori感染性疾病的发生提供参考。
1 材料与方法
1.1材料胃黏膜上皮细胞GES-1购自中国科学院细胞库,H.pyloriATCC 43504标准菌株由西安医学院第一附属医院保存。B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)抗体为美国CTS产品;细胞周期依赖性蛋白激酶4(cyclin-dependent kinase 4,CDK4)抗体为美国Santa Cruz产品;Beclin 1抗体、细胞周期蛋白D1(Cyclin D1)抗体为美国Abacm产品;微管相关蛋白1轻链3Ⅱ(microtubule-associated protein light chain 3Ⅱ,LC3Ⅱ)抗体为英国Viva Bioscience产品;膜联蛋白V-FITC(Annexin V-FITC)/碘化丙啶(Propidium Iodide,PI)凋亡检测试剂盒为北京索莱宝产品;胰蛋白酶、DMEM为美国Sigma产品;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒为北京TIANGEN产品;胎牛血清为杭州四季青产品。
1.2细胞培养GES-1细胞从液氮中取出后,将冻存管置于37 ℃的水浴中溶解完全,将细胞转移至离心管,加入2 ml质量浓度为100 g/L胎牛血清的DMEM细胞培养液,混合后,在室温,1 000 r/min,离心半径为6 cm,离心5 min。吸除上清液后,加入5 ml细胞培养液,混合后,接种到25 ml的细胞培养瓶中培养,培养参数为:饱和湿度,37 ℃,体积分数为5%的CO2培养箱。当细胞培养密度达到80%以后,倒掉原来的培养液上清,加入2 ml的磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗涤2次细胞。加入2 ml含有质量浓度为0.2 g/L EDTA和2.5 g/L的胰蛋白酶消化液,37 ℃孵育2 min。加入3 ml的细胞培养液,1 000 r/min离心10 min。吸除上清液,加入3 ml的细胞培养液,以1∶3的比例种植到细胞瓶中,继续培养。
1.3细胞处理及分组GES-1细胞用不含有抗生素的质量浓度为100 g/L胎牛血清的DMEM培养液培养。用H.pylori标准菌株感染复数(MOI=200)处理细胞,记为实验组,同时以不加入H.pylori的细胞为对照组,培养24 h后,收集各组细胞,用于后续实验研究。
1.4MTT检测细胞增殖GES-1细胞种植到96孔细胞培养板中,每孔加入5 000个细胞,按照1.3中方法处理实验组和对照组细胞,每组设置4个复孔,培养24 h后,在每孔中加入20 μl的MTT溶液,37 ℃孵育4 h。把培养液吸除后,加入150 μl的二甲基亚砜溶液,反应10 min。检测每孔490 nm的吸光度值(A值)。实验重复3次,取均值。
1.5流式细胞术检测细胞凋亡对照组和实验组细胞按照上述方法培养24 h后,将细胞培养液吸除、胰蛋白酶消化后,收集各组细胞,用4 ℃的PBS洗涤2次后,将细胞浓度调整为2×106ml-1,吸取1 ml细胞,离心。加入5 μl PI和5 μl Annexin V-FITC,在避光条件下结合20 min,加入400 μl结合缓冲液,用流式细胞仪检测细胞凋亡,实验重复3次,取均值。
1.6流式细胞术检测细胞周期对照组和实验组细胞按照上述方法培养24 h后,将细胞培养液吸除、胰蛋白酶消化后,收集各组细胞,用4 ℃的PBS洗涤2次后,将细胞浓度调整为2×106ml-1细胞。吸取1 ml细胞,离心,取细胞沉淀,加入1 ml的低渗柠檬酸标记液,混匀后,在4 ℃放置30 min,离心后,吸除上清液后,加入200 μl的缓冲液,用流式细胞仪检测细胞周期。实验重复3次,取均值。
1.7Westernblotting检测LC3Ⅱ、Beclin1、Bcl-2、CDK4、CyclinD1水平对照组和实验组细胞按照上述方法培养24 h后,把细胞培养液吸除,用2 ml的PBS洗涤2次细胞,按照每个25 ml细胞培养瓶加入500 μl裂解液,在4 ℃裂解30 min。4 ℃,12 000 r/min离心15 min。收集蛋白上清液,用BCA法对蛋白进行定量检测。配制质量浓度为100 g/L的分离胶和质量浓度为50 g/L的浓缩胶。把蛋白样品与4×SDS-PAGE上样缓冲液以体积比为3∶1的比例混匀后,在100 ℃煮沸5 min。每孔加入30 μg的蛋白样品,以90 V恒压电泳,观察溴酚蓝到分离胶的底部时停止电泳。200 mA将蛋白转印至硝酸纤维素膜(NC膜)上,转膜时间为2 h。NC膜置于质量浓度为50 g/L的脱脂奶粉中,4 ℃封闭过夜。NC膜放在1∶1 000稀释的一抗中,37 ℃孵育2 h后,用TBST(Tris-HCl缓冲盐溶液+Tween)在室温洗涤3次。将NC膜放在1∶3 000稀释的二抗中,37 ℃孵育2 h。同样用TBST洗涤3次,ECL化学发光,Image Lab曝光,用Bio-Rad分析条带灰度值。用目的条带灰度值除以GAPDH灰度值表示蛋白水平。实验重复3次,取均值。

2 结果
2.1细胞增殖凋亡检测结果对照组和实验组细胞A值分别为:0.41±0.03、0.62±0.05,细胞凋亡率依次为:(5.25±0.47)%、(10.32±1.23)%。实验组A值和细胞凋亡率均明显高于对照组,差异有统计学意义(t1=6.238,t2=6.669,P<0.05,见图1)。H.pylori促进胃黏膜上皮细胞增殖和凋亡。

图1 流式细胞术检测细胞凋亡Fig 1 Cell apoptosis detected by flow cytometry
2.2细胞周期检测结果实验组G0/G1期细胞明显低于对照组,而S期细胞明显高于对照组,差异有统计学意义(P<0.05)。H.pylori将胃黏膜上皮细胞周期阻滞在S期(见表1)。
2.3自噬蛋白LC3Ⅱ、Beclin1检测结果对照组和实验组LC3 Ⅱ水平为:0.41±0.03、0.95±0.11,Beclin 1水平为:0.36±0.03、1.04±0.12。实验组LC3Ⅱ、Beclin 1的表达水平明显高于对照组,差异有统计学意义(t1=8.203,t2=9.522,P<0.05)(见图2)。表明H.pylori促进胃黏膜上皮细胞自噬。

表1 各组细胞周期变化Tab 1 Changes of cell cycle %
注:与对照组相比,t=6.890,t=5.252,*P<0.05;与对照组相比,t=5.252,#P>0.05。
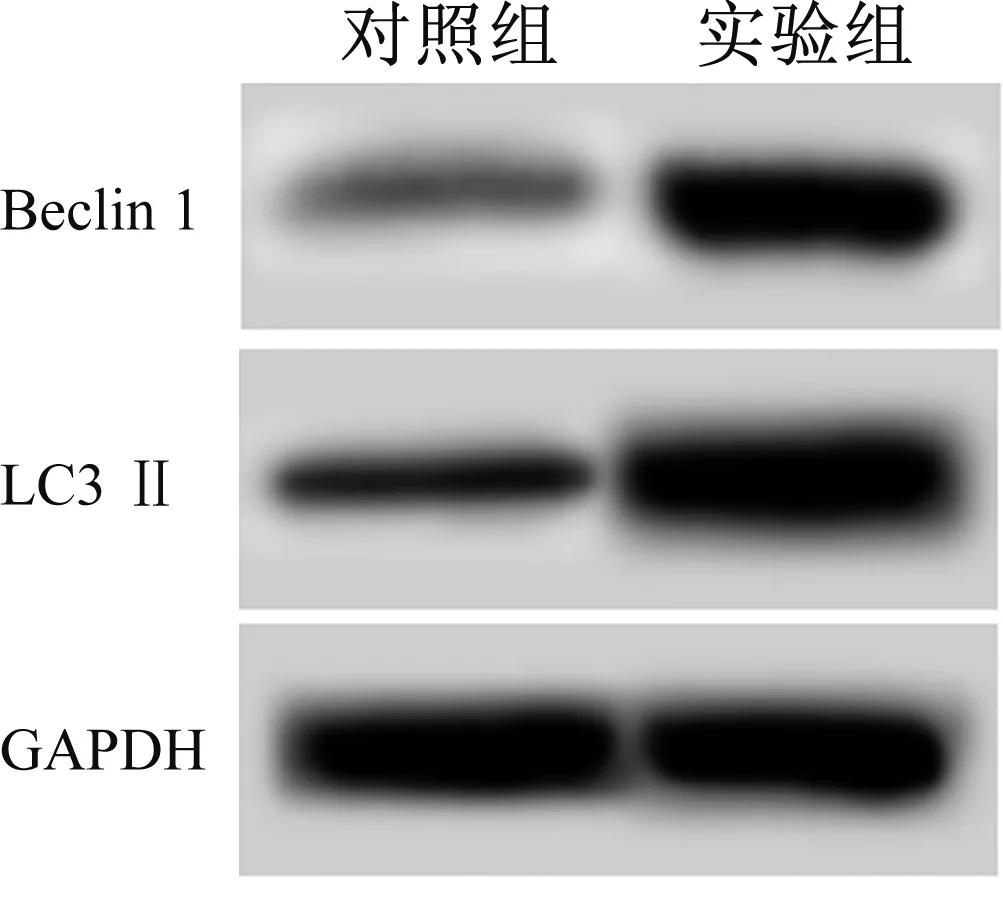
图2 Western blotting检测细胞中自噬蛋白LC3Ⅱ、
2.4Bcl-2、CDK4、CyclinD1水平检测结果实验组Bcl-2表达水平明显低于对照组,而CDK4、Cyclin D1水平明显高于对照组,差异有统计学意义(P<0.05)(见图3、表2)。表明H.pylori抑制胃黏膜上皮细胞中Bcl-2表达,促进CDK4、Cyclin D1表达。

图3 Western blotting检测Bcl-2、CDK4、Cyclin D1水平Fig 3 Levels of Bcl-2, CDK4, Cyclin D1 detected byWestern blotting
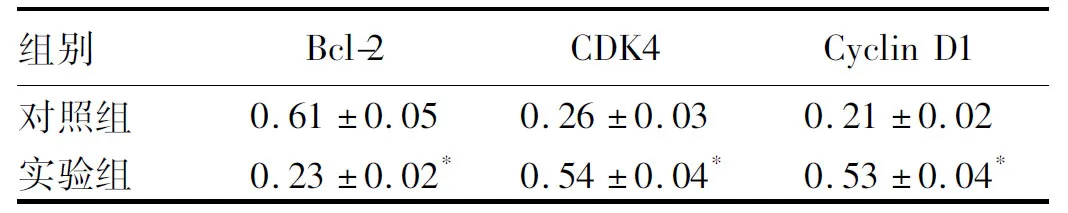
注:与对照组相比,t=12.222,t=9.700,t=12.394,*P<0.05。
3 讨论
研究[7]显示,H.pylori感染与胃癌的发病率呈正相关,H.pylori感染者发生胃癌的概率是非感染者的6倍左右。在胃癌发生过程中,细胞过度增殖,而随着细胞增殖速度的加快,细胞发生DNA复制错误等的机会增加,基因突变的概率升高,细胞恶性增殖的速度也会增加[8]。从慢性浅表性胃炎到萎缩性胃炎,再到肠上皮化生、异型增生等这一系列过程中,胃黏膜上皮细胞的增殖速度不断加快,也是胃癌发生的标志之一[9]。
在正常情况下,细胞的增殖和凋亡处于平衡状态,细胞增殖加快时,细胞凋亡减少。但在H.pylori感染的患者中,胃黏膜上皮细胞增殖和凋亡速度均增加[10]。研究[3-4,11]显示,在H.pylori感染的大鼠模型中,胃黏膜组织中的细胞凋亡速度增加,组织中增殖细胞核抗原的阳性率升高。本研究用H.pylori处理胃黏膜上皮细胞,发现细胞的增殖能力增加,细胞凋亡水平也增加,说明H.pylori可以诱导胃黏膜上皮细胞增殖和凋亡。
细胞周期可以分为间期、分裂期,其中G1期、S期和G2期组成间期,M期是细胞分裂期[12]。调控细胞周期的因素有很多,与细胞内基因的转录等有关[13]。细胞周期性蛋白(Cyclin)和细胞周期蛋白依赖激酶(CDKs)等是调控细胞周期的重要因子,Cyclin D1和CDK4可以形成复合物,促进S期相关基因的表达,促进细胞从G0/G1期向S期转化[14]。本研究结果显示,H.pylori处理后的胃黏膜上皮细胞S期细胞比例增加,细胞中Cyclin D1和CDK4水平升高,说明H.pylori可以促进细胞中Cyclin D1和CDK4表达,从而将周期阻滞在S期。
自噬是细胞为了维持内环境稳定,通过合成新的蛋白质,把原来异常或老化的蛋白降解掉的过程,是一种进化较为保守的溶酶体依赖的降解途径[15]。正常情况下,自噬对细胞稳态维持具有重要作用,而在病理因素的作用下,自噬还与肿瘤发生、老年痴呆、细菌感染、帕金森、免疫相关疾病等的发生有关[16-18]。Beclin-1在自噬分隔膜形成的早期作为一种平台分子,可以调控磷脂酰肌醇等复合物的形成,此外,Beclin-1还可以与Bcl-2蛋白结合,抑制自噬发生,而Bcl-2作为一种重要的凋亡相关蛋白,参与调控细胞凋亡的发生[19-20]。LC3Ⅱ是细胞自噬的标志蛋白,LC3的C端甘氨酸残基暴露形成LC3Ⅱ[20-22]。本研究结果显示,H.pylori作用后的胃黏膜上皮细胞中LC3Ⅱ、Beclin-1蛋白水平升高,Bcl-2水平降低,细胞自噬水平升高。
综上,H.pylori促进胃黏膜上皮细胞增殖、凋亡,阻滞细胞周期,诱导细胞自噬,导致胃黏膜不稳定,这可能是其促进胃癌发生的原因。本研究结果为研究H.pylori在胃癌发生中的作用提供了理论参考,为研究其作用机制奠定了基础。
[1] MYINT T, SHIOTA S, VILAICHONE R K, et al. Prevalence of Helicobacter pylori infection and atrophic gastritis in patients with dyspeptic symptoms in Myanmar [J]. World J Gastroenterol, 2015, 21(2): 629-636. DOI: 10.3748/wjg.v21.i2.629.
[2] CHEN X Z, SCHÖTTKER B, CASTRO F A, et al. Association of helicobacter pylori infection and chronic atrophic gastritis with risk of colonic, pancreatic and gastric cancer: A ten-year follow-up of the ESTHER cohort study [J]. Oncotarget, 2016, 7(13): 17182-17193. DOI: 10.18632/oncotarget.7946.
[3] 朱立宁, 徐岷, 张尤历, 等. 不同基因型幽门螺杆菌对人胃黏膜上皮细胞引起免疫损伤的作用[J]. 国际消化病杂志, 2016, 36(1): 63-65. DOI: 10.3969/j.issn.1673-534X.2016.01.016.
[4] BYUN E, PARK B, LIM J W, et al. Activation of NF-κB and AP-1 mediates hyperproliferation by inducing β-catenin and c-Myc in Helicobacter pylori-infected gastric epithelial cells [J]. Yonsei Med J, 2016, 57(3): 647-651. DOI: 10.3349/ymj.2016.57.3.647.
[6] HOLCK S, HOLM I L, HOLCK P P, et al. Epithelial cell kinetics of the gastric mucosa during Helicobacter pylori infection [J]. FEMS Immunol Med Microbiol, 2007, 50(2): 206-212. DOI: 10.1111/j.1574-695X.2007.00254.x.
[7] LEE Y C, CHIANG T H, CHOU C K, et al. Association between Helicobacter pylori eradication and gastric cancer incidence: a systematic review and Meta-analysis [J]. Gastroenterology, 2016, 150(5): 1113-1124.e5. DOI: 10.1053/j.gastro.2016.01.028.
[8] SAKA A, YAGI K, NIMURA S. Endoscopic and histological features of gastric cancers after successful Helicobacter pylori eradication therapy [J]. Gastric Cancer, 2016, 19(2): 524-530. DOI: 10.1007/s10120-015-0479-y.
[9] 张卫民, 赖卓胜, 许刚, 等. 幽门螺杆菌源抗菌肽对胃黏膜上皮细胞及胃癌细胞生长的影响[J]. 中华消化杂志, 2003, 23(12): 715-717. DOI: 10.3760/j.issn:0254-1432.2003.12.003.
ZHANG W M, LAI Z S, XU G, et al. In vitro effects of cecropin-like antibacterial peptide from Helicobacter pylori on gastric cancer cells and gastric epithelial cells [J].Chin J Dig, 2003, 23(12): 715-717. DOI: 10.3760/j.issn:0254-1432.2003.12.003.
[10] CRABTREE J E, COURT M, ABOSHKIWA M A, et al. Gastric mucosal cytokine and epithelial cell responses to Helicobacter pylori infection in Mongolian gerbils [J]. J Pathol, 2004, 202(2): 197-207. DOI: 10.1002/path.1498.
[11] LIU T, SHI Y, LIU X F, et al. Helicobacter pylori HP0876 is dispensable for heme-iron acquisition but attenuates bacterial adherence to gastric epithelial cells [J]. Curr Microbiol, 2012, 65(3): 254-261. DOI: 10.1007/s00284-012-0153-0.
[12] 冯少勇, 张雁钢, 张利, 等. 细胞周期点激酶l/2的研究进展[J]. 中华临床医师杂志(电子版), 2015, 9(10): 1916-1921. DOI: 10.3877/cma.j.issn.1674-0785.2015.10.035.
FENG S Y, ZHANG Y G, ZHANG L, et al. Progress in the study of cell cycle checkpoint kinase 1/2 [J]. Chin J Clinicians (Electronic Edition), 2015, 9(10): 1916-1921. DOI: 10.3877/cma.j.issn.1674-0785.2015.10.035.
[13] 尹淑杰, 张涛, 荣光影, 等. 川芎嗪对阿尔茨海默病大鼠学习记忆能力和细胞周期蛋白E、P21表达的影响[J]. 中国老年学杂志, 2016, 36(20): 4961-4962. DOI: 10.3969/j.issn.1005-9202.2016.20.009.
[14] HOSOOKA T, OGAWA W. A novel role for the cell cycle regulatory complex cyclin D1-CDK4 in gluconeogenesis [J]. J Diabetes Investig, 2016, 7(1): 27-28. DOI: 10.1111/jdi.12369.
[15] DUAN L, PEREZ R E, DAVAADELGER B, et al. p53-regulated autophagy is controlled by glycolysis and determines cell fate [J]. Oncotarget, 2015, 6(27): 23135-23156. DOI: 10.18632/oncotarget.5218.
[16] HOSSEINZADEH M, NIKSERESHT S, KHODAGHOLI F, et al. Cannabidiol post-treatment alleviates rat epileptic-related behaviors and activates hippocampal cell autophagy pathway along with antioxidant defense in chronic phase of pilocarpine-induced seizure [J]. J Mol Neurosci, 2016, 58(4): 432-440. DOI: 10.1007/s12031-015-0703-6.
[17] 徐俊杰, 王志莲, 郝敏. 细胞自噬与肿瘤的研究进展[J]. 中华临床医师杂志(电子版), 2016, 10(5): 701-706. DOI: 10.3877/cma.j.issn.1674-0785.2016.05.021.
XU J J, WANG Z L, HAO M. Research progress of autophagy and tumor [J]. Chin J Clinicians (Electronic Edition), 2016, 10(5): 701-706. DOI: 10.3877/cma.j.issn.1674-0785.2016.05.021.
[18] NIXON R A, YANG D S. Autophagy failure in Alzheimer’s disease-locating the primary defect [J]. Neurobiol Dis, 2011, 43(1): 38-45. DOI: 10.1016/j.nbd.2011.01.021.
[19] BASPINAR S, BIRCAN S, YAVUZ G, et al. Beclin 1 and bcl-2 expressions in bladder urothelial tumors and their association with clinicopathological parameters [J]. Pathol Res Pract, 2013, 209(7): 418-423. DOI: 10.1016/j.prp.2013.04.006.
[20] BASPINAR S, BIRCAN S, ORHAN H, et al. The relation of beclin 1 and bcl-2 expressions in high grade prostatic intraepithelial neoplasia and prostate adenocarcinoma: a tissue microarray study [J]. Pathol Res Pract, 2014, 210(7): 412-418. DOI: 10.1016/j.prp.2014.02.008.
[21] SAHNI S, BAE D H, LANE D J, et al. The metastasis suppressor, N-myc downstream-regulated gene 1 (NDRG1), inhibits stress-induced autophagy in cancer cells [J]. J Biol Chem, 2014, 289(14): 9692-9709. DOI: 10.1074/jbc.M113.529511.
[22] 谢敏, 郭燕君, 徐营, 等. 去血清饥饿法对卵巢颗粒细胞自噬因子LC3和Beclin-1表达的影响[J]. 中国妇幼保健, 2016, 31(5): 1045-1047. DOI: 10.7620/zgfybj.j.issn.1001-4411.2016.05.59.
XIE M, GUO Y J, XU Y, et al. Effect of serum starvation on expressions of LC-3 and Beclin-1 in granulosa cells of ovary [J]. Maternal & Child Health Care of China, 2016, 31(5): 1045-1047. DOI: 10.7620/zgfybj.j.issn.1001-4411.2016.05.59.
doi:10.3969/j.issn.1006-5709.2018.06.017

