经食管支架植入术反流性食管炎大鼠模型的建立与探讨
,,,,,,,,,
1.广西中医药大学第一附属医院脾胃病科,广西 南宁 530023; 2.广西中医药大学研究生学院
【Abstract】ObjectiveTo improve the technique of cardiac steel ring implantation and fixation, and to establish the rat modeling method of reflux esophagitis(RE), and to explore the feasibility and effectiveness of esophageal stent implantation.MethodsThirty SD rats were randomly divided into the model group and control group. The rats in model group were treated by esophageal stent implantation: a steel ring was fixed on a sheath and pushed from the mouth to the cardia through esophagus, and then it was fixed with fish line suturing. The rats in control group were treated by esophageal balloon dilatation: a balloon was inserted along the guide wire into esophagus and localized in the gastroesophageal junction, then the balloon was inflated to maintain 10 minites. After operation, nursing observation and weight measurement were carried out on the animals, and the pathological changes of the esophageal specimens were obtained after 4 weeks.ResultsThe pathological examination showed that both two groups had obvious pathological changes in esophagus. Pathological changes and inflammatory lesions, especially in the lower esophagus, were obviously observed in the esophageal mucosa of the rats. And the pathological changes in the model group were more serious than that in the control group, while, the model group had a low survival rate.ConclusionUsing esophageal stent implantation could successfully produce the rat model of RE, which has the features of significant pathological changes in esophagus, relatively simple operation and light trauma with the rats, showing that the modeling method is feasible and worth popularization.
【Keywords】 Rat model; Reflux esophagitis; Esophageal interventional therapy; Stent implantation
胃食管反流病(gastroesophageal reflux disease,GERD)是胃内容物反流入食管、口腔(包括喉部)或肺所致的症状和并发症。酸(碱)反流导致的食管黏膜破损称为反流性食管炎(reflux esophagitis,RE)。近年来,随着国内外对RE发病原因和机制的相关研究不断深入,RE动物模型的研究成为目前研究的一个热点。廖旭等应用食管气囊扩张微创方法建立GERD动物模型,探索食管下括约肌(low esophageal sphincter,LES)松弛发病的机制,然而成功率偏低。王斌等在廖旭的基础上改用Forley导尿管建立兔RE模型,不足之处为扩张强度较难把握。有学者[5-7]探索破坏LES及其周围解剖组织的方法造成GERD,采用部分贲门肌切开加幽门半缝扎术制备RE动物模型。有学者[8]探索采用不同幽门管径限制幽门舒张合并前胃结扎以限制胃容量的方法制作RE模型,探讨不同的幽门结扎内径大小对RE模型的存活率、食管炎发生率的影响。另有学者[9]采用食管十二指肠侧侧吻合术叠加夹尾刺激法所形成的RE大鼠动物模型制备方法,发现模型质量及病变形成率高,术后动物并发症及死亡率相对较小。为了探索安全有效的动物模型制备方法,本研究在借鉴以往RE动物模型制作方法的基础上,拟通过经食管植入金属支架的技术手段,扩张动物食管下端,来制作RE的大鼠模型。
1 材料与方法
1.1实验动物12~13月龄清洁级SD大鼠30只,雌雄各半,体质量220~250 g,购自广西医科大学实验动物中心,实验动物合格证号:SCXK桂2009-0002。实验动物使用许可证:SYKG桂2009-2005。
1.2实验方法大鼠购回后,适应环境7 d,于手术前禁食24 h,手术前采用质量浓度为100 g/L的水合氯醛进行腹腔注射麻醉,剂量为0.3 ml/100 g。
1.2.1 模型组:麻醉后将大鼠置于手术台,开腹后,将钢圈(钢丝直径0.31 mm,钢圈内径0.35 cm,长0.5~0.6 cm)套在鞘芯上,从口腔经食管送钢圈于贲门处,先退出鞘芯,再退出鞘,用鱼线(0.4号,0.10 mm)缝合固定钢圈于贲门处,关腹前腹腔内注入青霉素105单位。如图1所示,开腹后,仔细钝性分离周围神经及血管,切勿损伤血管神经,利用止血镊分开充分暴露食管后,镊子夹住大鼠下牙后将头部抬起使口腔跟食管成一直线,利于将套有钢圈的鞘管经食管送进贲门,分别退出鞘心和鞘,使钢圈进到贲门处,用鱼线缝合固定钢圈于贲门处,逐层关腹即可。
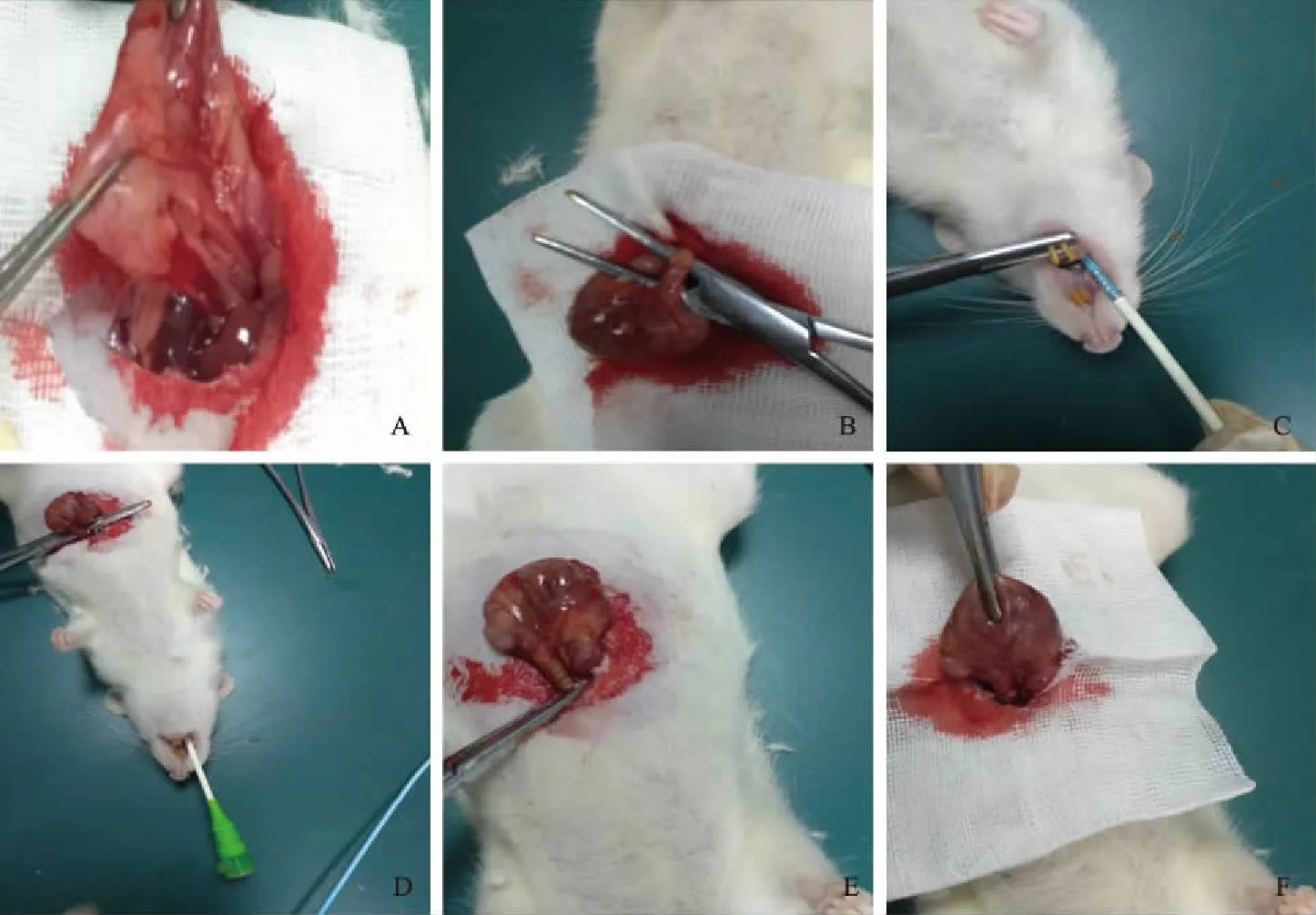
图1 模型组大鼠构建RE的步骤
A:钝性分离周围的静脉和神经;B:充分暴露食管;C:将套有钢圈的鞘管经食管送进贲门;
D:退出鞘心和鞘;E:钢圈进到贲门处;F:鱼线缝合固定钢圈
Fig1ThestepsofconstructingREinmodelgroup
A: blunt separation of the surrounding veins and nerves; B: full exposure of the esophagus; C: the sheath with a steel ring was sent through the esophagus into the fontanelle; D: withdrawal sheath; E: steel ring entered the fontanelle; F: suture thread fixing steel ring
1.2.2 对照组:麻醉后将大鼠置于手术台,插管前仔细检查单腔管确无漏气后,抽尽气囊内气体,涂液体石蜡后,经口腔插管送至贲门处,距离口腔约9 cm,缓慢向气囊内加压至50 mmHg,维持10 min,重复3次,每次间隔3 min。对于一次扩张无效的动物还可以进行多次重复扩张。图2为X射线下的大鼠,球囊顺利进入贲门处后加压扩张。
1.3术后观察术后禁食24 h、不禁水,密切观察模型组和对照组大鼠饮食、排便及活动情况,每周测量体质量1次。对死亡动物随即行尸体解剖,观察胸腹腔脏器大体改变,以对其死因作出分析判断。

图2 对照组气囊扩张贲门后的大鼠 Fig 2 Rats after balloon dilation in control group
1.4X线检测大鼠钢圈脱落情况对模型组大鼠在植入钢圈术1周后开始进行X线拍摄,观察钢圈在大鼠胃肠道的位置。
1.5病理检查4周后,处死大鼠,取食管中下段组织置于质量浓度为100 g/L的甲醛溶液中固定,石蜡包埋,常规HE染色后,用光镜观察组织学病理改变。
2 结果
2.1一般情况两组大鼠毛发光亮,精神清醒,体质量220~250 g,饮食正常,活动良好,其中模型组腹部可见2.5~3 cm长的伤口,在4周后逐渐消退,伤痕也逐渐消失。模型组在实验过程中,术中因穿孔死亡1只,术后死亡2只,死亡率为20.00%,对照组术中无死亡,术后死亡1只,死亡率为6.67%,对照组存活率较模型组高。
2.2模型组大鼠钢圈脱落情况经X线拍摄发现,有少量大鼠的钢圈从第2周开始出现脱落,至第3周出现大量脱落,第4周几乎全部脱落。其中可见少量钢圈脱落至胃部(见图3~4)。
2.3食管下段病理模型组:造模4周后,病理显示可分为3度:轻度者至重度者鳞状上皮增生,黏膜固有层延长,炎症细胞(中性粒细胞和淋巴细胞)浸润。
中度者较前加重并伴有固有层组织轻度充血出血和水肿,伴有糜烂。重度者较前加重,可见鳞状上皮乳头状增生,炎症细胞(中性粒细胞、淋巴细胞和少量嗜酸性粒细胞)灶性浸润加重,可见多核巨细胞及小灶坏死,糜烂程度加重。对照组:造模4周后,病理显示,轻度炎症者鳞状上皮增生,固有层乳头延伸,食管肌层弥漫性炎。中重度者可见食管肉芽肿性炎及水肿,小灶坏死,大量炎症细胞(泡沫细胞、中性粒细胞和淋巴细胞)浸润(见图5)。

图3 钢圈在贲门部;图4 钢圈在胃部Fig 3 Steel rings in the cardiac area; Fig 4 Steel rings in the stomach
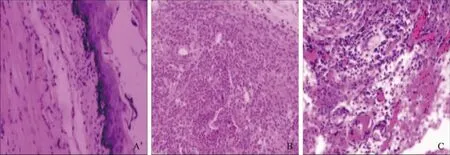
图5 食管病理图片(HE 100×)
A:正常食管;B:模型组;C:对照组
Fig5Pathologyofesophagus(HE100×)
A: normal esophagus; B: model group; C: control group
3 讨论
RE的病理机制复杂,要制备病变形成率高、死亡率低、模型长久稳定、方法简单易行的动物模型,是相关科学实验有待解决的一个难点。与大动物模型相比,大鼠模型具有经济性、可重复性、实验条件易控制、可大规模进行等优点。但大鼠RE模型的建立是一项手术要求相对较高的实验技术方法,要建立一个稳定的动物模型并不是一件容易之事,必须经过较长时间的探索和训练才能完成。
抗反流屏障的结构和功能缺陷是造成GERD的原因之一,本次实验目的是降低LES压力,造成以胃酸为主的反流。实验结果表明,采用介入的方法建立模型,可以减少胃的创伤;在贲门处置入钢圈,可造成大鼠模型以中下段为主的食管组织病理有较明显的炎症改变,且存活率较高,表明该造模方法具有较强的可行性和推广价值。
总结本次RE的造模实验,有以下经验和教训供大家参考:
术前准备:为保证手术顺利进行,大鼠术前24 h禁食而不禁水,可使大鼠胃肠道排空,利于视野暴露及手术吻合,防止感染,否则胃内容物易从食管伤口渗出,造成腹腔感染导致大鼠死亡。
麻醉控制:对于建立动物模型而言,良好麻醉效果是做好手术的第一关。我们采用质量浓度为100 g/L的水合氯醛,起效快、麻醉效果较好,水合氯醛具有实用、价格便宜的特点,且毒性小,对大鼠毒性损伤较少。大鼠麻醉剂量为0.3 ml/100 g水合氯醛,若麻醉剂量不足,术中可出现大鼠不停挣扎,严重者造成组织损伤,使手术无法顺利进行。麻醉时为避免扎到腹腔脏器,抓住大鼠耳朵和颈部的皮肤,把大鼠的尾巴压在无名指下,捏紧将大鼠提起来,暴露腹部,斜45°进针,不可粗鲁或大力进针,极易扎伤腹部脏器,造成感染或死亡。待到有落空感后,回抽针管,观察是否有血,再进行注射。
术中注意事项:大鼠食管有3个狭窄处,鞘管经食管送进去的时候注意温柔小心,切记捅伤食管,严重者捅破食管进去胸腔,引起肺部感染。若感觉进去困难,可用润滑油或石蜡油涂擦鞘管,可使阻力减小。其次,固定线不仅要细小而且要耐腐蚀,钢圈在贲门部要缝合固定3~4次,线头要剪短又防止过短脱落。本次实验需要改进之处为可以采用更加耐腐蚀耐酸的缝合线,改进损伤更小、固定更牢靠的钢圈缝合方式,其食管炎症可能会更严重,且模型维持时间可能会更久。第三,腹部术口切记过大,术口为2.5~3 cm,若大鼠本身胃体较大,可视情况调整术口大小。缝合腹部伤口时要全层吻合,利于痊愈和防止感染。若缝合质量不高,不严密,可导致感染或术后腹部疝气等。若食管术口缝合不紧密可能会导致胃液渗出到腹腔,造成腹腔感染导致死亡,若腹部术口缝合不紧密可能会导致感染或腹部疝气等并发症,甚至导致死亡。
抗感染:大鼠的耐受力较好,能够抵抗一定的感染。但由于进行手术后,大鼠易受感染死亡,术后应予一定剂量的抗生素,可有效减少腹部切口、贲门缝合固定处的感染几率。在预实验中,我们发现,大鼠腹部切口因感染而红肿,大鼠撕咬缝线造成腹部切口开裂,肠管暴露而至死亡。若未能在无菌环境下进行手术,可考虑术前予大鼠抗生素,术后维持3 d的抗生素。
术后大鼠复温:冬季术后复温尤为重要,术后给予大鼠烤灯复温,皮毛烘干2~3 h,视具体情况而定。大鼠约1 h后清醒,能翻身爬起活动,但行动迟缓、无目标,精神较差,对外界刺激淡漠,饮水量较少。待神志清醒,活跃走动时即可撤除烤灯。术后禁食24 h,不禁水。
术后恢复情况:模型组大鼠造模创伤较小,食管炎症较为长久,然而大鼠有自愈机制,我们观察到大鼠2~3个月后食管炎症能自行恢复,但仍有伤口疤痕存在。对照组的食管炎症持续时间较模型组短,能持续约2个月。我们观察到大鼠食管中下段炎症在第3~4周最严重,也是钢圈脱落最密集的时间,由于大鼠的耐受力较好,自身修复能力较强,炎症程度会得到不同程度的缓解,推测大鼠维持GERD模型时间为2~3个月。
本实验建立在参考心脏支架手术之上,由于食管管道跟心血管管道相似,食管具有弹性与收缩性,钢圈扩张食管,降低LES压力,造成胃酸反流而形成RE动物模型,本实验需要改进之处为若找到类似心血管支架的材料替代钢圈,可减少食管缝合创伤及腹部创伤,降低感染风险,提高动物生存率,同时可延长食管炎症时间,不会导致钢圈脱落,若能找到此种材料替代,且价钱便宜,则能进一步完善该实验造模方法。
[1] KATZ P O, GERSON L B, VELA M F. Guidelines for the diagnosis and management of gastroesophageal reflux disease [J]. Am J Gastroenterol, 2013, 108(3): 308-328; quiz 329. DOI: 10.1038/ajg.2012.444.
[2] 中华医学会消化内镜学分会. 反流性食管炎诊断及治疗指南(2003年)[J]. 中华消化内镜杂志, 2004, 21(4): 221-222. DOI: 10.3760/cma.j.issn.1007-5232.2004.04.001.
[3] 廖旭, 宋洋, 朱惠明. 应用食管气囊扩张法建立胃食管反流病动物模型研究[J]. 胃肠病学和肝病学杂志, 2009, 18(3): 257-260. DOI: 10.3969/j.issn.1006-5709.2009.03.024.
LIAO X, SONG Y, ZHU H M. Establishment of an animal model of gastroesophageal reflux disease using esophageal balloon dilatation [J]. Chin J Gastroenterol Hepatol, 2009, 18(3): 257-260. DOI: 10.3969/j.issn.1006-5709.2009.03.024.
[4] 王斌, 张伟, 仇明, 等. 应用Forley导尿管建立兔反流性食管炎模型[J]. 第二军医大学学报, 2015, 36(7): 741-746. DOI: 10.3724/SP.J.1008.2015.00741.
WANG B, ZHANG W, QIU M, et al. Balloon dilatation of Forley catheter in establishing a reflux esophagitis model [J]. Academic Journal of Second Military Medical University, 2015, 36(7): 741-746. DOI: 10.3724/SP.J.1008.2015.00741.
[5] 许树长, 戴军, 胡运彪, 等. 实验性酸性反流性食管炎动物模型制备的研究[J]. 中华消化杂志, 1999, 19(3): 208-209. DOI: 10.3760/j.issn:0254-1432.1999.03.026.
[6] 于强, 袁红霞, 崔乃强. 酸性反流性食管炎大鼠模型的改良制备[J]. 中国中西医结合消化杂志, 2002, 10(2): 74-75, 78. DOI: 10.3969/j.issn.1671-038X.2002.02.003.
YU Q, YUAN H X, CUI N Q. Improved technique for the rat model of acidic reflux esophagitis [J]. Chinese Journal of Integrated Traditional and Western Medicine on Digestion, 2002, 10(2): 74-75, 78. DOI: 10.3969/j.issn.1671-038X.2002.02.003.
[7] 唐艳萍, 弓艳霞, 李淑红, 等. 复方白及糊对反流性食管炎模型大鼠食管黏膜的影响[J]. 中医杂志, 2011, 52(15): 1312-1315, 1321. DOI: 10.13288/j.11-2166/r.2011.15.036.
TANG Y P, GONG Y X, LI S H, et al. Influence of compound hyacinth bletilla paste on the esophageal mucosa of acidic reflux esophagitis model rats [J]. Journal of Traditional Chinese Medicine, 2011, 52(15): 1312-1315, 1321. DOI: 10.13288/j.11-2166/r.2011.15.036.
[8] 郑朝旭, 林伟斌, 余俊峰, 等. 反流性食管炎大鼠模型的制备:不同管径内支架支撑幽门及前胃结扎[J]. 中国组织工程研究与临床康复, 2010, 14(20): 3705-3708. DOI: 10.3969/j.issn.1673-8225.2010.20.022.
ZHENG C X, LIN W B, YU J F, et al. Preparation of reflux esophagitis rat models: partial pylorus ligation plus forestomach ligation with different diameters of stents [J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2010, 14(20): 3705-3708. DOI: 10.3969/j.issn.1673-8225.2010.20.022.
[9] 张娇, 程正义, 唐旭东, 等. 反流性食管炎混合反流病证结合大鼠模型的建立与评价[J]. 中华中医药杂志, 2017, 32(3): 1021-1025. DOI: 10.3969/j.issn.1673-1727.2017.03.036.
ZHANG J, CHENG Z Y, TANG X D, et al. Establishment and evaluation of a combination rat model of disease and syndrome of reflux esophagitis combined with reflux disease [J]. CJTCMP, 2017, 32(3): 1021-1025. DOI: 10.3969/j.issn.1673-1727.2017.03.036.

