5 种梅干菜的酚类化合物及抗氧化能力比较分析
沈 清,楼乐燕,尹 培,黄 睿,叶兴乾,陈健初*
(浙江大学生物系统工程与食品科学学院,馥莉食品研究院,浙江省农产品加工技术研究重点实验室,浙江省食品加工技术与装备工程中心,浙江 杭州 310058)
梅干菜是一种中国南方传统的发酵腌制蔬菜,在长江三角洲地区尤为常见[1]。梅干菜通常选用九头芥菜(Brassic juncea Coss.)经家庭手工制作而成,其制作方法在Huang Shirong等[2]的文献中有报道,主要包括腌制和干制2 个关键加工工艺。梅干菜具有独特的风味,通常作为食品辅料与猪肉、鸡肉、鱼和豆角等一同烹制成美味可口的菜肴。其中,梅干菜扣肉是一道著名而美味的中国传统菜肴,享誉国内外。
有研究报道,梅干菜中富含酚类物质,具有较强的抗氧化能力[2],还具有一定的抑菌能力[3]。王超等[4]利用高效液相色谱分析出了九头芥梅干菜乙醇提取物及其石油醚、乙酸乙酯萃取物和萃余相中主要的酚类化合物为没食子酸。Li Chang等[1]研究表明梅干菜提取物作为一种天然抗氧化剂能够延长菜籽油和花生油的货架期。黄师荣等[5-6]研究了梅干菜提取物对猪肉和草莓具有一定的保鲜作用。
随着消费需求的增加,工业技术的发展,梅干菜逐渐开始从家庭手工业向工业化生产发展,目前,市面上已有梅干菜品牌问世,如浙江绍兴咸亨食品有限公司生产的咸亨牌梅干菜,浙江丽水缙云县全优食品有限公司生产的咕咕鲜牌梅干菜等。市售梅干菜产品的品质参差不齐,其含有对食品本身和人体健康有益作用的抗氧化物质含量和抗氧化能力也不尽相同,本研究旨在分析比较市售5 种梅干菜的酚类化合物含量和抗氧化能力,并用高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)法进一步鉴定梅干菜酚类化合物的种类,以期为消费者选择高品质的梅干菜产品和梅干菜有效成分的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
咸亨牌九头芥梅干菜(简写为XH) 浙江绍兴咸亨食品有限公司;咕咕鲜牌九头芥梅干菜(简写为GGX)浙江丽水缙云县全优食品有限公司;九头芥梅干菜(简写为GHW) 浙江杭州冠华王食品有限公司;农家自产九头芥梅干菜A(简写为JTA) 浙江杭州临安北站农贸城;农家自产九头芥梅干菜B(简写为JTB)浙江杭州三墩农贸市场。梅干菜样品如图1所示。

图1 5 种梅干菜样品Fig.1 Samples of fi ve pickled and dried mustard brands
没食子酸、芦丁、黑芥子苷、水溶性VE(Trolox)标准品 美国Sigma公司;甲酸、甲醇、乙腈(均为色谱纯) 上海阿拉丁生化科技股份有限公司;福林-酚试剂 国药集团化学试剂有限公司;总抗氧化能力检测试剂盒 上海碧云天生物技术有限公司;其余化学试剂均为国产分析纯。
1.2 仪器与设备
FW135型中草药粉碎机 天津泰斯特仪器有限公司;HH-10数显恒温搅拌水浴锅 金坛市科杰仪器厂;UV-2550紫外分光光度计 日本岛津公司;MB100-2A微孔板恒温振荡器 北京佳源兴业科技有限公司;1510全波长酶标仪、Fluoroskan Ascent荧光酶标仪 美国Thermo Fisher公司;UPLC-Triple-TOF/MS系统:AcquityTMultra型HPLC仪 美国Waters公司;Triple TOF 5600+型飞行时间质谱(配有电喷雾离子源)美国AB SCIEX公司。
1.3 方法
1.3.1 梅干菜乙醇提取物的制备和提取
分别取100 g 5 种梅干菜样品于60 ℃烘箱中烘干,粉碎后过40 目筛子,筛下物混匀后置于-80 ℃冰箱密封保存,备用。梅干菜提取物的制备参考Huang Shirong等[2]的方法,并稍作修改。取1 g粉末样品于50 mL离心管内,加入70%乙醇溶液15 mL,45 ℃水浴振荡提取2 h,然后5 000 r/min离心10 min,收集上清液。此过程重复3 次。合并3 次上清液用70%乙醇溶液定容至50 mL。提取液贮存在-80 ℃冰箱中,用于酚类化合物分析和抗氧化能力评价。
取1 mL提取液于干燥恒质量的玻璃试管中,用氮吹仪在45 ℃条件下吹干,根据玻璃试管氮吹前后质量差与1 mL提取液相当于梅干菜粉末质量的比值计算提取率。
1.3.2 总酚含量的测定
采用福林-酚法[7],并稍作修改。取400 μL梅干菜提取液与1 mL福林-酚试剂发生氧化反应,并用蒸馏水稀释到2 mL。此混合体系在常温暗室中保持5 min,随后加入5 mL的5%碳酸钠溶液,加蒸馏水至14 mL,混合后室温条件下静置1 h,于波长765 nm处测吸光度,用没食子酸为当量制作标准曲线,根据标准曲线计算,总酚含量用每克样品干质量含有的没食子酸当量(gallic acid equivalent,GAE)表示为mg GAE/g。
1.3.3 总黄酮含量的测定
参照Jia Zhishen[8]和Kim[9]等的方法,并稍作修改。取1 mL梅干菜提取液置于10 mL试管中,加70%乙醇溶液4 mL,再加5% NaNO3溶液0.3 mL,摇匀后静置5 min;然后加入10% Al(NO3)3溶液0.3 mL,摇匀后静置6 min;加入1 mol/L NaOH溶液4 mL,最后加入70%乙醇溶液至10 mL,摇匀后放置10 min,于波长510 nm处测定吸光度,用芦丁为当量制作标准曲线,根据标准曲线算出样品的总黄酮当量,总黄酮含量用每克样品干质量含有的芦丁当量(rutin equivalent,RE)表示为mg RE/g。
1.3.4 总硫代葡萄糖苷含量的测定
参照Thies[10]氯化钯比色法,并稍作修改。准确称取粉末样品100 mg于15 mL离心管中,在沸水中干蒸10 min,再加入煮沸的蒸馏水8 mL,再在沸水浴中蒸煮20 min,取出冷却静置,取上层清液0.5 mL于5 mL离心管中,然后加入0.1%羧甲基纤维素钠溶液2 mL,充分摇匀,加入4 mmol/L PdCl2显色溶液1 mL,盖上盖子,再充分摇匀后放置1 h,用分光光度计在波长540 nm处测定吸光度。同时取0.5 mL上清液于5 mL离心管中,再加入3 mL蒸馏水,此溶液作为阴性对照,以排除样品本身颜色的干扰。用黑芥子苷制作标准曲线,根据标准曲线算出样品的总硫代葡萄糖苷(以下简称总硫苷)含量,总硫苷含量用每克样品干质量含有的黑芥子苷当量(sinigrin equivalent,SE)表示为mg SE/g。
1.3.5 HPLC-MS/MS分析梅干菜提取液中的酚类化合物
1.3.5.1 样品前处理
取1 mL梅干菜提取液过0.22 μm微孔滤膜,转移至进样小瓶,上机测定。
1.3.5.2 HPLC条件
ZORBAX-SB C18色谱柱(100 mm×4.6 mm,1.8 µm);流动相A为0.1%甲酸溶液,流动相B为0.1%甲酸-乙腈溶液;梯度洗脱程序:流动相初始5% B,保持2 min,在25 min时升至50% B,之后10 min内升至95% B,保持2 min,最后3 min内降低到5% B;流速为0.8 mL/min;检测波长为280 nm;柱温箱温度为30 ℃;进样量为5 μL。
1.3.5.3 MS/MS条件
采用UPLC-Triple-TOF 5600+飞行时间LC-MS联用仪,负离子扫描模式;质量扫描范围为m/z 100~1 500;雾化气(GS1)压力为50 psi;雾化气(GS2)压力为50 psi;气帘气压力为35 psi;离子源温度为550 ℃;离子源电压为-4 500 V。
一级扫描:去簇电压为100 V;聚焦电压为10 V;二级扫描:使用TOF MS~Product Ion~IDA模式采集质谱数据,碰撞诱导解离能量分别为20、40 V和60 V,进样前,用自动校准化合物系统做质量轴校正,使质量轴误差小于2×10-6。
得到的质谱图利用质谱软件PeakView 1.2.0.3 workstation(ABSCIEX, Framingham, MS, USA)进行分析。
1.3.6 梅干菜抗氧化能力评价
1.3.6.1 铁离子还原(ferric reducing antioxidant power,FRAP)法
FRAP法测定总抗氧化能力的原理为酸性条件下抗氧化物可以还原Fe3+-TPTZ产生蓝色的Fe2+-TPTZ,随后在波长593 nm处测定蓝色的Fe2+-TPTZ即可获得样品的总抗氧化能力。用总抗氧化能力检测试剂盒(FRAP法)检测样品的总抗氧化能力,在96 孔板内先加入180 μL FRAP工作液,再加入5 μL样品或各浓度Trolox标准溶液,轻轻混匀,37 ℃孵育3~5 min后测定A593nm,根据标准曲线计算出样品的总抗氧化能力,结果用微摩尔Trolox当量(Trolox equivalent,TE)每克样品干质量表示为μmol TE/g。
1.3.6.2 1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2-picrylhydrazyl,DPPH)法
采用Bao Jinsong等[7]的方法并稍作修改。在96 孔板内加入200 μL的DPPH溶液(0.1 mmol/L,溶于70%乙醇溶液中),再加入20 μL样品或各浓度Trolox标准溶液,轻轻混匀,室温避光反应30 min后测定A517nm,根据标准曲线计算出样品的总抗氧化能力,结果用微摩尔TE每克样品干质量表示为μmol TE/g。
1.3.6.3 2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzthiazoline-6-sulphonate),ABTS)法
ABTS法测定总抗氧化能力的原理为ABTS在适当的氧化剂作用下氧化成绿色的ABTS+·,在抗氧化物存在时ABTS+·的产生会被抑制,在波长414 nm或734 nm处测定ABTS+·的吸光度即可测定并计算样品的总抗氧化能力。用总抗氧化能力检测试剂盒(ABTS快速法)检测样品的总抗氧化能力,在96 孔板内先加入20 μL过氧化物酶工作液,再加入10 μL样品或各浓度Trolox标准溶液,最后加入170 μL ABTS工作液,轻轻混匀,室温孵育6 min后测定A414nm,根据标准曲线计算出样品的总抗氧化能力,结果用微摩尔TE每克样品干质量表示为μmol TE/g。
1.3.6.4 氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)法
采用Huang Haizhi等[11]的方法并稍作修改。在96 孔板(黑)内加入25 μL的样品或各浓度Trolox标准溶液,再加入25 μL的荧光素钠溶液(504 nmol/L,溶于pH 7.4的磷酸缓冲液中),在37 ℃条件下振荡孵育5 min,加入150 μL的2,2’-偶氮二(2-甲基丙基咪)二盐酸盐溶液(17.07 mmol/L溶于pH 7.4的磷酸缓冲液中)启动反应,轻轻混匀后放入荧光酶标仪中检测,激发波长485 nm,发射波长538 nm,每2 min测定1 次,连续测定120 min,积分荧光衰减曲线下的面积,根据标准曲线计算出样品的总抗氧化能力,结果用微摩尔TE每克样品干质量示为μmol TE/g 。
1.4 数据统计与分析
实验每个样品设3 个平行,采用Excel 2010软件和SPSS 20.0软件进行数据分析,测定结果以 ±s表示。实验数据采用ANOVA进行Duncan’s差异分析,以P值小于0.05表示差异显著。
2 结果与分析
2.1 梅干菜酚类物质提取率测定结果
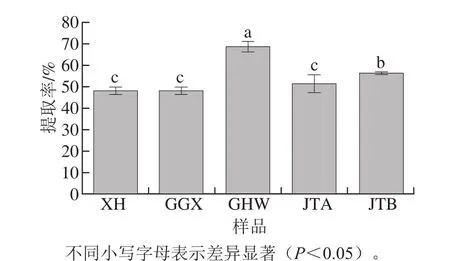
图2 5 种梅干菜酚类物质提取率Fig.2 Extraction yields of phenolics from fi ve pickled and dried mustard brands
溶剂提取法是植物多酚常用的提取方法[12],本实验采用Huang Shirong等[2]的方法,70%乙醇溶液为溶剂对梅干菜的酚类物质进行提取,5 种梅干菜的提取率见图2。结果显示5 种梅干菜的提取率均可以达到48%以上,其中GHW的提取率最大,为68.67%,其次为JTB的提取率56.33%。其余3 种梅干菜XH、GGX和JTA的提取率无显著性差异,均在50%左右。本实验所得梅干菜提取率均高于Huang Shirong等[2]用70%乙醇溶液所得提取率(40.57%),原因一方面可能是由梅干菜样品不同引起的,由本实验可知不同生产商所加工制得的梅干菜提取率有差异;另一方面可能是本实验所采用的提取方法有所改进,如料液比增加、提取次数增加等。提取率的提高有利于后续对样品中含有的多酚类化合物进行分析。
2.2 梅干菜的总酚、总黄酮和总硫苷测定结果

表1 5 种梅干菜的总酚、总黄酮和总硫苷含量Table1 Contents of total phenolics, total fl avonoids and total glucosinolates in fi ve pickled and dried mustard brands
由表1可知,5 种梅干菜的总酚和总黄酮含量存在差异,并且梅干菜中的总黄酮含量约是其总酚含量的一半。其中,GGX的总酚和总黄酮含量最高,其次为GHW,较低的是JTA和JTB,两者无显著性差异。而XH的总酚含量也较低,与JTA或JTB无显著性差异;XH的总黄酮含量显著低于GGX(P<0.05),与GHW相当(P>0.05)。本实验测得梅干菜总酚含量与王萍等[13]测定的不同基因型叶用芥菜在不同采收季节总酚含量一致(6.51~14.87 mg GAE/g);梅干菜总黄酮含量与Park等[14]测定的叶用芥菜在不同发酵时期不同溶剂提取的总黄酮含量相当。
梅干菜一般用芥菜加工制作而成[1,15],属十字花科芸薹属。硫代葡萄糖苷是植物体内一种次级代谢产物,广泛存在于十字花科植物中[16]。大量实验研究表明硫代葡萄糖苷具有抗氧化、抑菌和抗癌等生物活性[17-19]。因此本实验测定5 种梅干菜的总硫苷含量。如表1所示,5 种梅干菜的总硫苷含量存在差异,其中总硫苷含量最高的是GGX,其次为GHW和JTA,较低的是XH和JTB。本实验测得的梅干菜总硫苷含量(7.69~13.83 mg SE/g,相当于19.34~34.81 μmol/g)高于Aguilo-Aguayo等[20](5.13 μmol/g)、Song Lijiang等[21](0.1~0.6 μmol/g)和Rudi等[22](<3.9 mg/g)测定的芸薹属植物中的总硫苷含量,但与涂宗财等[23]测定的芥菜中总硫苷含量水平相当(23.31 μmol/g)。本实验测定的梅干菜总硫苷含量偏高。因为梅干菜是一种经过腌制和晒干等多种加工过程的芥菜,而在植物加工贮藏过程中,由于细胞完整性遭到破坏使得硫苷和芥子酶接触会造成硫苷损失[18,21-22,24],理论上梅干菜所含的硫苷含量应该显著低于新鲜芥菜等。而本实验采用氯化钯显色法测定总硫苷含量时,由于梅干菜提取物本身为较深的黄棕色,对显色结果造成偏大的影响。因此后续实验若要更准确研究测定梅干菜中的硫代葡萄糖苷含量可以采取HPLC-MS等检测手段[25]。
2.3 HPLC-MS/MS分析梅干菜提取液中的酚类化合物

表2 HPLC-MS/MS鉴定梅干菜中的酚类化合物种类Table2 HPLC-MS/MS pro fi les of phenolic compound in pickled and dried mustard brands
为研究梅干菜中酚类化合物的种类和含量,本实验采用HPLC-MS/MS对5 种梅干菜的酚类化合物进行鉴定,酚类物质的鉴定通过与标准品(或相关文献报道)的总离子流色谱图的母离子峰、二级质谱的碎片和保留时间等质谱行为进行比较分析。从梅干菜中一共分析出17 种酚类化合物,包括9 种类黄酮和8 种酚酸,如表2所示。有文献报道,芸薹属中类黄酮物质主要为槲皮素、山柰酚和异鼠李素[26],在本实验中均检测出。胡玉霞[27]测得雪里蕻的酚酸有没食子酸、原儿茶酸、对羟基苯甲酸、香草酸、咖啡酸、香豆酸、阿魏酸和芥子酸8 种,但是没食子酸和香草酸在本实验中未检测出。
由于购买所有酚类化合物标准品和利用HPLC-MS/MS检测费用昂贵,为了节约成本,本实验用上述分析出的每种化合物占所有17 种化合物峰面积的百分比来表示其相对含量,以此来分析比较5 种梅干菜所含酚类化合物的情况。由表3可知,5 种梅干菜所含的类黄酮和酚酸相对含量有差异。其中,GGX总类黄酮相对含量小于50%,其余4 种梅干菜总类黄酮相对含量均大于50%,JTA的总类黄酮含量最高,高达76.72%,JTB、XH和GHW总类黄酮相对含量依次递减,且5 种梅干菜的总类黄酮相对含量有显著性差异,而5 种梅干菜总酚酸相对含量高低正好与总类黄酮相对含量相反。关于5 种梅干菜的类黄酮,JTA和JTB中含有超过25%的野漆树苷,XH约含25%的山柰酚,GHW和JTA含25%左右的异鼠李素,说明梅干菜的类黄酮主要有野漆树苷、山柰酚和异鼠李素等,但是在不同梅干菜中相对含量差异显著。GGX含有12.05%柚皮素,GHW含有6.25%柚皮素,认为柚皮素也是梅干菜类黄酮中相对含量较多的物质。而被认为叶用芥菜中主要的类黄酮物质槲皮素在5 种梅干菜中相对含量均不高(0.71%~5.07%)。关于5 种梅干菜的酚酸,相对含量最高的是阿魏酸,GGX和GHW含25%左右,JTA相对含量最低为13.02%。5 种梅干菜的对香豆酸(2.45%~9.51%)和肉桂酸(2.11%~7.88%)相对含量也较高。芥子酸在GHW梅干菜中相对含量也较高,占3.86%。说明梅干菜的酚酸类主要有阿魏酸、对香豆酸、肉桂酸和芥子酸等,但是在不同梅干菜中含量差异显著。
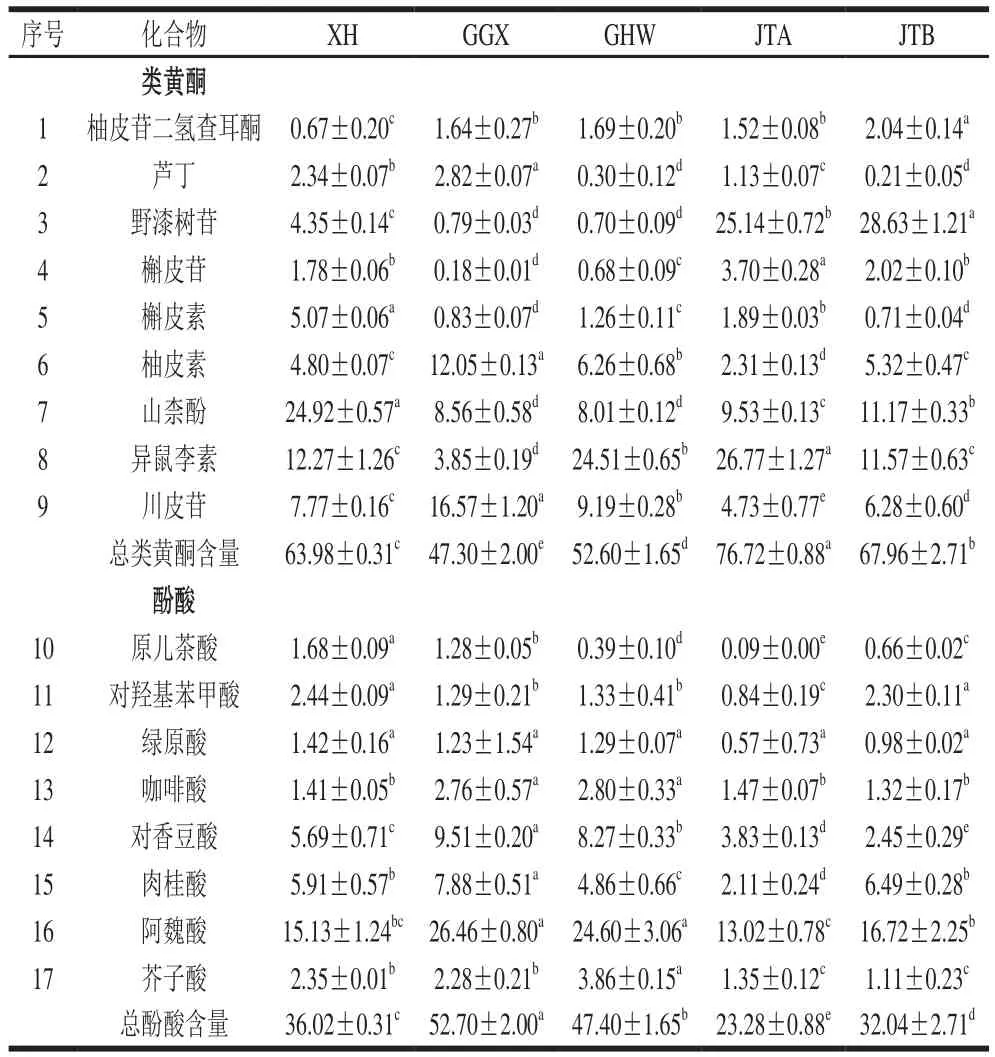
表3 HPLC-MS/MS分析5 种梅干菜的酚类化合物相对含量Table3 Contents of phenolic compounds determined by HPLC-MS/MS in fi ve pickled and dried mustard brands%
2.4 梅干菜的抗氧化能力评价
ABTS、FRAP、DPPH和ORAC法是评价抗氧化剂的抗氧化能力常用的化学方法,它们的作用机理各不相同且各具优缺点,目前国内外还没有统一的标准[28-29]。因此,本实验同时用这4 种方法来评价梅干菜的抗氧化能力,结果如图3所示。4 种方法所得的结果均表明GGX的抗氧化能力最强,其次为GHW,而XH和JTA抗氧化能力相当,显著低于GHW而高于JTB(P<0.05)。但是,这4 种方法所测得的梅干菜抗氧化能力在数值上有一定区别。以GGX为例,ABTS、FRAP、DPPH和ORAC法测得的抗氧化能力分别为28.09、32.88、31.72 μmol TE/g和445.55 μmol TE/g。结果表明,ORAC法测得的数值是其余3 种方法测得的10 倍以上,而FRAP法和DPPH法相当,数值最小的是ABTS法。其余4 种梅干菜均与GGX结果一致。本实验用ABTS法测定的GGX梅干菜抗氧化能力数值上与王萍等[30]测得的腌制雪里蕻样品一致(28 μmol TE/g),其余4 种梅干菜均较低。Todorovic等[31]也分析比较了这4 种方法检测同一种食物的抗氧化能力,结果也显示4 种方法测得的数据差异显著,且ORAC法最高,这可能是因为ORAC法较其他3 种方法具有高灵敏度的优点。
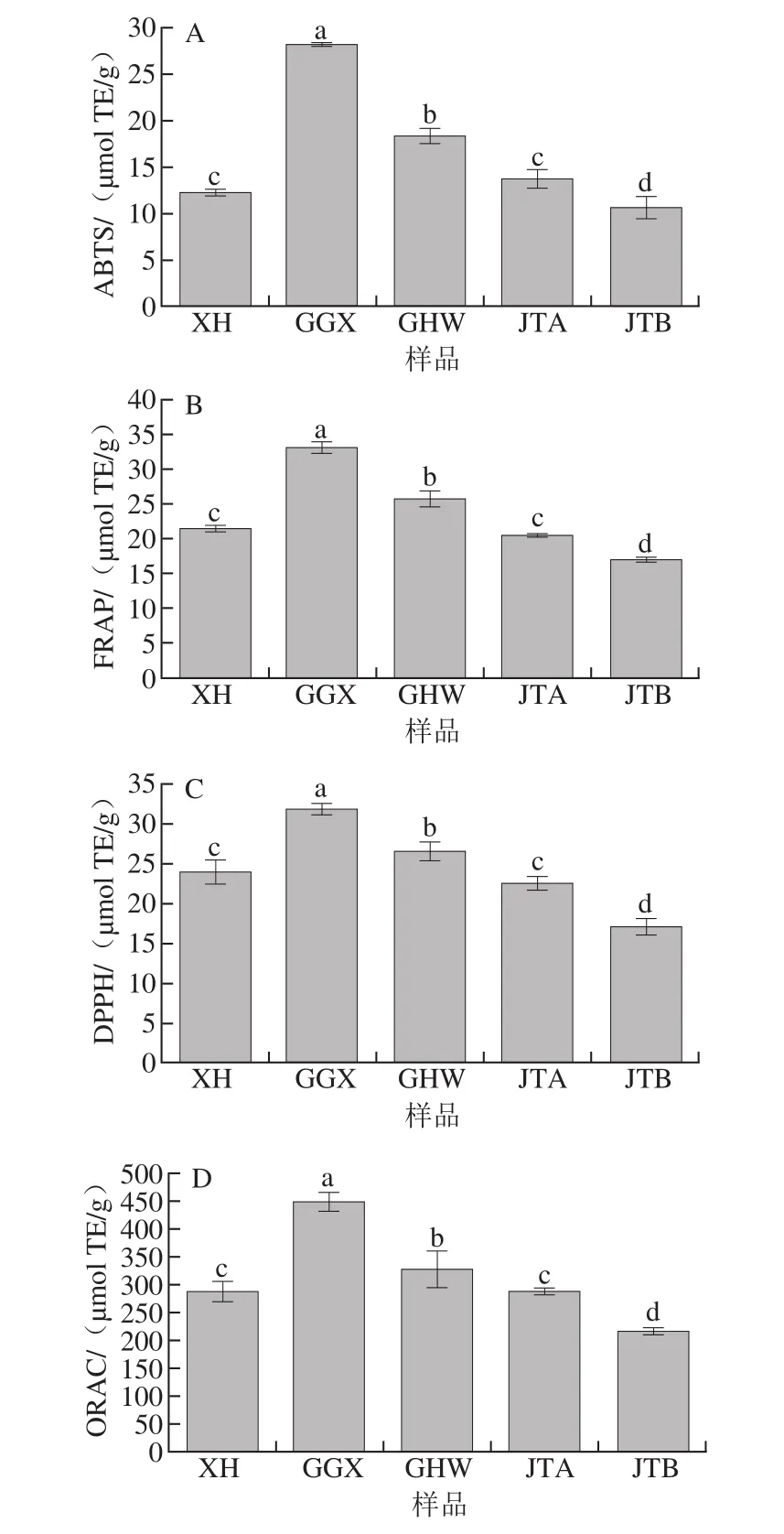
图 3 ABTS(A)、FRAP(B)、DPPH(C)和ORAC(D)法测定5 种梅干菜的抗氧化能力Fig.3 Antioxidant activities determined by ABTS (A), FRAP (B),DPPH (C) and ORAC (D) assays of fi ve pickled and dried mustard brands
2.5 梅干菜的抗氧化剂与抗氧化能力相关性分析
比较总酚、总黄酮、总硫苷、ABTS、FRAP、DPPH和ORAC值可以评估梅干菜中含有的这3 种抗氧化剂和4 种抗氧化能力方法之间的相关性。如表4所示,梅干菜的3 种抗氧化剂和4 种抗氧化能力方法在数值上两两之间显著相关,但是相关系数有差异。其中,总酚和总硫苷与ABTS有最高的相关性,相关系数分别为0.957(P<0.01)和0.963(P<0.01),而与DPPH的相关性最低,相关系数分别为0.818(P<0.01)和0.828(P<0.01)。而总黄酮与FRAP有最高的相关性,相关系数为0.950(P<0.01),与DPPH的相关性也是最低,相关系数为0.904(P<0.01)。综合4 种抗氧化能力评价方法,可以看出类黄酮物质是梅干菜中主要的抗氧化剂,这与一些芥菜的研究报道一致[32-33]。关于3 种抗氧化剂,总酚和总黄酮相关性较高(0.934,P<0.01),原因为本实验采用的福林-酚法测得的总酚包括类黄酮物质,因此两者具有较高的相关性。总硫苷与总酚相关性较高(0.941,P<0.01),与总黄酮相关性很低(0.852,P<0.01)。关于4 种抗氧化能力评价方法,ABTS与FRAP相关性最高(0.967,P<0.01),这与Thaipong等[34]的研究报道一致(0.97)。ABTS与DPPH相关性最低(0.904),但FRAP和DPPH有相对较高的相关性(0.958)。而有研究[35]表明ABTS和DPPH的相关系性较高(0.949),但是ABTS比DPPH法更适合评价食品的抗氧化能力,这与本实验结果一致。ORAC与ABTS和FRAP的相关性一样,相关系数均是0.952,而与DPPH的相关性较低(0.937)。但是Huang Haizhi等[11]研究表明ABTS、FRAP和DPPH 3 种方法相关性较高(>0.97),原因是三者的原理相似,也就是单电子转移。
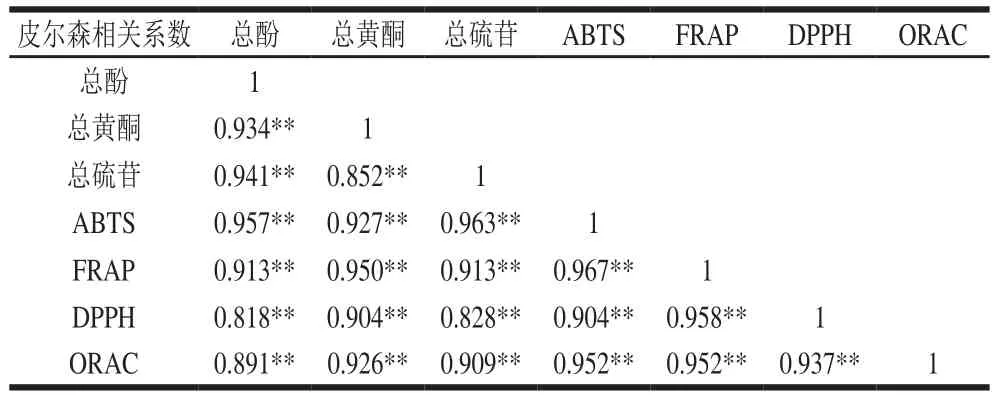
表4 梅干菜的抗氧化剂与抗氧化能力相关性Table4 Correlation coeff i cients among antioxidants and antioxidant capacity values
3 结 论
梅干菜中主要的抗氧化剂为酚类化合物。利用HPLC-MS/MS分析鉴定出梅干菜中共含有17种酚类化合物,包括9 种类黄酮和8 种酚酸。其中,梅干菜中的类黄酮主要有野漆树苷、山柰酚、异鼠李素、柚皮素等;酚酸主要有阿魏酸、香豆酸和肉桂酸等。市售5 种梅干菜所含的酚类化合物含量和各酚类化合物所占的比例及其抗氧化能力差异显著。其中,GGX的总酚含量最高,抗氧化能力最强;而JTB的总酚含量最少,抗氧化能力最弱。梅干菜的酚类化合物与抗氧化能力显著相关(P<0.01)。利用ABTS、FRAP、DPPH和ORAC 4 种抗氧化能力评价方法评价梅干菜,发现ABTS与FRAP相关性最高,相关系数为0.967;ORAC法测得的梅干菜抗氧化能力显著高于其他3 种方法;ABTS法与梅干菜的抗氧化剂相关性最高,最适合评价梅干菜的总抗氧化能力。后续实验可以致力于研究ORAC法测定梅干菜抗氧化能力显著高于其他方法的原因。
[1] LI C, TANG Z F, HUANG M, et al. Antioxidant efficacy of extracts produced from pickled and dried mustard in rapeseed and peanut oils[J]. Journal of Food Science, 2012, 77(4)∶ C394-C400.DOI∶10.1111/j.1750-3841.2011.02606.x.
[2] HUANG S R, HUANG M, FENG B. Antioxidant activity of extracts produced from pickled and dried mustard (Brassica juncea Coss. var.foliosa Bailey)[J]. International Journal of Food Properties, 2012,15(1/2)∶ 374-384. DOI∶10.1080/10942912.2010.487628.
[3] 黄师荣, 唐忠锋, 李庆斌. 梅干菜提取物抑菌作用的研究[J]. 食品工业科技, 2009, 30(8)∶ 106-107. DOI∶10.13386/j.issn1002-0306.2009.08.074.
[4] 王超, 汪江英, 时磊, 等. 九头芥梅干菜提取物的抗氧化性能研究[J]. 食品与机械, 2013, 29(3)∶ 116-119. DOI∶10.3969/j.issn.1003-5788.2013.03.028.
[5] 黄师荣, 李豪杰, 戴杰辉, 等. 九头芥梅干菜提取物抗菌活性及其在猪肉保鲜中的应用[J]. 现代食品科技, 2014, 30(10)∶ 58-62.DOI∶10.13982/j.mfst.1673-9078.2014.10.011.
[6] 黄师荣, 唐忠锋. 梅干菜提取物保鲜草莓的研究[J]. 安徽农业科学,2009, 37(26)∶ 12695-12696. DOI∶10.13989/j.cnki.0517-6611.2009.26.026.
[7] BAO J S, CAI Y Z, SUN M, et al. Anthocyanins, flavonols, and free radical scavenging activity of Chinese bayberry (Myrica rubra) extracts and their color properties and stability[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6)∶ 2327-2332.DOI∶10.1021/jf048312z.
[8] JIA Z S, TANG M, WU J. The determination of fl avonoid contents in mulberry and their scavenging effects on superoxide radicals[J]. Food Chemistry, 1999, 64(4)∶ 555-559. DOI∶10.1016/S0308-8146(98)00102-2.
[9] KIM D O, JEONG S W, CHANG Y L. Antioxidant capacity of phenolic phytochemicals from various cultivars of plums[J]. Food Chemistry, 2003, 81(3)∶ 321-326. DOI∶10.1016/S0308-8146(02)00423-5.
[10] THIES W. Complex-formation between glucosinolates and tetrachloropalladate (II) and its utilization in plant-breeding[J].Fette Seifen Anstrichmittel, 1982, 84(9)∶ 338-342. DOI∶10.1002/lipi.19820840903.
[11] HUANG H Z, SUN Y J, LOU S T, et al. In vitro digestion combined with cellular assay to determine the antioxidant activity in Chinese bayberry (Myrica rubra Sieb. et Zucc.) fruits∶ a comparison with traditional methods[J]. Food Chemistry, 2014, 146∶ 363-370.DOI∶10.1016/j.foodchem.2013.09.071.
[12] AMEER K, SHAHBAZ H M, KWON J H. Green extraction methods for polyphenols from plant matrices and their byproducts∶ a review[J].Comprehensive Reviews in Food Science and Food Safety, 2017,16(2)∶ 295-315. DOI∶10.1111/1541-4337.12253.
[13] 王萍, 朱祝军. 不同采收季节对叶用芥菜类黄酮物质含量和抗氧化活性的影响[J]. 园艺学报, 2006, 33(4)∶ 745-750. DOI∶10.3321/j.issn∶0513-353X.2006.04.010.
[14] PARK S Y, JANG H L, LEE J H, et al. Changes in the phenolic compounds and antioxidant activities of mustard leaf (Brassica juncea)kimchi extracts during different fermentation periods[J]. Food Science &Biotechnology, 2017, 26(1)∶ 105-112. DOI∶10.1007/s10068-017-0014-5.
[15] 徐专红. 梅干菜肉的制作和贮藏性能初探[J]. 食品工业科技,1996(6)∶ 64-65. DOI∶10.13386/j.issn1002-0306.1996.06.022.
[16] KORUS A, SLUPSKI J, GEBCZYNSKI P, et al. Effect of preliminary processing and method of preservation on the content of glucosinolates in kale (Brassica oleracea L. var. acephala) leaves[J]. LWT-Food Science and Technology, 2014, 59(2)∶ 1003-1008. DOI∶10.1016/j.lwt.2014.06.030.
[17] MITHEN R F, DEKKER M, VERKERK R, et al. The nutritional significance, biosynthesis and bioavailability of glucosinolates in human foods[J]. Journal of the Science of Food &Agriculture, 2000, 80(7)∶ 967-984. DOI∶10.1002/(SICI)1097-0010(20000515)80∶7<967∶∶AID-JSFA597>3.0.CO;2-V.
[18] NUGRAHEDI P Y, VERKERK R, WIDIANARKO B, et al. A mechanistic perspective on process-induced changes in glucosinolate content in Brassica vegetables∶ a review[J]. Critical Reviews in Food Science and Nutrition, 2015,55(6)∶ 823-838. DOI∶10.1080/10408398.2012.688076.
[19] 宋亚, 李凯利, 方佳宁, 等. 鲜切紫甘蓝中花青苷和硫代葡萄糖苷在贮藏过程中的变化[J]. 食品科学, 2016, 37(18)∶ 96-101.DOI∶10.7506/spkx1002-6630-201618016.
[20] AGUILO-AGUAYO I, SUAREZ M, PLAZA L, et al. Optimization of pulsed electric field pre-treatments to enhance health-promoting glucosinolates in broccoli fl owers and stalk[J]. Journal of the Science of Food and Agriculture, 2015, 95(9)∶ 1868-1875. DOI∶10.1002/jsfa.6891.
[21] SONG L, THORNALLEY P J. Effect of storage, processing and cooking on glucosinolate content of Brassica vegetables[J]. Food & Chemical Toxicology, 2007, 45(2)∶ 216-224. DOI∶10.1016/j.fct.2006.07.021.
[22] RUDI DE V H, BLIJLEVEN W G. The effect of processing conditions on glucosinolates in cruciferous vegetables[J]. European Food Research and Technology, 1988, 187(6)∶ 525-529. DOI∶10.1007/BF01042383.
[23] 涂宗财, 郭逍遥, 刘成梅, 等. 芥菜中硫代葡萄糖苷提取工艺条件的优化[J]. 食品与生物技术学报, 2007, 26(6)∶ 9-12. DOI∶10.3321/j.issn∶1673-1689.2007.06.003.
[24] BANERJEE A, VARIYAR P S, CHATTERJEE S, et al. Effect of post harvest radiation processing and storage on the volatile oil composition and glucosinolate prof i le of cabbage[J]. Food Chemistry, 2014, 151∶22-30. DOI∶10.1016/j.foodchem.2013.11.055.
[25] FRANCO P, SPINOZZI S, PAGNOTTA E, et al. Development of a liquid chromatography-electrospray ionization-tandem mass spectrometry method for the simultaneous analysis of intact glucosinolates and isothiocyanates in Brassicaceae seeds and functional foods[J]. Journal of Chromatography A, 2016, 1428∶ 154-161. DOI∶10.1016/j.chroma.2015.09.001.
[26] CARTEA M E, FRANCISCO M, SOENGAS P, et al. Phenolic compounds in Brassica vegetables[J]. Molecules, 2011, 16(1)∶ 251-280. DOI∶10.3390/molecules16010251.
[27] 胡玉霞. 雪里蕻腌渍过程中理化成分及其抗氧化性变化研究[D]. 杭州∶ 浙江大学, 2007.
[28] LOPEZ-ALARCON C, DENICOLA A. Evaluating the antioxidant capacity of natural products∶ a review on chemical and cellular-based assays[J].Analytica Chimica Acta, 2013, 763∶ 1-10. DOI∶10.1016/j.aca.2012.11.051.
[29] PINCHUK I, SHOVAL H, DOTAN Y, et al. Evaluation of antioxidants∶scope, limitations and relevance of assays[J]. Chemistry and Physics of Lipids, 2012, 165(6)∶ 638-647. DOI∶10.1016/j.chemphyslip.2012.05.003.
[30] 王萍, 朱祝军. 腌制加工对不同品种叶用芥菜抗氧化物质含量和抗氧化活性的影响[J]. 核农学报, 2006, 20(6)∶ 516-520. DOI∶10.3969/j.issn.1000-8551.2006.06.017.
[31] TODOROVIC V, REDOVNIKOVIC I R, TODOROVIC Z, et al.Polyphenols, methylxanthines, and antioxidant capacity of chocolates produced in Serbia[J]. Journal of Food Composition and Analysis,2015, 41∶ 137-143. DOI∶10.1016/j.jfca.2015.01.018.
[32] BAHORUN T, LUXIMON-RAMMA A, CROZIER A, et al. Total phenol, fl avonoid, proanthocyanidin and vitamin C levels and antioxidant activities of Mauritian vegetables[J]. Journal of the Science of Food &Agriculture, 2004, 84(12)∶ 1553-1561. DOI∶10.1002/jsfa.1820.
[33] GONZALEZ E M, ANCOS D B, CANO P M. Relation between bioactive compounds and free radical-scavenging capacity in berry fruits during frozen storage[J]. Journal of the Science of Food &Agriculture, 2003, 83(7)∶ 722-726. DOI∶10.1002/jsfa.1359.
[34] THAIPONG K, BOONPRAKOB U, CROSBY K, et al. Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts[J]. Journal of Food Composition &Analysis, 2006, 19(7)∶ 669-675. DOI∶10.1016/j.jfca.2006.01.003.
[35] FLOEGEL A, KIM D O, CHUNG S J, et al. Comparison of ABTS/DPPH assays to measure antioxidant capacity in popular antioxidantrich US foods[J]. Journal of Food Composition & Analysis, 2011,24(7)∶ 1043-1048. DOI∶10.1016/j.jfca.2011.01.008.

