大豆分离蛋白与花青素非共价及共价作用对蛋白构象变化的影响
孙红波,李 杨,王立敏,董济萱,隋晓楠,齐宝坤,王中江,江连洲*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
大豆蛋白作为一种高营养高吸收率的全价植物蛋白,是我国居民日常膳食中优质蛋白质的重要来源之一[1-2],但天然蛋白质难以满足食品加工时的不同种需求。为拓宽其市场应用,人们通过修饰大豆蛋白的结构,提高蛋白质的功能特性和生物活性。目前,蛋白质的改性技术主要集中在物理改性和化学改性,如何找到一种健康营养的天然改性技术一直是人们研究的重点[3]。事实上,生物小分子常与蛋白质发生相互作用,并影响着蛋白质的结构与功能特性。花青素作为一种多酚类小分子物质,是膳食中重要的营养成分,有助于预防心脑血管疾病和神经系统问题等疾病,具有较高的蛋白亲合力,并能够改善食品中的风味和质地[4-5]。
现今部分文献研究表明蛋白质和多酚类物质之间可通过非共价结合/共价交联发生相互作用,其中,对多酚-蛋白质非共价作用的研究主要集中在:大豆蛋白与槲皮素[6]、乳蛋白与天竺葵素[7]、牛奶蛋白与白藜芦醇[8]、花青素与牛血红蛋白[9]等。在共价相互作用中,多酚通常在碱性溶液中被氧化成醌,随后与蛋白质中巯基或氨基基团结合发生不可逆的相互作用[10]。Jia Zhenbao等[11]分析了在碱性条件下,表没食子儿茶素-3-没食子酸经共价修饰乳清分离蛋白,引起了蛋白的构象和物化性质变化。Prodpran等[12]研究了几种酚类化合物与肌原纤维蛋白之间在pH值大于10时产生共价交联,复合物中所添加的酚类化合物可以增强成膜的机械性能。
目前,已有文献对多酚类物质与蛋白质相互作用体系进行了部分研究,但未能对比解析复合体系中共价及非共价作用对蛋白结构的变化规律,并且针对于大豆分离蛋白和花青素复合体系的研究尚属不足。因此,本实验重点研究不同质量浓度的花青素(0.05、0.1、0.2 g/100 mL)与大豆分离蛋白(1 g/100 mL)之间通过非共价/共价作用形成的复合体系,明确对比非共价结合/共价交联对大豆分离蛋白与花青素复合物之间的影响,详细解析互作体系的结构变化,以期为改性大豆分离蛋白在食品加工中的合理应用提供参考。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白 实验室自制;葵花油 市购;花青素黑米提取物 山西太极唐代科技有限公司;大豆哈尔滨高科技有限公司;花青素-3-葡萄糖苷标品 大连美仑生物技术有限公司;盐酸、氢氧化钠、磷酸二氢钠、磷酸氢二钠(均为分析纯) 北京新光化工试剂厂;正己烷、乙酸乙酯、甲醇(均为分析纯) 天津北科化学品有限责任公司;其他化学试剂均为分析纯。
1.2 仪器与设备
AL204型分析天平 梅勒特-托利多仪器(上海)有限公司;PHSJ-4A型实验室pH计 中国上海雷磁公司;F-4500荧光分光光度计 日本Hitachi公司;TU-1800紫外-可见分光光度计 北京普析通用仪器有限责任公司;JJ-1增力电动搅拌器 江苏金城国胜仪器厂;Allegra64R台式高速冷冻离心机 美国贝克曼公司;IRTracer-100傅里叶红外光谱 日本岛津公司;E2695高效液相色谱 沃特世科技(上海)有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳仪 东方电泳设备有限公司。
1.3 方法
1.3.1 大豆分离蛋白的制备
参考Wolf等[13]的制备方法,将新鲜大豆经破碎脱脂,与正己烷(1∶3)(g/mL)混合并离心脱油,所得脱脂豆粕以1∶10(g/mL)溶于去离子水中,用2 mol/L的NaOH溶液调节其pH值至8.5,经45 ℃搅拌2 h,将其悬浮液经9 500×g离心30 min,取其上清液用盐酸(2 mol/L)调节溶液pH值至4.5,经6 000×g 离心20 min得到蛋白沉淀物,将上述蛋白沉淀物水洗3 次后,经6 500×g离心30 min,用2 mol/L的NaOH溶液调节至中性即可,将此蛋白溶液冻干并研磨,即可获粉末状的大豆分离蛋白。
1.3.2 花青素的纯化与定量
根据Sui Xiaonan等[14]的方法对花青素进行纯化。首先将黑米提取物溶解在蒸馏水中除杂,将溶液流经固相萃取柱使花青素被完全吸附,洗脱吸附柱以去除糖类和其他多酚类化合物(如酚酸和黄酮)等物质,将酸化的甲醇溶液洗脱吸附柱得粗花青素溶液。将上述溶液经旋转蒸发器除去溶液中的甲醇,即可得到纯化的花青素提取物。利用高效液相色谱法测定花青素的含量[15],将纯化的花青素提取物经0.45 μm滤膜通过C18分析柱(250 mm×4.6 mm,5 μm)进行高效液相色谱系统分析,流量为1 mL/min,温度为25 ℃,梯度洗脱程序参考Sadilova等[16]的方法,测定其花青素含量为25%(为方便计算,本实验统一使用黑米中含量较多的矢车菊素-3-葡萄糖苷相对分子质量为花青素的相对分子质量近似处理)。
1.3.3 样品的配制
参考Nagy等[17]的方法稍作修改,将大豆分离蛋白粉末溶于磷酸盐缓冲液(10 μm,pH 7.4)中配制成质量浓度为1 g/100 mL的大豆分离蛋白溶液[18],将花青素(0.05、0.1、0.2 g/100 mL)按比例分别溶于此蛋白溶液中,室温条件下隔氧混合搅拌2 h,由此可得大豆分离蛋白-花青素非共价复合物。参考Jia Zhenbao等[11]的方法稍作修改,将大豆分离蛋白粉末溶于磷酸钠缓冲液(10 μm,pH 7.4)中配制成质量浓度为1 g/100 mL的大豆分离蛋白溶液,将花青素(0.05、0.1 、0.2 g/100 mL)按比例分别溶于此蛋白溶液中,用NaOH溶液(0.5 mol/L)调节pH值至9.0,室温条件下混合搅拌24 h,终止反应调节pH值至7.4。由此可得大豆分离蛋白-花青素共价复合物。其中,未经处理的大豆分离蛋白溶液作为空白对照,各样品处理条件及编号见表1。

表1 花青素与大豆分离蛋白复合物样品Table1 SPI-anthocyanins complexes
1.3.4 浊度测定
浊度分析参考Martini等[19]的方法稍作修改,将待测样品适当稀释后(样品蛋白质量浓度在5 mg/mL)倒入石英比色皿中,并利用紫外分光光度计在波长600 nm处对样品进行测定,在25 ℃条件下测量浊度值,每个样品平行测定3 次取平均值。
1.3.5 分子质量的测定
使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳测定样品的分子质量,根据Laemmli等[20]的方法稍作修改。制备10%分离胶、5%浓缩胶,上样质量浓度1 mg/mL,将样品与上样缓冲液在90 ℃条件下混合并加热5 min,在冷却后进行上样,其上样量为10 μL。电泳过程中维持80 V恒压直至样品跑至分离胶时改为120 V,电泳过程结束后用生物染色剂(考马斯亮蓝R-250)对凝胶进行染色随后洗脱,采用市售彩虹Marker作为标准蛋白。
1.3.6 结合度的测定
确定复合物中花青素结合度及每毫克蛋白绑定花青素的含量。根据Rodríguez等[21]的方法稍作修改,首先制备花青素-3-葡萄糖苷的校准标准曲线,将所有样品分别经截留分子质量为3 kDa的透析袋在4 ℃条件下进行透析12 h,取其透析液适当稀释,以获得其浓度值在制备的校准曲线范围内,用高效液相色谱法在波长520 nm处测量样品花青素吸光度并计算其含量,复合物中花青素结合度及花青素/蛋白百分比按公式(1)、(2)计算:

式中:R花青素为复合物中花青素绑定蛋白结合率/%;M总花青素为总花青素质量/mg;M透析为透析液外未被绑定的游离花青素质量/mg;R花青素/蛋白为每毫克大豆分离蛋白结合花青素的百分比/%;M蛋白为大豆分离蛋白质量/mg。
1.3.7 荧光光谱分析
将样品适当稀释,分别置于石英比色皿中,使用F-4500荧光光谱仪测定样品的荧光光谱。其中,扫描发射波长在300~500 nm之间,激发波长为280 nm,激发和发射狭缝均为5 nm。
1.3.8 傅里叶变换红外光谱分析
红外光谱测试采用KBr压片法,称取样品1 mg,加入溴化钾100 mg,压片后在室温记录红外光谱。设定扫描波数谱段范围450~4 000 cm-1,分辨率设定为4 cm-1,扫描64 次,谱图利用Peakfit Version软件进行处理。利用积分面积计算各二级结构组分的相对含量[22]。
1.4 数据统计及分析
实验中每组数据平均重复3 次,利用Origin 8.5软件进行数据处理与作图。利用SPSS V17.0软件进行ANOVA差异显著性分析及相关性分析,其中P值小于0.05为显著性差异。
2 结果与分析
2.1 浊度分析
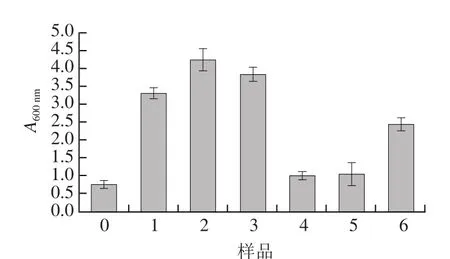
图1 大豆分离蛋白-花青素复合物的浊度Fig.1 Turbidity of SPI-anthocyanins complexes
浊度可以直观地反映溶液中蛋白质-花青素复合液中颗粒的分散状态,同时可表达复合物的聚集状态以及粒径大小[23],由图1可知,非共价结合/共价交联作用对大豆分离蛋白-花青素复合物浊度的影响。随花青素比例的增加,样品1~6较空白样品其浊度值都发生不同程度的增大,这可能是由于大豆分离蛋白经非共价结合/共价交联机制与花青素发生相互作用,改变蛋白部分结构,使得粒径发生不同程度的增大,蛋白质分子上含有固定连接多酚分子的位点数,随着多酚浓度的增加,当两者结合部位的数目趋于相等时,则可形成大量的复合物,浊度增大[24-25]。大豆分离蛋白-花青素复合物中样品4~6(pH 9.0、24 h;20∶1、10∶1、5∶1,m/m)的浊度值低于样品1~3(pH 7.4、2 h;20∶1、10∶1、5∶1,m/m),这一结果与Wang Xiaoyang等[26]实验结论相同,由于在碱性条件下,花青素被氧化成醌类物质进而与蛋白质相互作用导致共价键的形成,从而改善复合物粒径大小,降低溶液中与光线发生的漫反射。由此共价作用所形成的浊度值低于非共价作用所形成的浊度值。
2.2 结合度分析
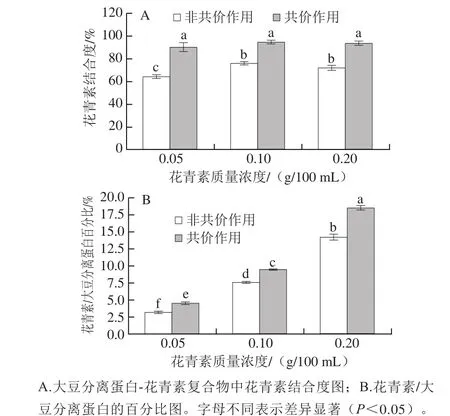
图2 大豆分离蛋白-花青素复合物中结合分析图Fig.2 Binding capacity of SPI-anthocyanins complexes
复合物经透析后可以获得未与蛋白质相互作用的游离花青素,通过测定游离花青素的含量,进而计算出花青素结合程度与花青素/大豆分离蛋白的百分比。通过图2得知,经共价交联处理的样品4~6(pH 9.0、24 h;20∶1、10∶1、5∶1,m/m)的结合度在90%~95%之间。相比之下,非共价结合处理的样品1~3(pH 7.4、2 h;20∶1、10∶1、5∶1,m/m)结合度较小为64%~76%(图2A)。非共价键主要包括范德华力、氢键、疏水作用力等,其键能弱于共价键,并且非共价作用是一种可逆的相互作用[17],这可能导致复合物的非共价结合程度低于共价交联程度。但无论共价/非共价作用,每毫克蛋白质所绑定的花青素含量都随花青素质量浓度的增加而上升(图2B),这一结果与Rodríguez等[21]的实验现象相吻合。值得注意的是样品4(pH 9.0、24 h;20∶1,m/m)中的花青素/大豆分离蛋白百分比比样品1(pH 7.4,2 h;20∶1,m/m)高出40.17%,样品5(pH 9.0,24 h;10∶1,m/m)比样品2(pH 7.4、2 h;10∶1,m/m)高出30.84%,结果表明随着花青素质量浓度的增加,共价键在所有复合物中具有比非共价键更强的亲和性,更有效地形成大豆分离蛋白-花青素复合物。此外,花青素与蛋白的结合能力与其相互作用模式等其他性质有关[17]。
2.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳结果
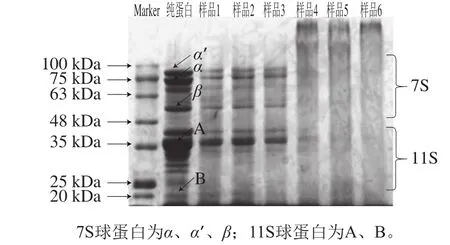
图3 大豆分离蛋白-花青素复合物的电泳图谱图Fig.3 SDS-PAGE prof i les of SPI-anthocyanins complexes
大豆分离蛋白受离心力场作用,根据沉降系数的差异分为4 种不同的蛋白质沉淀物2S、7S、11S和15S[27],其中7S(β-伴大豆球蛋白)和11S(大豆球蛋白)是大豆分离蛋白中的主要蛋白质,根据蛋白亚基分子质量的不同在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳图中产生不同条带分布,由此表达蛋白亚基的迁移能力[28]。如图3所示,与未经处理的蛋白相比,复合物中蛋白条带宽度都有所下降,并且在样品4~6(pH 9.0、24 h;20∶1、10∶1、5∶1,m/m)中分离胶上端出现了新的条带,平均分子质量约为180 kDa,此外分离胶顶部有黑色条带印记,这种现象说明有新的衍生物生成[29]。这可能是由于7S与11S蛋白被花青素经共价交联被部分绑定,从而形成较大分子质量的蛋白质复合物。这与Jia Zhenbao等[11]实验结论相同。样品1~3(pH 7.4、2 h;20∶1、10∶1、5∶1,m/m)中没有新的条带出现,仅降低了7S、11S蛋白含量,这意味着在pH 7.4、2 h处理条件下未生成共价交联反应,未改变蛋白质的四级结构。
2.4 荧光光谱分析
荧光光谱可有效反映蛋白质三级结构构象变化[30],常用于了解蛋白质与小分子物质复合的结合特性。由图4可知,花青素加入后,蛋白最大吸收峰的荧光强度值均低于未处理的空白蛋白荧光强度,并且荧光强度随花青素质量浓度的增加而逐渐降低,这说明花青素与大豆分离蛋白发生了相互作用。样品1~6的λmax均发生红移,表明复合物中大豆分离蛋白发生解折叠,并且蛋白经花青素结合后其主要发色基团Trp暴露于较为亲水环境中,由此导致蛋白质的三级结构发生不同程度的变化[31-32]。复合样品4~6(pH 9.0、24 h;20∶1、10∶1、5∶1,m/m)的荧光猝灭效果较样品1~3(pH 7.4、2 h;20∶1、10∶1、5∶1,m/m)明显,其结果表明共价交联作用强度大于非共价结合作用,这可能是花青素与蛋白经不可逆的共价作用大大降低了色氨酸含量,色氨酸含有自由氨基(—NH2),氨基与多酚类物质上的C发生共价交联生成C—N共价键。并且蛋白可能由于与花青素紧密结合使得部分发色基团被掩盖,降低蛋白荧光强度[11]。

图4 大豆分离蛋白-花青素复合物荧光光谱图Fig.4 Emission fl uorescence spectra of SPI-anthocyanins complexes
2.5 红外光谱分析

图5 大豆分离蛋白-花青素复合物傅里叶红外光谱图Fig.5 FT-IR spectra of SPI-anthocyanins complexes
傅里叶红外光谱是一种用来分析蛋白质结构表征的光谱技术[33]。如图5所示,蛋白质酰胺I带吸收峰的变化反映了蛋白二级结构的变化(1 700~1 600 cm-1)。根据己有研究表明,蛋白质二级结构与各子峰间的对应关系为:波数1 646~1 664 cm-1处对应的结构为α-螺旋;波数1 615~1 637 cm-1和1 682~1 700 cm-1处对应的结构为β-折叠;波数1 664~1 681 cm-1处对应的结构为β-转角;波数1 637~1 645 cm-1处对应的结构为无规则卷曲[34]。
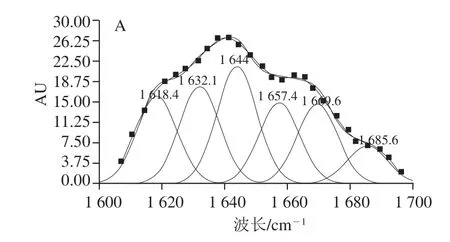

图6 大豆分离蛋白-花青素复合物中蛋白酰胺I带的拟合图谱Fig.6 Second-derivative FTIR spectra in the amide I region and Gaussian curve fi tting for soybean protein isolate in soybean protein isolates-anthocyanins complexes
采用Gauss面积法拟合,将复合样品中大豆分离蛋白的酰胺I带红外谱图进行二阶导数,可得大豆分离蛋白-花青素复合物中蛋白酰胺I带的拟合图谱,见图6;可计算得出蛋白质二级结构的种类与含量[35],计算结果见表2。

表2 大豆分离蛋白-花青素复合物中蛋白的二级结构相对含量Table2 Secondary structure contents of proteins in SPI-anthocyanins complexes
由图5、6可知,复合物中的蛋白红外光谱吸收强度有明显变化,花青素的加入导致酰胺I带吸收峰的强度降低,与空白蛋白,样品1(pH 7.4、2 h;20∶1,m/m)、4(pH 9.0、24 h;20∶1,m/m)的酰胺I带分别从1 624.78 cm-1蓝移至1 630.97 cm-1和1 634.74 cm-1,波长向短波长方向移动,振动能量增高。这表明添加花青素后蛋白质的二级结构发生了不同程度的改变。复合物之间的相互作用可能会导致蛋白质构象发生变化[36]。表2中,样品1(pH 7.4、2 h;20∶1,m/m)与样品4(pH 9.0、24 h;20∶1,m/m)的β-折叠相对含量分别降低到36.84%和18.01%,β-转角相对含量分别增加到31.95%和40.16%,无规则卷曲相对含量分别增加到22.40%和26.53%。这表明α-螺旋和β-折叠结构逐渐向β-转角和无规则卷曲转变,Hasni等[37]认为蛋白质的构象可被多酚改变,主要是由于α-螺旋、β-折叠与β-转角、无规则卷曲之间的含量转换,此外,在碱性条件下大豆分离蛋白-花青素复合物中β-转角及无规则卷曲结构相对含量明显提升,这进一步表明对于复合物中的蛋白质,共价交联作用较非共价结合作用具有较强的解折叠能力,使得部分蛋白结构展开。
3 结 论
本实验采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析与结合度测定方法探究了大豆分离蛋白-花青素复合体系中分子质量分布及花青素对蛋白的绑定状态,利用浊度测定手段分析了复合体系中颗粒的分散状态,再通过荧光光谱及红外光谱测定方法从微观上解析了复合体系中蛋白结构变化。由此研究得出以下结论:
结合度测定、凝胶电泳分析等实验表明,在电泳图谱中样品4~6(20∶1、10∶1、5∶1,m/m)在pH 9.0、24 h处理条件下有大分子衍生物生成,由此说明在此条件下形成共价交联;每毫克蛋白质所绑定的花青素含量都随花青素质量浓度的增加而增大,且共价键在所有复合物中具有比非共价键更强的亲和特性。
随花青素的加入,大豆分离蛋白经非共价结合/共价交联机制与花青素发生相互作用,蛋白部分结构发生改变,复合体系中粒径发生不同程度的增大。在pH 7.4、2 h和pH 9.0、24 h处理条件下,样品浊度值均高于空白蛋白样品,且样品4~6(20∶1、10∶1、5∶1,m/m)的浊度值低于样品1~3(20∶1、10∶1、5∶1,m/m),这可能是共价聚合可改善复合物粒径大小从而降低复合物光漫反射。
荧光光谱图中表明随着花青素含量的增大,复合物溶液的荧光强度明显降低。蛋白质与花青素之间的相互作用不断增强,使得发色基团被不断猝灭,其中不可逆的共价作用猝灭能力强于非共价作用;在pH 7.4、2 h和pH 9.0、24 h 处理条件下,低花青素比例(20∶1,m/m)大豆分离蛋白-花青素复合物的红外吸收光谱强度与空白蛋白样相比均发生明显变化,这表明复合物中蛋白质二级结构发生改变,且样品4在pH 9.0、24 h处理条件下β-转角及无规则卷曲结构相对含量高于样品1(pH 7.4、2 h),由此推测共价交联机制中蛋白多肽链的解折叠能力较强。
以上结果为大豆分离蛋白-花青素复合体系中的非共价/共价作用对其结构的影响提供了部分参考,为多酚类物质与植物蛋白复合产品等食品加工过程的应用提供了一定的理论依据。
[1] GARCIA-DIAZ D F, JOHNSON M H, DE MEJIA E G. Anthocyanins from fermented berry beverages inhibit inf l ammation-related adiposity response in vitro[J]. Journal of Medicinal Food, 2015, 18(4)∶ 489-496.DOI∶10.1089/jmf.2014.0039.
[2] 张涛, 魏安池, 刘若瑜. 大豆蛋白改性技术研究进展[J]. 粮油食品科技, 2011, 19(5)∶ 26-29. DOI∶10.16210/j.cnki.1007-7561.2011.05.020.
[3] 毕爽, 张巧智, 丁俭, 等. 红外光谱研究超声促聚集作用对大豆蛋白-磷脂结构与功能的影响[J]. 食品科学, 2017, 38(11)∶ 18-24.DOI∶10.7506/spkx1002-6630-201711004.
[4] MULAUDZI R B, NDHLALA A R, KULKARNI M G, et al.Pharmacological properties and protein binding capacity of phenolic extracts of some Venda medicinal plants used against cough and fever[J]. Journal of Ethnopharmacology, 2012, 143(1)∶ 185-193.DOI∶10.1016/j.jep.2012.06.022.
[5] KONCZAK I, ZHANG W. Anthocyanins—more than nature’s colours[J]. BioMed Research International, 2004, 2004(5)∶ 239-240.DOI∶10.1155/S1110724304407013.
[6] WANG Y, WANG X. Binding, stability, and antioxidant activity of quercetin with soy protein isolate particles[J]. Food Chemistry, 2015,188∶ 24-29. DOI∶10.1016/j.foodchem.2015.04.127.
[7] ARROYO-MAYA I J, CAMPOS-TERÁN J, HERNÁNDEZARANA A, et al. Characterization of flavonoid-protein interactions using fluorescence spectroscopy∶ binding of pelargonidin to dairy proteins[J]. Food Chemistry, 2016, 213∶ 431-439. DOI∶10.1016/j.foodchem.2016.06.105.
[8] GORJI E G, ROCCHI E, SCHLEINING G, et al. Characterization of resveratrol-milk protein interaction[J]. Journal of Food Engineering,2015, 167(b)∶ 217-225. DOI∶10.1016/j.jfoodeng.2015.05.032.
[9] 姚惠芳, 景浩. 笃斯越橘花青素与牛血清白蛋白的相互作用[J]. 食品科学, 2013, 34(23)∶ 6-10. DOI∶10.7506/spkx1002-6630-201323002.
[10] OZDAL T, CAPANOGLU E, ALTAY F. A review on protein-phenolic interactions and associated changes[J]. Food Research International,2013, 51(2)∶ 954-970. DOI∶10.1016/j.foodres.2013.02.009.
[11] JIA Z B, ZHENG M, TAO F, et al. Effect of covalent modification by (-)-epigallocatechin-3-gallate on physicochemical and functional properties of whey protein isolate[J]. LWT-Food Science and Technology, 2016, 66∶ 305-310. DOI∶10.1016/j.lwt.2015.10.054.
[12] PRODPRAN T, BENJAKUL S, PHATCHARAT S. Effect of phenolic compounds on protein cross-linking and properties of film from fish myofibrillar protein[J]. International Journal of Biological Macromolecules, 2012, 51(5)∶ 774-782. DOI∶10.1016/j.ijbiomac.2012.07.010.
[13] WOLF W J. Soybean proteins. Their functional, chemical, and physical properties[J]. Journal of Agricultural and Food Chemistry,1970, 18(6)∶ 969-976. DOI∶10.1021/jf60172a025.
[14] SUI X N, ZHOU W. Monte Carlo modelling of non-isothermal degradation of two cyanidin-based anthocyanins in aqueous system at high temperatures and its impact on antioxidant capacities[J]. Food Chemistry, 2014, 148∶ 342-350. DOI∶10.1016/j.foodchem.2013.10.060.
[15] SUI X, DONG X, ZHOU W. Combined effect of pH and high temperature on the stability and antioxidant capacity of two anthocyanins in aqueous solution[J]. Food Chemistry, 2014, 163∶ 163-170. DOI∶10.1016/j.foodchem.2014.04.075.
[16] SADILOVA E, STINTZING F C, CARLE R. Thermal degradation of acylated and nonacylated anthocyanins[J]. Journal of Food Science,2006, 71(8)∶ C504-C512. DOI∶10.1111/j.1750-3841.2006.00148.x.
[17] NAGY K, COURTET-COMPONDU M C, WILLIAMSON G, et al.Non-covalent binding of proteins to polyphenols correlates with their amino acid sequence[J]. Food Chemistry, 2012, 132(3)∶ 1333-1339.DOI∶10.1016/j.foodchem.2011.11.113.
[18] 刘勤勤, 朱科学, 郭晓娜, 等. 茶多酚与大豆分离蛋白的相互作用[J].食品科学, 2015, 36(17)∶ 43-47. DOI∶10.7506/spkx1002-6630-201517009.
[19] MARTINI S, POTTER R, WALSH M. Optimizing the use of power ultrasound to decrease turbidity in whey protein suspensions[J]. Food Research International, 2010, 43(10)∶ 2444-2451. DOI∶10.1016/j.foodres.2010.09.018.
[20] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227∶ 680-685.DOI∶10.1038/227680a0.
[21] RODRÍGUEZ S D, VON STASZEWSKI M, PILOSOF A M R.Green tea polyphenols-whey proteins nanoparticles∶ bulk, interfacial and foaming behavior[J]. Food Hydrocolloids, 2015, 50∶ 108-115.DOI∶10.1016/j.foodhyd.2015.04.015.
[22] SUREWICZ W K, MANTSCH H H. New insight into protein secondary structure from resolution-enhanced infrared spectra[J].Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 1988, 952∶ 115-130. DOI∶10.1016/0167-4838(88)90107-0.
[23] 李云. 大豆蛋白聚集及共混凝胶性质研究[D]. 无锡∶ 江南大学,2007.
[24] 綦菁华, 蔡同一, 于同泉, 等. 蛋白质和酚类的浓度及其比率对其聚合物浊度的影响[J]. 食品科学, 2008, 29(11)∶ 114-117.
[25] SIEBERT K J, TROUKHANOVA N V, LYNN P Y. Nature of polyphenol-protein interactions[J]. Journal of Agricultural and Food Chemistry, 1996, 44(1): 80-85. DOI:10.1021/jf9502459.
[26] WANG X Y, ZHANG J, LEI F, et al. Covalent complexation and functional evaluation of (-)-epigallocatechin gallate and α-lactalbumin[J]. Food Chemistry, 2014, 150∶ 341-347. DOI∶10.1016/j.foodchem.2013.09.127.
[27] NISHINARI K, FANG Y, GUO S, et al. Soy proteins∶ a review on composition, aggregation and emulsif i cation[J]. Food Hydrocolloids,2014, 39∶ 301-318. DOI∶10.1016/j.foodhyd.2014.01.013.
[28] 郑敏. 表没食子儿茶素没食子酸酯(EGCG)对乳清分离蛋白的改性作用研究[D]. 北京∶ 中国计量学院, 2014.
[29] RAWEL H M, CZAJKA D, ROHN S, et al. Interactions of different phenolic acids and flavonoids with soy proteins[J]. International Journal of Biological Macromolecules, 2002, 30(3)∶ 137-150.DOI∶10.1016/S0141-8130(02)00016-8.
[30] LIU W, ZHANG Z Q, LIU C M, et al. The effect of dynamic highpressure microf l uidization on the activity, stability and conformation of trypsin[J]. Food Chemistry, 2010, 123(3)∶ 616-621. DOI∶10.1016/j.foodchem.2010.04.079.
[31] KRISTO E, HAZIZAJ A, CORREDIG M. Structural changes imposed on whey proteins by UV irradiation in a continuous UV light reactor[J]. Journal of Agricultural and Food Chemistry, 2012, 60(24)∶6204-6209. DOI∶10.1021/jf300278k.
[32] LAKOWICZ J R, MASTERS B R. Principles of fluorescence spectroscopy[J]. Naturwissenschaften, 1991, 78(10): 456-457.
[33] JACKSON M, MANTSCH H H. The use and misuse of FTIR spectroscopy in the determination of protein structure[J]. Critical Reviews in Biochemistry and Molecular Biology, 1995, 30(2): 95-120.DOI:10.3109/10409239509085140.
[34] SCHMIDT V, GIACOMELLI C, SOLDI V. Thermal stability of films formed by soy protein isolate-sodium dodecyl sulfate[J].Polymer Degradation and Stability, 2005, 87(1): 25-31. DOI:10.1016/j.polymdegradstab.2004.07.003.
[35] MAUERER A, LEE G. Changes in the amide I FT-IR bands of poly-L-lysine on spray-drying from alpha-helix, beta-sheet or random coil conformations[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2006, 62(2): 131-142. DOI:10.1016/j.ejpb.2005.08.005.
[36] WU X, WU H, LIU M, et al. Analysis of binding interaction between (-)-epigallocatechin (EGC) and beta-lactoglobulin by multi-spectroscopic method[J]. Spectrochim Acta A Molecular &Biomolecular Spectroscopy, 2011, 82(1): 164-168. DOI:10.1016/j.saa.2011.07.028.
[37] HASNI I, BOURASSA P, HAMDANI S, et al. Interaction of milk α- and β-caseins with tea polyphenols[J]. Food Chemistry, 2011,126(2): 630-639. DOI:10.1016/j.foodchem.2010.11.087.

