Claudin 3在肺鳞癌和腺癌的表达差异及预后探讨
车娟娟,王 婧,李卉惠,赵 磊,甄洪超,曹邦伟
肺癌是目前全球范围内发病率和死亡率均极高的恶性肿瘤之一,5年生存率徘徊在15%左右[1]。美国癌症协会(ACS)的最新数据显示:2018年美国预计有234,030例新发肺癌病例,预计将有154,050例患者死于肺癌,占所有癌症死亡总数的26%[2]。非小细胞肺癌(NSCLC)主要由肺鳞癌和腺癌构成,近年来腺癌比例逐渐增高。短期出现复发转移依旧是影响术后肺鳞癌和腺癌生存的主要因素。Claudins蛋白家族是细胞紧密连接的主要成分,其异常表达是肿瘤发展过程中的关键步骤,并且与多种肿瘤的预后相关[3-5]。本研究通过回顾性分析我院2010年1月—2014年12月行手术切除的肺鳞癌和腺癌患者各80例,免疫组化检测Claudin3的表达状况,探讨其在肺鳞癌与腺癌中的表达差异,并进一步分析其与临床病理因素和预后的相关性。
1 资料与方法
1.1 一般资料 病例收集:收集首都医科大学附属北京友谊医院2010年1月—2014年12月手术切除的肺鳞癌和腺癌石蜡包埋标本各80例,共计160例,请高年资的病理医师复习病理切片。
病例入选标准:(1)术前接受胸部CT扫描、脑CT或MR扫描、腹部B超或CT,排除脑、肝、肾上腺、对侧肺内无转移,全身ECT骨扫描检查(部分患者行PET-CT检查)排除骨转移的患者;(2)术前未接受任何放、化疗等抗癌治疗;(3)依据NCCN指南要求,行肺癌根治性切除术及随访资料完整患者为研究对象,排除术后1月内死亡病例。
治疗方式:所有患者均经手术治疗,其中I~Ⅲa期患者给予手术为主的综合治疗,Ⅱ-Ⅲa期患者术后予以辅助化疗,部分IIIa期患者行辅助放疗。其中化疗采用NSCLC的常规方案,包括长春瑞滨联合顺铂或卡铂(NP)、培美曲塞联合顺铂或卡铂(PP)、紫杉醇联合顺铂或卡铂(TP)、吉西他滨联合顺铂或卡铂(GP)等;放疗包括对病灶、纵隔及双侧锁骨上的淋巴结的放射治疗。
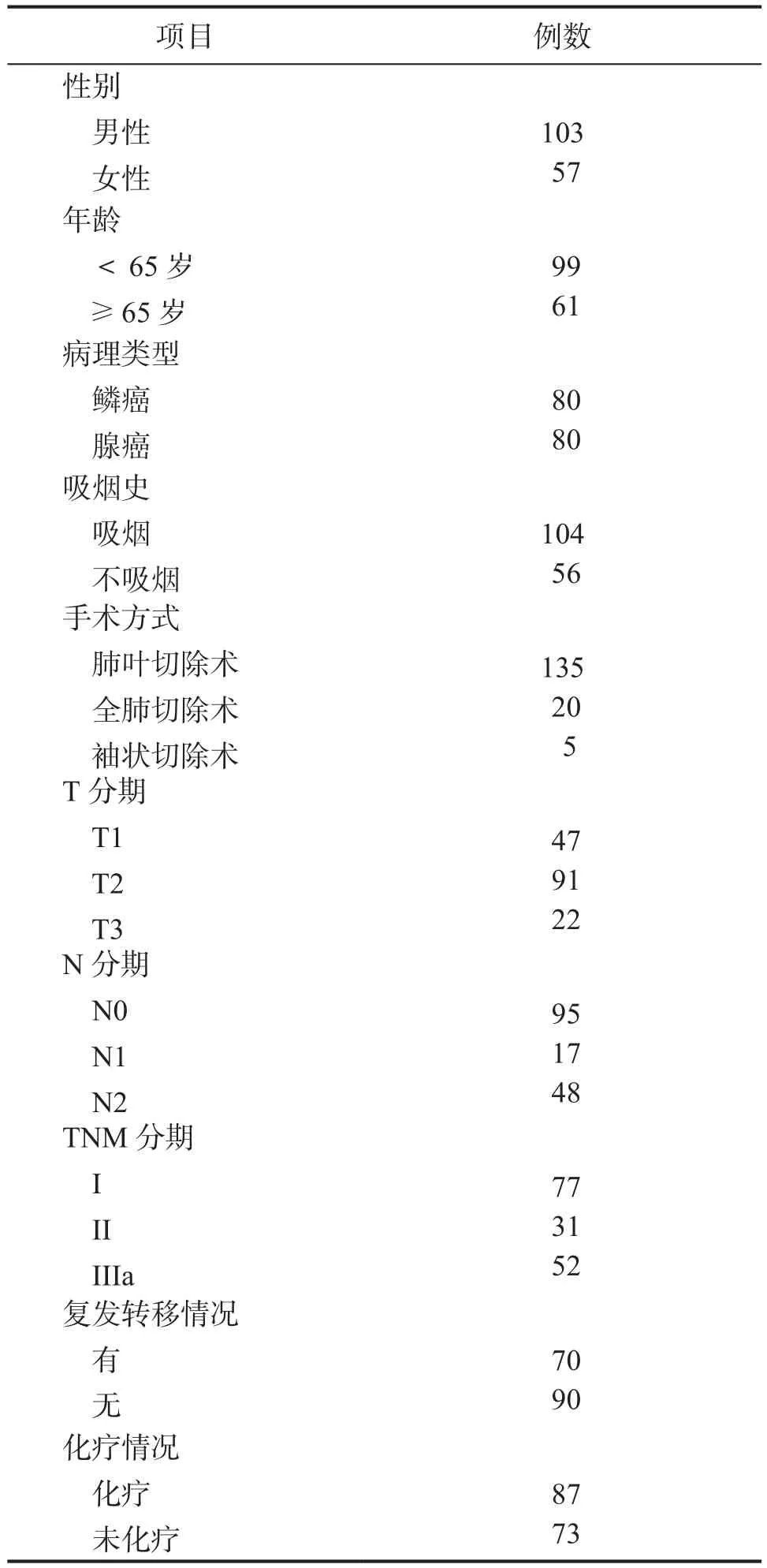
表1 肺鳞癌及腺癌患者的临床资料情况
1.2 免疫组化检测方法 采用免疫组化SP法对所有标本中的Claudin 3蛋白表达情况进行检测,具体方法:4 μm厚的组织切片常规脱蜡、梯度乙醇入水。应用3%的H2O2避光室温放置20 min封闭内源性过氧化物酶活性,使用0.1%枸橼酸缓冲液(pH 6.0)高温高压修复抗原后,滴加10%正常山羊血清反应20 min,加Claudin 3一抗(1:100稀释,Assay Biotech,Sunnyvale,CA,USA),4 ℃过夜后,加入生物素标记的二抗,在37 ℃孵育30 min,二甲基联苯胺(DAB)显色。封固后在光学显微镜下观察染色结果。以宫颈癌组织染色结果作为阳性对照,以PBS代替一抗作为阴性对照。
免疫组化着色结果判断Claudin 3阳性表达定位于细胞膜。免疫组化反应根据染色强度和阳性细胞百分比分级为0~3级。0分:没有着色或者阳性细胞小于10%;1分:大于10%的肿瘤细胞浅着色或者10%~40%的细胞中等着色;2分:大于40%的肿瘤细胞中等着色或者10%~40%的肿瘤细胞强着色;3分:大于40%的细胞强着色。为了便于统计分析,将0~1分者定义为阴性组,将2~3分者定义为阳性组。
1.3 统计方法及随访 应用SPSS 17.0统计软件进行统计学分析,率的检验采用χ2检验,Kaplan-Meier法计算生存率,Log-rank检验进行单因素分析,多因素分析利用Cox回归模型进行,以P<0.05为差异有统计学意义。生存时间定义为:自手术治疗之日至末次随访日或死亡的时间,以年为单位计算。失访或随访截止时仍存活者视为截尾数据,随访终止日期为2017年1月1日。
2 结果
2.1 Claudin 3在NSCLC中的表达情况及与临床病理因素的关系 免疫组化法检测Claudin 3表达如图1,Claudin 3阳性表达定位于细胞膜上。分析160例患者中,Claudin 3表达情况与临床病理因素关系,发现Claudin 3表达与性别、年龄、吸烟史、TNM分期及复发转移均无相关性,而仅仅与病理类型相关,结果如表2所示。2.2 患者生存的预后因素分析 应用Kaplan-Meier法对160例肺鳞癌和腺癌患者相关因素进行单因素分析显示:性别、年龄、吸烟史、病理类型、术后辅助化疗及Claudin 3表达等因素对患者生存率的影响无统计学意义(P>0.05)。而T分期、N分期、TNM分期及是否复发转移等因素对患者生存率的影响有明显统计学意义(P<0.05)(表3)。
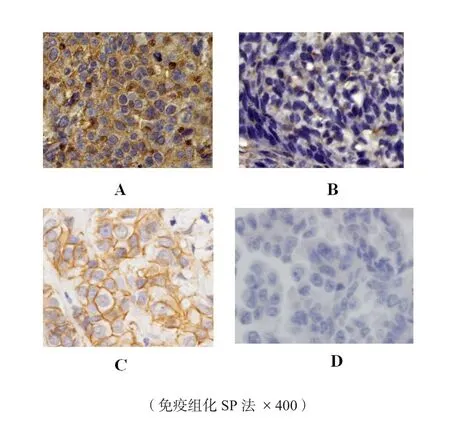
图1 免疫组化检测Claudin 3在NSCLC组织表达情况
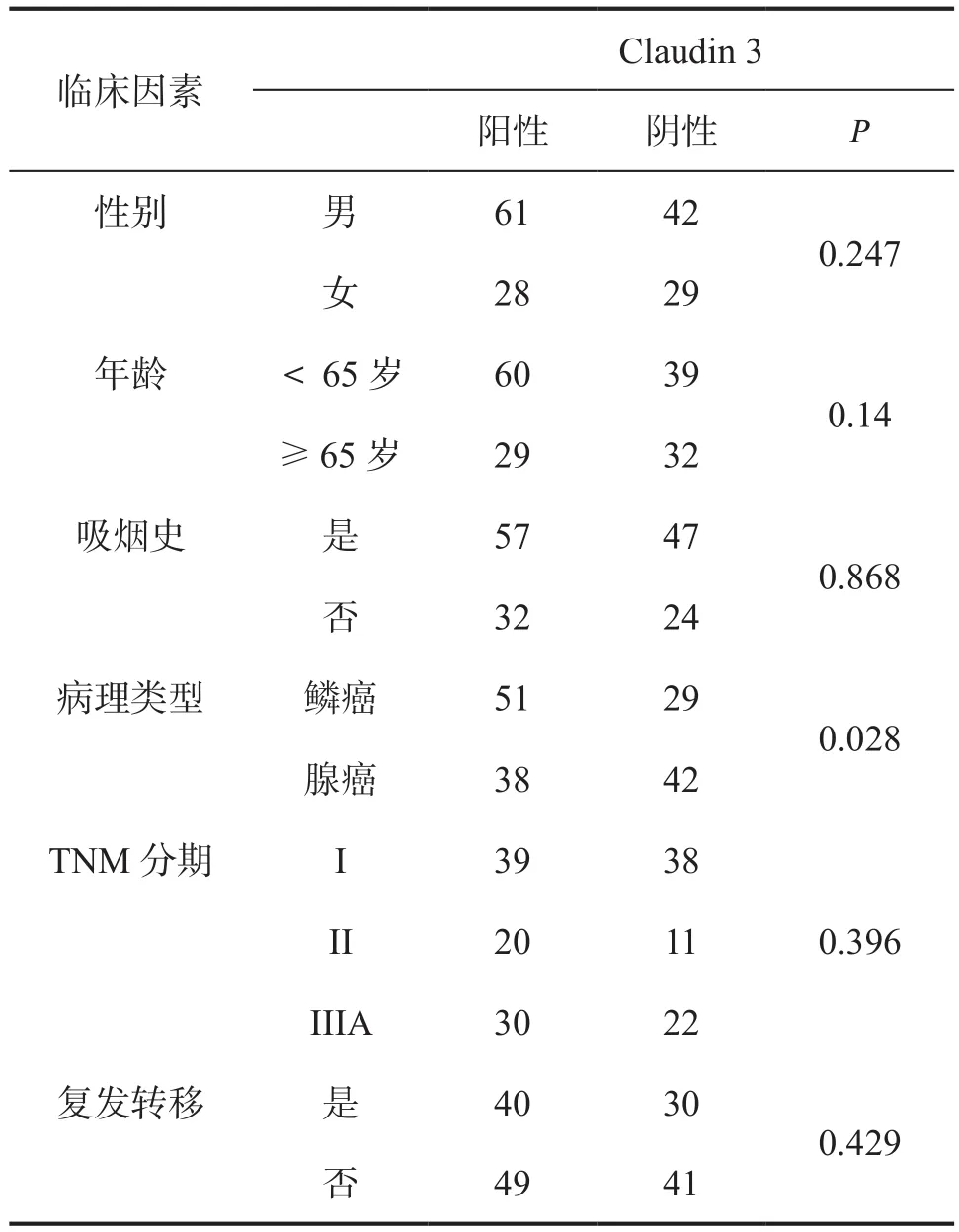
表2 160肺癌标本中Claudin 3阳性表达与临床因素的关系
对上述进行单因素分析的因素进一步纳入Cox回归模型,行多因素分析显示:TNM分期(P=0.000)和复发转移(P=0.000)是NSCLC独立的预后影响因素,其生存曲线分别如图2、图3所示。
2.3 Claudin 3表达状况在不同病理亚型分层分析结果 鉴于不同病理亚型中Claudin 3的表达差异,为了进一步明确Claudin 3在不同肺癌亚型的临床意义,我们进一步进行分层分析,结果如下表4所示。两个亚组的生存曲线如图4、5。
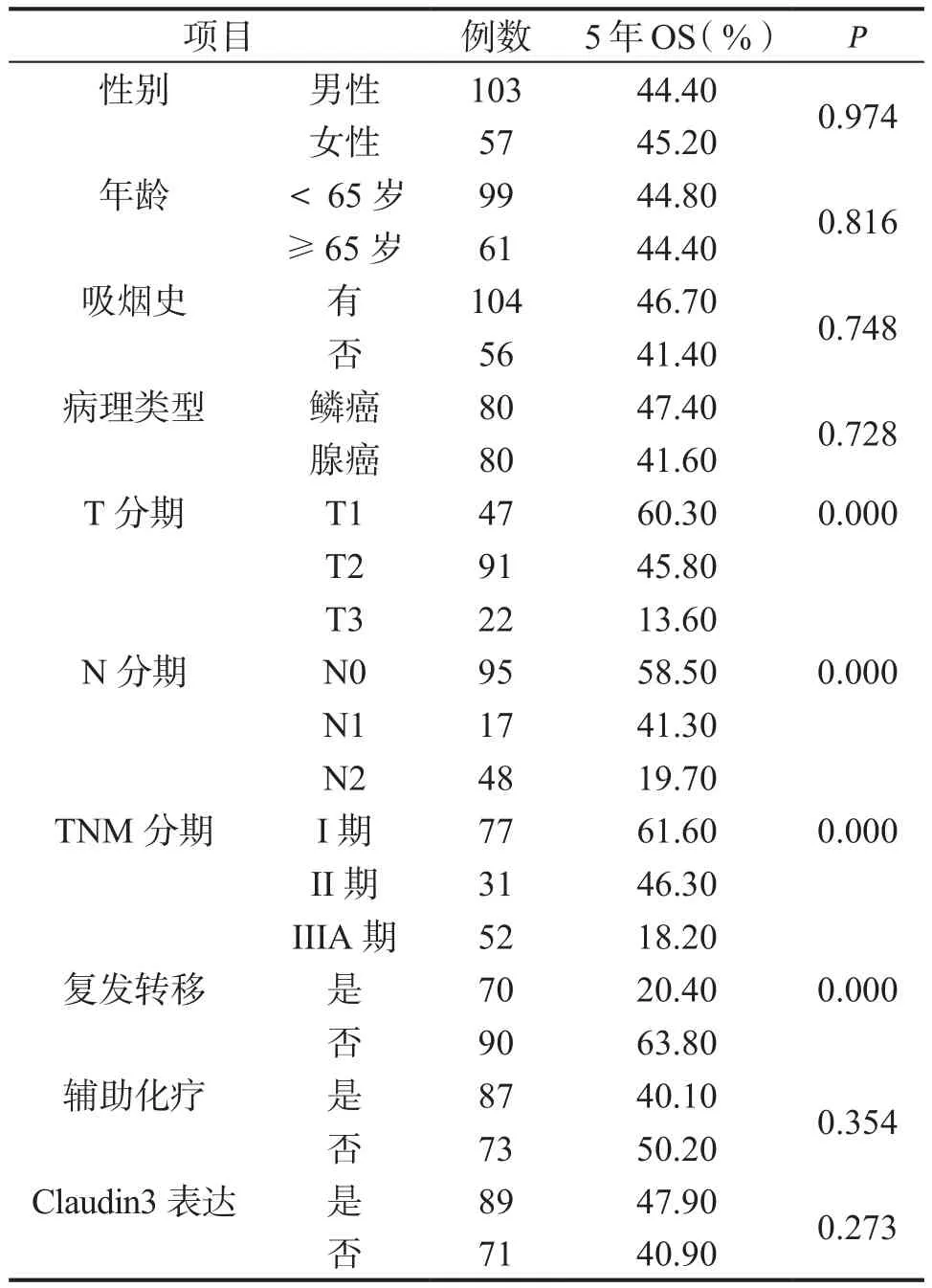
表3 NSCLC患者的预后因素的单因素分析结果
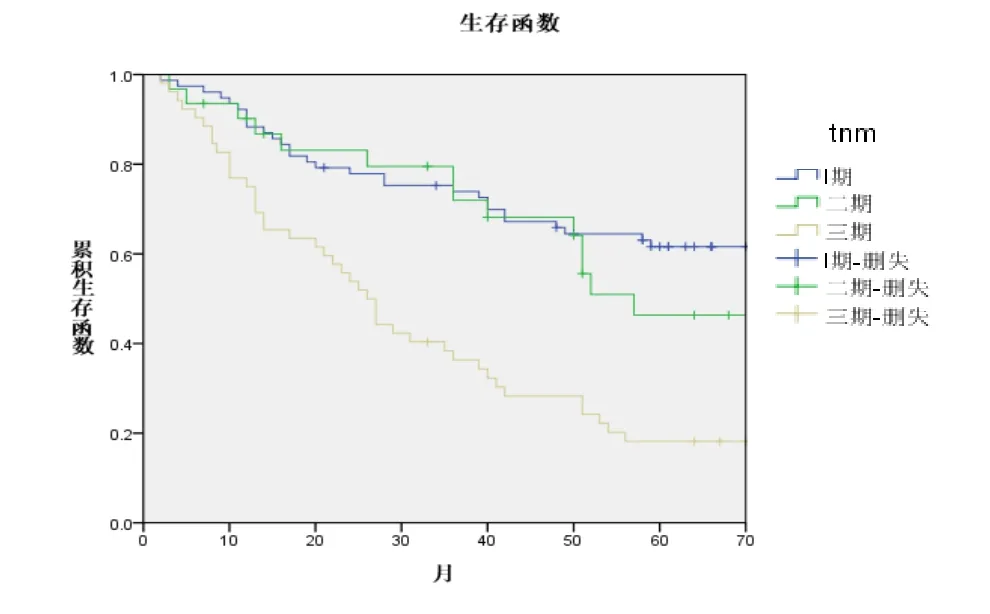
图2 不同TNM分期患者的生存曲线
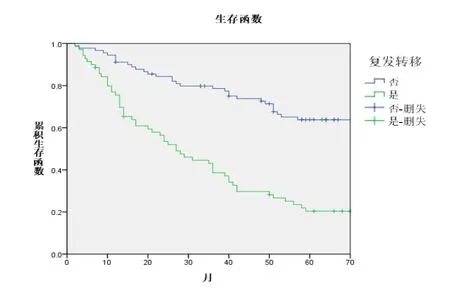
图3 是否复发转移患者的生存曲线
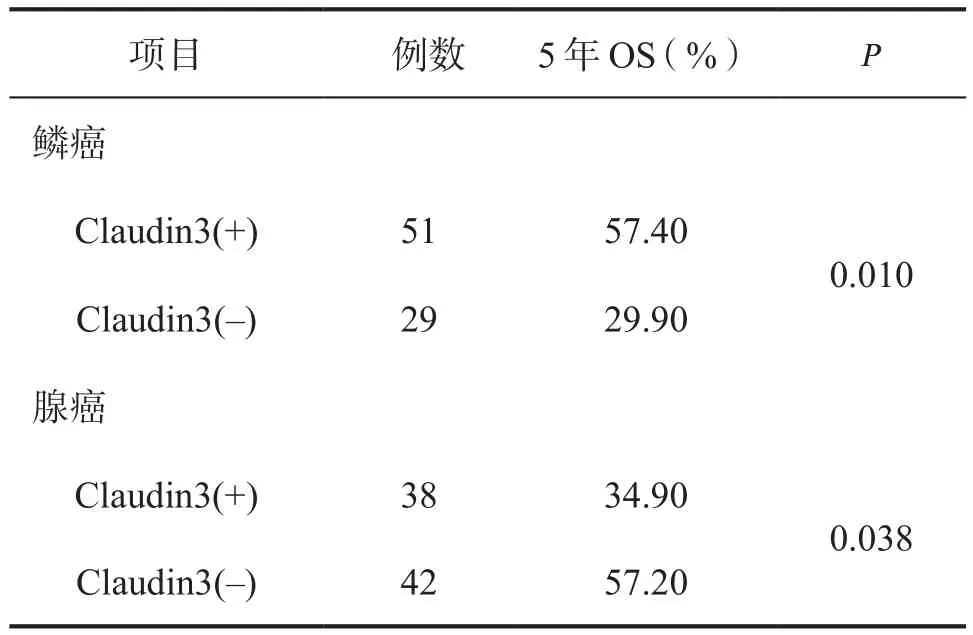
表4 160例肺癌患者预后因素的分层分析结果
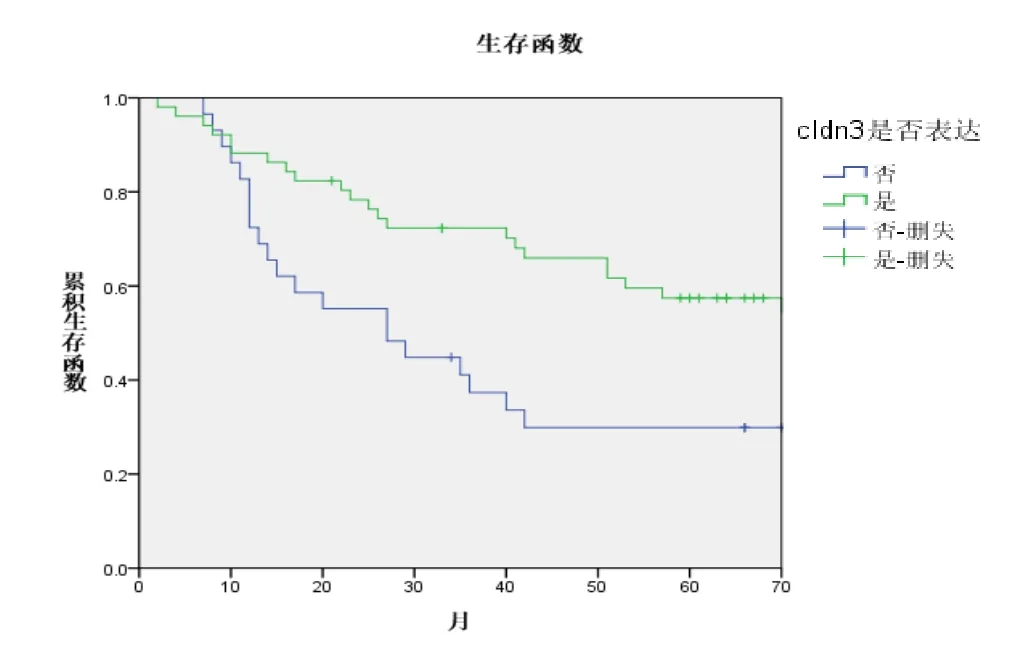
图4 鳞癌患者中不同Claudin3表达的生存曲线
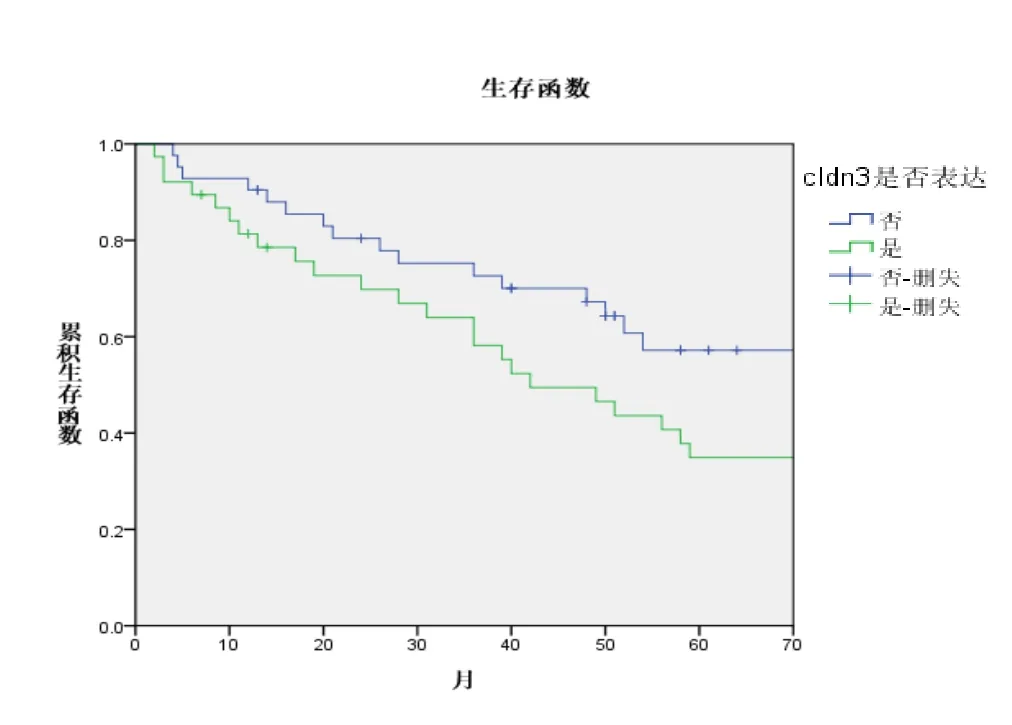
图5 腺癌患者中不同Claudin3表达的生存曲线
3 讨论
肺癌是目前全球范围内发病率和死亡率均极高的恶性肿瘤之一。ACS数据显示:肺癌发病率的变化存在性别差异,自80年代以来,男性肺癌发病率一直在下降,2010—2014年,平均每年下降约2.9%;而女性肺癌发病率的下降滞后于男性,约从2005开始出现下降[6]。并且在临床实践中大约50%的病例是肺腺癌[7]。在我国,肺癌的发病率却逐年升高,并且在许多大城市肺癌的发病率已占常见恶性肿瘤的首位[8]。NSCLC约占肺癌的85%,肺鳞癌和肺腺癌构成NSCLC的主要病理类型,肺腺癌的发病率逐年升高,且肺腺癌更多见于非吸烟的患者[9]。手术切除为主的综合治疗可以明显提高患者生存率。NSCLC预后受多种因素影响,本研究通过多因素分析显示TNM分期(P=0.000)和复发转移(P=0.000)是NSCLC独立的预后影响因素。
Claudins跨膜蛋白家族是构成细胞紧密连接的主要骨架结构,它们可以直接调控TJ的渗透性。目前发现Claudins包括27种家族成员,远端肺上皮细胞主要表达Claudin 3(CLDN3)和Claudin 4[10],CLDN3在肺的屏障功能中发挥了重要作用。同时CLDN3是产气荚膜梭状芽孢杆菌内毒素的天然受体,两者结合后能够导致细胞快速溶解,而产气荚膜梭状芽孢杆菌内毒素能够有效地抑制CLDN3表达的恶性肿瘤[11],由此CLDN3将可能作为肿瘤治疗的潜在靶点。我们的研究发现CLDN3在IIIA期肺腺癌中的阳性表达率明显高于I期患者,并且CLDN3阳性表达患者的5年生存率明显低于阴性患者(34.9% vs 57.2%)。我们的研究结果与张连明等[12]的研究结果相一致,他们发现与癌旁正常组织相比,肺腺癌组织中CLDN3的表达量显著升高,并且CLDN3的过表达与肺腺癌细胞的恶性潜能及ERK1/2和PI3K-Akt信号通路相关。与肺腺癌相反,我们发现CLDN3在IIIA期肺鳞癌组织中的阳性表达率明显低于I期患者,CLDN3阳性表达患者的5年生存率明显优于阴性患者(57.4% vs 29.9%),这与我们之前的研究结果相一致[13]。并且我们之前的研究发现CLDN3可以通过抑制上皮间质转化进而抑制肺鳞癌侵袭和转移[13-14]。进一步对CLDN3进行分层并行生存分析显示CLDN3分别是肺鳞癌和肺腺癌的独立预后影响因素[14]。Judit等[15]也发现与正常肺组织相比,CLDN 3在肺腺癌中表达增加,而在肺鳞癌中表达下降。分析CLDN3在肺鳞癌和肺腺癌中表达差异的原因,我们推测与肺鳞癌和肺腺癌来源及肿瘤发生发展过程不同相关,肺鳞癌起源于段和亚段支气管黏膜上皮,经鳞状上皮化生、异型增生和原位癌等阶段再演进为肺鳞癌。而肺腺癌来自支气管的黏膜上皮和腺上皮,大多起源于较小的支气管黏膜分泌黏液的上皮细胞。此外,放射诱导的小鼠肺腺癌模型发现肺腺癌主要来源于II型肺泡上皮细胞,腺鳞癌和鳞癌来源于其它肺上皮细胞,而CLDN3主要是由II型肺泡上皮细胞表达[16]。因此CLDN3在肺腺癌中的高表达可能是相对的,而不是绝对的,Lin等[17]也认为在卵巢癌的形成过程中经历了间质上皮转化过程,而卵巢癌组织中CLDN3和Claudin4的高表达是相对的,而不是绝对的。目前所有文献报道中,尚未见到比较CLDN3不同表达程度对预后的影响,后续的研究中,我们会扩大病例数进一步研究探索。
T分期及N分期成为NSCLC预后的独立影响因素。依据国际肺癌研究协会(IASLC)最新数据库分析,IASLC对第七版肿瘤、淋巴结和转移(TNM)分期系统进行了修订。N分期方面维持不动,T 分期方面变动最大的是,肿瘤大小是一个重要的预后因素,具体为:距隆突小于2 cm的支气管及全部的肺不张/肺炎均归为T2,膈肌浸润归为T4,因为与T3相比,膈肌浸润的预后与T4更相似,纵隔胸腔浸润由于很少使用而不再用于描述T分期。我们依据15最新的TNM分期,T1、T2、T3及T4期5年生存率分别为57.6%、48.0%、22.8%和19.9%,发现随着T分期的增加,生存率逐渐下降,具有统计学差异(P=0.000)。此外,更新的推荐将IA期患者进行了细分;设立了ⅢC期,即T3和T4期且N3的患者,将Ⅳ期患者分为ⅣA期(胸腔内转移)和ⅣB期(单一/多发胸腔外转移)。我们的研究显示,I期、II期及IIIA期5年生存率分别为61.6%、46.3%和18.2%,发现随着TNM分期的增加,生存率逐渐下降,具有统计学差异(P=0.000)。这提示我们新TNM分期能够合理精确地指导术后恰当的综合治疗,结合我们的资料,新分期可以更加准确的反应预后。
[1] Moore W, Talati R, Bhattacharji P, et al. Five-year survival after cryoablation of stage I non-small cell lung cancer in medically inoperable patients[J]. J Vasc Interv Radiol,2015,26(3):312-319.
[2] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin,2018,68(1):7-30.
[3] Romanov V, Whyard TC, Waltzer WC, et al. A CLDN3 and claudin 4-targeted Clostridium perfringens protoxin is selectively cytotoxic to PSA-producingprostate cancer cells[J]. Cancer Lett,2014, 351(2): 260-264.
[4] Che J, Yang Y, Xiao J, et al. Decreased expression of claudin-3 is associated with a poor prognosis and EMT in completely resected squamous cell lung carcinoma[J]. Tumour Biol, 2015, 36(8):6559-6568.
[5] Todd MC, Petty HM, King JM, et al. Overexpression and delocalization of claudin-3 protein in MCF-7 and MDA-MB-415 breast cancer cell lines[J]. Oncol Lett, 2015, 10(1): 156-162.
[6] Smith RA, Andrews KS, Brooks D, et al. Cancer screening in the United States, 2018: A review of current American Cancer Society guidelines and current issues in cancer screening[J]. CA Cancer J Clin, 2018,doi: 10.3322/caac.21446. [Epub ahead of print]
[7] Noone AM, Cronin KA, Altekruse SF, et al. Cancer incidence and survival trends by subtype using data from the Surveillance Epidemiology and End Results Program, 1992-2013[J]. Cancer Epidemiol Biomarkers Prev, 2017, 26(4): 632-641.
[8] 陈万青, 郑荣寿, 张思维, 等. 2013年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2017, 25(1): 1-8.
[9] Novello S, Barlesi F, Califano R, et al. Metastatic non-small-cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J]. Ann Oncol, 2016, 27(suppl 5): v1-v27.
[10] Günzel D. Claudins: vital partners in transcellular and paracellular transport coupling[J]. Pf l ugers Arch, 2017, 469(1): 35-44.
[11] Romani C, Cocco E, Bignotti E, et al. Evaluation of a novel human IgG1 anti-CLDN3 antibody that specifically recognizes its aberrantly localized antigen in ovarian cancer cells and that is suitable for selective drug delivery[J]. Oncotarget, 2015, 6(33):34617-34628.
[12] Zhang L, Wang Y, Zhang B, et al. Claudin-3 expression increases the malignant potential of lung adenocarcinoma cells: role of epidermal growth factor receptor activation[J]. Oncotarget, 2017,8(14): 23033-23047.
[13] Che J, Yue D, Zhang B, et al. Claudin-3 Inhibits Lung Squamous Cell Carcinoma Cell Epithelial-mesenchymal Transition and Invasion via Suppression of the Wnt/β-catenin Signaling Pathway[J]. Int J Med Sci, 2018, 15(4): 339-351.
[14] Che JJ, Yang YF, Xiao J, et al. Decreased expression of claudin-3 is associated with a poor prognosis and EMT in completely resected squamous cell lung carcinoma[J]. Tumour Biol, 2015,36(8): 6559-6568.
[15] Judit Moldvay, Márta Jäckel, Csilla Páska, et al. Distinct claudin expression profile in histologic subtypes of lung cancer[J]. Lung Cancer, 2007, 57(2): 159-167.
[16] Oghiso Y, Yamada Y. Immunohistochemical study on cellular origins of rat lung tumors induced by inhalation exposures to plutonium dioxide aerosols as compared to those by X-ray irradiation[J]. J Radiat Res, 2002, 43(3): 301-311.
[17] Lin X, Shang X, Manorek G, et al. Regulation of the Epithelial-Mesenchymal Transition by Claudin-3 and Claudin-4[J]. PLoS One, 2013, 8(6): e67496.

