急性脑梗死早期外周血淋巴细胞亚群的变化及其意义
罗焕,蒋超,朱丽,左方芳,田宁,孙璐
郑州大学第五附属医院神经内科,河南郑州 450052
脑卒中是一种高致残率、高死亡率的急性脑血管事件[1],在我国以及世界范围都已成为人类死亡和致残的重要病因之一,危害人类生命健康,降低生活质量,对患者家庭以及整个社会造成沉重负担。据全球疾病负担调查分析,卒中是全球范围内生命损失第三大原因[2]。
脑卒中主要包括缺血性卒中和出血性卒中两种,其中缺血性卒中占所有脑卒中患者的70%~80%。缺血性脑卒中又称“脑梗死”,脑梗死不仅导致神经元死亡、颅内炎症反应,还能引起机体免疫系统改变[3]。淋巴细胞是机体的主要免疫细胞,在细胞免疫应答中发挥重要作用,可辅助体液免疫应答。脑梗死的发生发展过程与免疫系统之间关系的研究正在逐步展开,但各研究结果不尽相同,且对Th17细胞、Treg细胞研究较少。为探讨淋巴细胞亚群(如Th细胞、Tc细胞、NK细胞、B细胞、Th17细胞、Treg细胞)在急性脑梗死早期中的变化及其意义,该院于2016年6月—2017年6月收集急性脑梗死患者的外周血,进行淋巴细胞亚群测定,现报道如下。
1 资料与方法
1.1 一般资料
该病例对照研究连续纳入了入住该院的急性脑梗死患者50例作为研究对象,均符合2010年中国急性缺血性脑卒中诊治指南[4],选取同时期门诊健康体检者50名作为对照组。其中男女比例均为1:1,年龄均大于40岁,两组病例的一般临床资料特点见表1。入选标准:急性脑梗死发生12 h之内入院且NIHSS评分≥4分(出血性卒中动物实验模型显示脑损伤体积影响细胞和体液免疫[5])。剔除标准:入院时伴有感染症状,伴有实验室检查指标(如血尿常规、ESR等)异常,恶性肿瘤,近期服用抗炎及免疫抑制剂等药物。50名健康体检者在此前的体格检查和常规实验室检查均属于健康状态,同样按照上述纳入标准和剔除标准筛选。该项检测经伦理委员会认可,所有研究对象及其家属均签署知情同意书,所有操作均符合无菌操作原则。
1.2 检测方法
所有研究对象均于入院首个清晨空腹静脉取血等5 mL。淋巴细胞亚群检测:应用该院检验科提供的美国BD公司的FACSCalibur流式细胞仪及美国BD公司生产的抗体:总淋巴细胞(CD45),Th细胞(CD3、CD4)、Tc 细胞(CD3、CD8)、NK 细胞(CD16、CD56)、B细 胞 (CD19)、Th17 细 胞 (CD4、IL17A)、Treg 细 胞(CD4、CD25、FoxP3)。测定结果采用 CellQuest功能软件进行数据获取与分析。
1.3 统计方法
采用SPSS 13.0统计学软件对数据进行统计学分析,计量资料以均数±标准差(±s)表示,采用独立样本t检验进行分析,计数资料以百分比(%)表示,采取χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 比较两组一般临床资料
脑梗死组年龄(57.43±16.72)岁,对照组(60.67±10.45)岁(t=0.726,P>0.05),两组一般资料差异无统计学意义(P>0.05),具有可比性,见表 1。
2.2 比较两组淋巴细胞亚群的比例
比较两组外周血中淋巴细胞亚群Th细胞、Tc细胞、NK细胞、B细胞、Th17细胞、Treg细胞占总淋巴细胞的百分比(%),对照组总外周血淋巴细胞数为5.23×109/L,脑梗死组总外周血淋巴细胞数为11.96×109/L。脑梗死组较对照组Th细胞、Tc细胞、NK细胞、B细胞比例降低,差异有统计学意义(P<0.05),Th17细胞、Treg细胞比例升高,差异有统计学意义 (P<0.05)。 见表 2。

表1 两组病例一般资料特点的比较
表2 两组病例外周血淋巴细胞亚群占总淋巴细胞比例的比较[(±s),%]
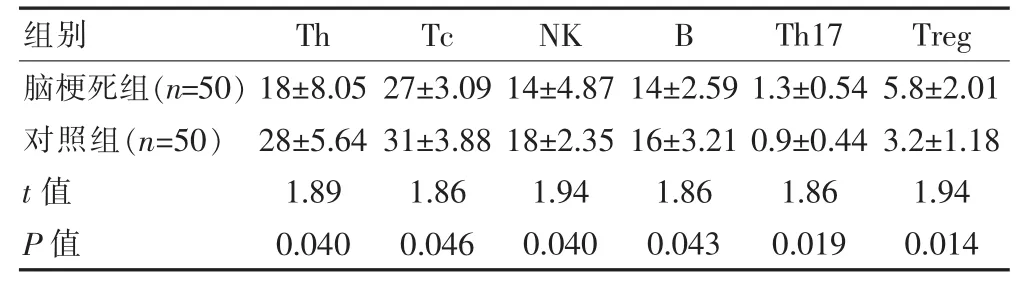
表2 两组病例外周血淋巴细胞亚群占总淋巴细胞比例的比较[(±s),%]
组别Th Tc NK B Th17 Treg脑梗死组(n=50)对照组(n=50)t值P值18±8.05 28±5.64 1.89 0.040 27±3.09 31±3.88 1.86 0.046 14±4.87 18±2.35 1.94 0.040 14±2.59 16±3.21 1.86 0.043 1.3±0.54 0.9±0.44 1.86 0.019 5.8±2.01 3.2±1.18 1.94 0.014
3 讨论
研究发现脑卒中可导致神经-免疫系统紊乱,1974年Orra等[6]报导了脑卒中后免疫抑制,1977年Beseclovsky等[7]提出神经-内分泌-免疫网络假说,神经、内分泌和免疫系统之间的相互关系的研究越来越多。Barclay Sd等[8]研究认为,T细胞上CD3+分子的减少可降低对抗原提呈细胞上的主要组织兼容性复合体抗原决定簇识别能力,从而减弱机体的免疫功能。目前,急性脑梗死与免疫系统的关系尚不明确,该研究旨在通过分析急性脑梗死早期患者外周血淋巴细胞亚群的变化,来探索脑梗死后免疫系统的变化。
免疫系统是由多种免疫器官、免疫细胞和全身各级淋巴管构成,免疫应答可分为体液免疫应答和细胞免疫应答2种。在正常免疫应答过程中,淋巴细胞群及其亚群之间相互作用,从而完成对抗原物质的识别、免疫应答和清除,从而维持机体正常的免疫系统的稳定。淋巴细胞是机体免疫系统的主要免疫细胞,不仅参与体液免疫应答,而且在细胞免疫应答中发挥重要作用。在外周血中淋巴细胞约占白细胞的20%~45%。淋巴细胞可分为T细胞、B细胞、NK细胞等,并可以进一步分为若干亚型。CD3+T是总T淋巴细胞,它主要分为两个亚群,即CD3+CD4+T(Th)细胞和CD3+CD8+T(Tc)细胞。Th细胞又可分为Th1细胞、Th2细胞、Th3细胞、Th17细胞等。近年来,又命名了一种新的具有免疫抑制作用的Th细胞,即调节性T细胞(Treg细胞)。NK细胞是自然杀伤细胞,参与固有免疫应答,能直接杀伤靶细胞,此外尚具有免疫调节功能[9]。
淋巴细胞及其亚群在免疫应答反应中起重要作用,目前Treg细胞在脑卒中中的变化及作用存在争议[10-11]。与前人的动物实验研究相似[10],该次发现急性脑梗死患者外周血 Th17 细胞[(1.3±0.54)%vs (0.9±0.44)%]、Treg 细胞[(5.8±2.01)%vs (3.2±1.18)%]的比例较正常对照组升高了,然而Th细胞(18±8.05)%vs(28±5.64)%、Tc 细胞[(27±3.09)%vs (31±3.88)%]、NK 细胞[(14±4.87)%vs (18±2.35)%]、B 细胞[(14±2.59)%vs (16±3.21)%]的比例降低了。这说明了急性脑梗死早期存在机体免疫系统的紊乱,淋巴细胞亚群数量有所变化。据报导,在炎症反应中Th细胞能够加剧炎症反应,而Treg细胞发挥炎症抑制作用[12-13];在脑梗死后Th17细胞的数量与比例均明显升高,加重脑组织损伤[12,14];在脑血管病相关炎症反应过程中若Treg细胞缺如或功能受到抑制则能够促进脑损伤相关的炎症反应,并能够加重神经功能的缺损程度[15]。该实验研究结果结合上述研究报导说明在急性脑梗死后Th17细胞数量增加,可促进脑卒中后炎症反应,而Treg细胞数量有所增加,能够抑制脑卒中后炎症及免疫反应,抑制神经功能缺损。B细胞主要参与体液免疫反应,该研究中B细胞较对照组有所减少,可能是急性脑梗死后体液免疫反应受到抑制所致;NK细胞是自然杀伤细胞,该研究中NK细胞较对照组有所减少,说明急性脑梗死后可能发生了自然杀伤作用或者免疫调节作用;Tc细胞是细胞毒性细胞,该研究中Tc细胞较对照组有所减少作用,说明在急性重症脑梗死时可能产生细胞毒性作用杀伤靶细胞,或者细胞毒性作用被抑制,这可能与机体感染和神经保护机制有关。
综上所述,急性脑梗死患者早期免疫功能的变化与脑卒中患者发病及病情变化相关。急性脑梗死早期患者免疫系统受到抑制,这可能是由于脑组织缺血缺氧受损后,神经-内分泌-免疫网络紊乱,使机体细胞免疫和体液免疫受到抑制,从而发生卒中后免疫抑制综合征。也可能与脑卒中后外周血Th17细胞、Treg细胞的比例变化相关。免疫因素在急性脑梗死早期中的作用及其相互作用机制还有待进一步探讨。
[1]Ay H,Arsava EM,Andsberg G,et al.Pathogenic ischemic stroke phenotypes in the NINDS-stroke genetics network[J].Stroke,2014,45(12):3589-3596.
[2]GBD 2013 Mortality and Causes of Death Collaborators.Global,regional,and national age-sex specific all-cause and cause-specific mortality for 240 causes of death,1990-2013:a systematic analysis for the Global Burden of Disease Study 2013[J].Lancet,2015,385(9963):117-171.
[3] Shichita T,Ago T,Kamouchi M,et al.Novel therapeutic strategies targeting innate immune responses and early inflammation after stroke[J].J Neurochem,2012,123 Suppl 2:29-38.
[4]中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南2010[J].中华神经科杂志,2010,43(2):146-153.
[5]IIIanes S,Liesz A,Sun L,et al.Hematoma size as major modulator of the cellular immune system after experim ental intracerebral hemorrhage[J].Neurosci Lett,2011,490(3):170-174.
[6]Howard RJ,Simmons RL.Acquired immunologic deficie ncies after trauma andsurgical procedures[J].Surg Gynecol Obstet,1974,139(5):771-182.
[7]Besedovsky H,Sorkin E.Network of immune-neuroendo crine interactions[J].Clin Exp Immunol,1977,27(1):1-12.
[8]Urra X,Obach V,Chamorro A.Stroke induced immunodepression syndrome:from bench to beside[J].Current Molecular Medicine,2009,9(2):195-202.
[9]龚非力.医学免疫学 [M].3版.北京:人民卫生出版社,2011:115-124.
[10]Wang J,Yu l,Jiang C,et al.Cerebral ischemia increases bone marrow CD4+CD25+FoxP3+regulatory T cells in mice via signals from sympathetic nervous system[J].Brain Behav Immun,2015,43:172-183.
[11]Kleinewietfeld M,Hafler DA.The plasticity of human Treg and Th17 cells and its role in autoimmunity[J].Semin Immunol,2013,15,25(4):305-312.
[12]Liesz A,Hu X,Kleinschnitz C,et al.Functional role of reg ulatory lymphocytes in stroke:facts and controversies[J].Stroke,2015,46(5):1422-1430.
[13]Siniscalchi A,Gallelli L,Malferrari G,et al.Cerebral stroke injury:the role of cytokines and brain inflammation[J].J Basic Clin Physiol Pharmacol,2014,25(2):131-137.
[14]Yang Z,Yu A,Liu Y,et al.Regulatory T cells inhibit microglia activation and protect against inflammatory injury in intracerebral hemorrhage[J].Int Immunophar macol,2014,22(2):522-525.
[15]Na SY,Mracsko E,LieszA ,etal.Amplification of regulatory T cell using a CD28 superagonist reduces brain damage after ischemic stroke in mice[J].Stroke,2015,46(1):212-220.

