支持向量机CT引导下肺穿刺活检气胸预测模型的研究
吴虹霖, 雷丽程, 杨茂江, 蒋小凤, 王 朗, 李 杨, 杨汉丰
CT引导下经皮胸腔肺穿刺活检(percutaneous transthoracic needle biopsy,PTNB)广泛应用于肺部病变的诊断,尤其是辨别肺部病变的良恶性。该检查准确率高、安全性好、并发症少[1]。气胸是其最常见的并发症,发生率为4%~62%[2-3]。既往研究大多探讨气胸的风险因素,鲜见气胸预测模型的建立。近年来,人工智能和机器学习算法对疾病的早期诊断和风险预测成为一大热点,如诊断冠状动脉疾病和前列腺癌[4-5],预测癌症存活率等[6]。
本文基于以往文献报道和临床经验总结的气胸风险因素,联合机器学习的方法,旨在构建具有较高判别能力的气胸预测模型。该模型可作为初步筛选工具,用于识别CT引导下PTNB术后发生气胸的高危患者,有助于医师优化穿刺路径以降低气胸发生率。
1 材料与方法
1.1 临床资料
回顾性分析2016年11月—2017年4月于我院介入室行CT引导下PTNB患者528例,其中53例发生气胸,气胸发生率为10.0%。纳入标准:川北医学院附属医院PACS系统检索肺穿刺活检患者;院内进行病理诊断。排除标准:病灶最大直径<5 mm;病灶属于纵隔内或胸膜肿块;影像资料不完整。本研究中机器学习方法在两样本数量(气胸/非气胸)接近的情况下能更快地得到更好的预测模型,因此,共计纳入94例患者(气胸组/非气胸组为43/51),其中男62例,女32例,年龄为37~84岁,平均(61.1±9.6)岁。本研究经本院伦理委员会批准,所有患者均知晓手术目的及风险,并签署知情同意书。
1.2 方法
1.2.1 术前准备 所有患者术前(1个月内)经胸部CT平扫和增强扫描或PET-CT检查发现肺部结节,需行CT引导下PTNB明确病灶性质。所有患者在手术前1 d接受血常规、凝血功能及心电图检查。抗凝血剂或抗血栓药物在手术前停用3 d以上,术前禁食4 h。
1.2.2 穿刺手术 手术由2名经验丰富(5年工作经验以上)的介入医师执行。采用16排螺旋CT扫描仪(16-MDCT: MX,Phillips Medical Systems,Best,Netherlands),管电压 120 kV,管电流 120 mAs,层厚2~3 mm,螺距1~2 mm。患者取仰卧位或俯卧位,在工作站确定体表穿刺点、角度及深度,并于体表做标记。消毒、铺巾,以1%利多卡因局部浸润麻醉。采用18 G或 19 G同轴活检针(C2016B,Bard)按预定穿刺路径进针至病灶内,联合20 G切割针(MN2016,Bard)和自动活检枪在病灶内不同方位取材2次。术毕取针,压迫包扎穿刺点后行胸部CT扫描观察有无气胸、出血等并发症。
1.2.3 术后处理 术后患者需留院观察至少4 h。根据脏壁层胸膜间最大距离将气胸分为少量气胸(<2 cm)、中量气胸(2~4 cm)和大量气胸(>4 cm)。少量气胸一般不需要处理,嘱患者静卧休息;中~大量气胸者、气胸进行性增加者或存在胸闷、呼吸困难等临床症状者采用气体抽吸、胸腔置管术等处理措施。
1.2.4 数据收集 于我院PACS系统上获取所有患者的相关参数,见表1,包括患者基本信息:性别和年龄;病灶相关因素:大小、深度(胸膜到病灶边缘最小长度)、位置(上/中/下叶)、病灶内是否存在空洞,病灶周围是否存在肺气肿或肺大泡、病灶周围是否有局限性炎症;穿刺活检术中相关因素:术中体位、穿刺针经过通气肺组织的长度、穿刺针胸膜下进针深度、进针角度(穿刺针与进针点胸膜切线的最小夹角)、手术时间、穿刺针是否经过胸膜凹陷、穿刺次数(图 1)。
1.3 统计学方法
采用SPSS 19.0进行统计学描述。连续变量采用均数和标准差(x±s)表示,分类变量采用频数(f)和频率(%)表示。1.4 预测模型
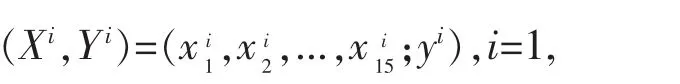
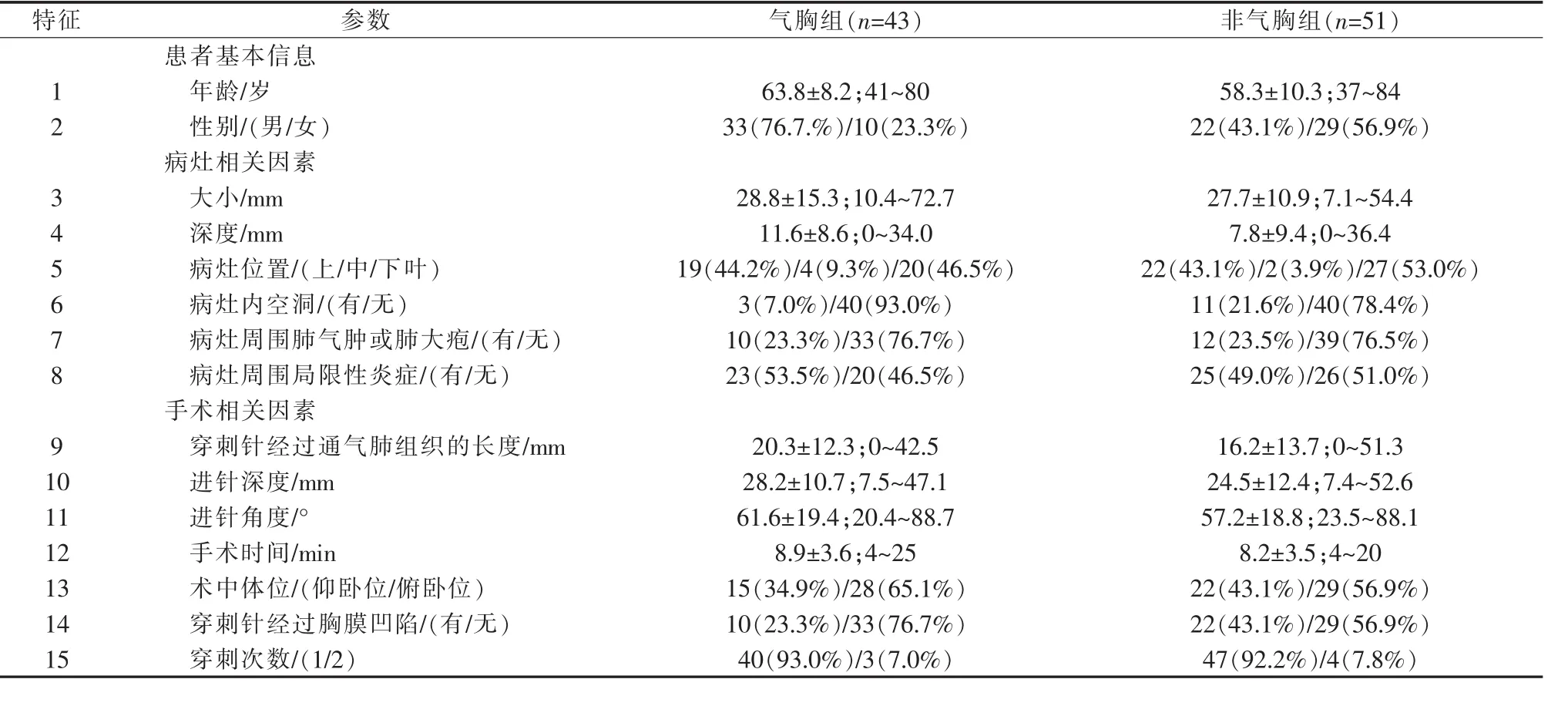
表1 气胸风险因素
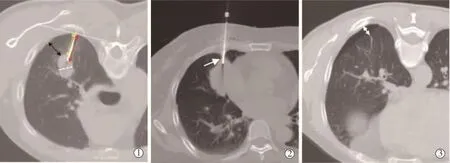
图1 穿刺途径的选择

图2 气胸预测模型的流程
1.4.1 预处理阶段 由于每个特征的单位和范围是不同的,需要将其标准化,使特征之间具有可比性。在预处理阶段,本文使用最大最小标准化进行标准化,将特征标准化到[0,1]范围内。最大最小值
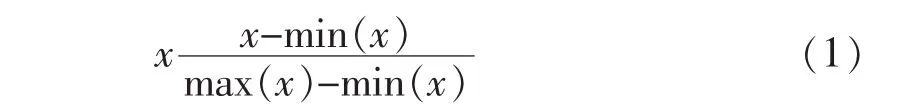
其中 x 是特征,max(x)和 min(x)分别是 x 在所有样本中的最大值和最小值。
1.4.2 特征选择阶段 根据每个特征对气胸的重要性和相关性进行排序。然后基于机器学习模型,通过递归特性消除算法来选择合适的特性子集[7]。实验使用了R语言的“caret”包来进行特征选择。
1.4.3 预测阶段 基于SVM、神经网络(neural networdks,NN)和随机森林(random forest,RF)3 个机器学习模型[8],输入与气胸相关的特性,预测气胸的发生。实验设置如下:使用80%样本来训练模型,20%样本来验证。采用10折交叉验证进行验证。SVM模型中使用高斯核函数,NN模型中使用径向基函数和50个隐藏神经元,RF模型中使用500棵树。为了得到可靠的错误估计,重复实验10次,对标准化根据公式(1)进行。结果计算平均值。实验使用R语言的“e1071”包实现SVM模型,分别实现NN模型和RF模型。
2 结果
2.1 患者基本资料
将94例患者分为气胸组45.7%(43/94)和非气胸组54.3%(51/94),患者基本信息、病灶及手术相关因素如表1所示。术后少/中/大量气胸者为32/7/4例。术后无迟发性气胸。
2.2 特征选择
当特征数量达到6~8时,SVM分类精度最高,而且比其它两个模型的所有情况分类精度更高。因此特征选择出前8项气胸的风险因素,按重要性的大小依次为:病变深度、年龄、大小、进针深度、穿刺针经过通气肺组织的长度、进针角度、穿刺针过胸膜凹陷及性别。图3、图4。
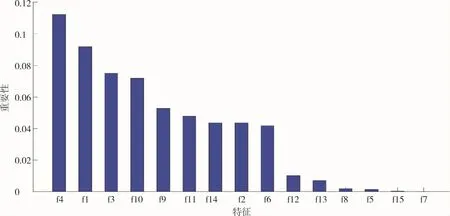
图 3 特征重要性排序(对应表1)
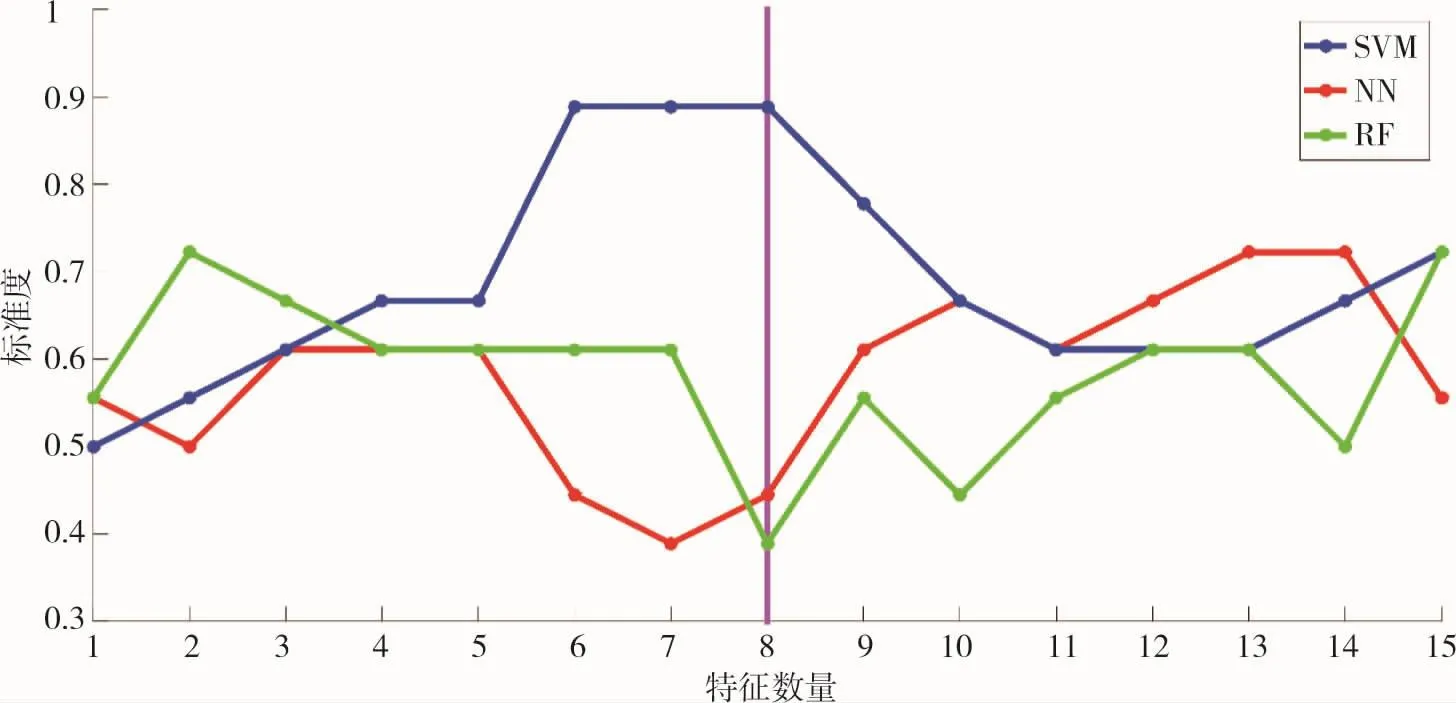
图4 不同特征数量和分类精度之间的关系
2.3 预测模型
基于特征选择获得的气胸风险因素,SVM、NN、RF对气胸的预测准确性分别为88.9%、44.4%、38.9%,灵敏度为71.4%、14.3%、28.6%,特异度为100%、63.6%、45.5%。SVM预测性能较NN和RF更好。而NN和RF模型不论在多少特征数量下,均不能取得较好的分类精度,主要是因为在训练数据上发生了过拟合现象,不能很好的预测新样本。SVM模型在训练和验证数据方面都有着较好的性能,没有发生过拟合现象,能更加客观和准确地预测气胸。表2。
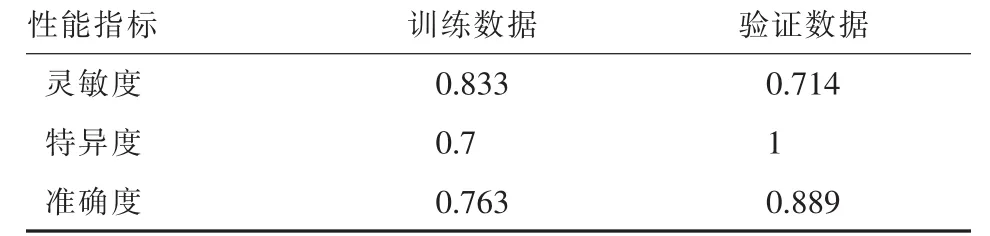
表2 在训练和验证数据中SVM模型的性能
3 讨论
目前,基于流行病学资料对气胸的研究主要是采用统计学方法分析气胸的风险因素以及建立气胸风险模型。许泽兵等[9]采用逻辑回归方法分析了气胸的风险因素。Anzidei等[10]基于多个风险因素提出了气胸风险模型(models of risks,MoRs)来预测气胸。Chiappetta等[11]提出的气胸预测模型的准确性超过75%。本研究属于回顾性研究,SVM等机器学习方法是利用计算机对既往患者的临床资料的学习过程。SVM联合患者基本信息、病灶及手术相关因素,建立了一个可行的气胸预测模型,它具有较高的诊断准确性(88.9%)。与常用的分类算法相比,在小样本、高维度的情况下,SVM往往可能更具优越性和合理性[5]。此模型可作为程序存储在电脑中,临床医师将风险因素输入程序,该模型自动预测患者是否发生气胸。该模型有助于临床医师识别高风险气胸患者,提前完善处理措施;有助于术者优化穿刺路径,尽量减少患者术中相关危险因素的暴露,有效地预防气胸的发生。
本研究发现病变深度、患者年龄、病灶大小、进针深度、穿刺针经过通气肺组织的长度、进针角度、穿刺针过胸膜凹陷及性别与气胸的发生密切相关。多项因素与以往研究结果类似[9,12-16],尚未见穿刺针经过胸膜凹陷与气胸发生相关性的研究。
病变深度是气胸最重要的风险因素,与以往研究报道相似。陈万海等[12]认为病灶深度是气胸发生的危险因素(P=0.02)。多项研究[17-18]表明 气胸发生率随病灶深度增加而增高。本研究发现年龄与气胸的发生亦存在关系,与既往研究结果类似。许泽兵等[9]发现年龄>60岁是气胸重要的风险因素(P=0.01)。何闯等[13]发现年龄每增加 10岁,气胸发生的风险将增加2.102倍。这可能与年龄较高者肺组织弹性较低、基础肺功能降低有关[14];此外,与老年患者对手术配合程度较差有关,如不能配合憋气或出现术中咳呛。气胸发生率与病灶大小呈负相关[19],本研究支持以往报道结果。朱柠等[14]认为,越小的病灶会增加穿刺的难度,反复多次操作潜在地增加气胸发生风险。此外,多次调节针头方向将加重胸膜损伤引发气胸[20]。本研究发现气胸与进针深度相关。较长的进针深度可能需要多次调整穿刺针的进针方向,这可能会导致胸膜撕裂引发气胸[21]。Rizzo等[22]发现肺内进针深度每增加10 mm,发生气胸和肺实质性出血的风险将增加3%。杨肖华等[23]认为随着穿刺深度增加,损伤到较粗级别的支气管的机会增多,这可能会增加气胸发生率。既往研究报道[24]穿刺针经过通气肺组织的长度是气胸的重要风险因素,与本研究结果相符。Kakizawa等[25]发现穿刺针经过通气肺组织的长度与气胸的程度有关(P<0.05)。进针角度是气胸的风险因素[13],支持本研究结果。进针夹角每增加20°气胸风险将增加2.413倍,这可能是由于进针角度增加,出血的概率降低,而少量出血被认为是气胸的保护因素[13]。本研究发现穿刺针过胸膜凹陷是气胸的一个风险因素,这在既往研究中从未被提及。这可能由于穿刺针过胸膜凹陷,其经过通气肺组织的路径相对缩短,因此对肺实质损伤范围减少,降低气胸发生率。此外,笔者推断在进针过程中或调整进针方向时,经过胸膜凹陷的穿刺针可能会牵拉凹陷的胸膜,这可能会扩大穿刺点或导致肺实质损伤,增加气胸发生率。牵拉力使脏壁层胸膜分离将增大穿刺阻力,可能导致穿刺次数增加;胸膜腔扩大使负压增大,使空气更易进入胸膜腔,导致严重气胸[25]。此项风险因素有待进一步研究。本研究认为性别是气胸的风险因素,这可能与男性有更大的用力肺活量(forced vital capacity,FVC)预测百分比有关。Saji等[26]认为 FVC%预测值增大是气胸的独立风险因素(P=0.004 4),术中越大的呼吸动度将增加气胸发生率。此外,男性吸烟率较女性更高,吸烟可能会影响气胸发生率[9]。
除上述特征选择出的风险因素以外,本研究提及的其它PTNB术后气胸风险因素在以往研究中已有报道。本研究基于机器学习提出了一个联合多因素分析的气胸预测模型,但并不否定未被选中的因素与气胸发生存在关系,本文只是选取了相对更重要的风险因素。笔者认为需不断地更新风险因素并扩大受试者样本量,进一步探讨PTNB术后气胸风险因素。SVM气胸预测模型比NN和RF具有更高的有效性和泛化性,能够预测气胸的发生,有助于介入医师对高风险气胸患者的诊疗,降低气胸发生率。
本研究存在局限性:①我们基于患者基本信息,病变及手术相关因素建立了SVM预测模型,但未考虑到生物化学指标、遗传因素和医师经验等相关因素。②某些相关因素的低曝光率可能会影响结果。③存在测量误差。④部分患者于门诊行穿刺活检,无术后近期随访的影像学资料,本研究均认为无迟发性气胸。最后,本组数据均来自同一地区人群。
综上所述,本文首次应用特征选择和支持向量机的方法,基于气胸风险因素建立气胸预测模型。本研究认为SVM气胸预测模型是一种可行的、实用的、较准确的分类器,有助于临床医师优化诊疗方式,降低气胸发生率。
[1] 许 彪,陈 刚,韦 璐.多层螺旋CT引导BARD活检枪经皮肺穿刺活检的临床应用[J].介入放射学杂志,2009,18:51-53.
[2] Laspas F,Roussakis A,Efthimiadou R,et al.Percutaneous CT-guided fine-needle aspiration of pulmonary lesions:results and complications in 409 patients[J].J Med Imaging Radiat Oncol,2008,52:458-462.
[3] Wallace MJ,Krishnamurthy S,Broemeling LD,et al.CT-guided percutaneous fine-needle aspiration biopsy of small(≤1-cm)pulmonary lesions[J].Radiology, 2002, 225: 823-828.
[4] Arabasadi Z,Alizadehsani R,Roshanzamir M,et al.Computer aided decision making for heart disease detection using hybrid neural network-genetic algorithm[J].Comput Methods Programs Biomed,2017,141:19-26.
[5] 李 梅,张 伟,李永忠,等.支持向量机神经网络在判别前列腺癌中的应用研究[J].四川大学学报·医学版,2013,44:666-668.
[6] Gupta S,Tran T,Luo W,et al.Machine-learning prediction of cancer survival:a retrospective study using electronic administrative records and a cancer registry[J].BMJ Open, 2014, 4: e004-e007.
[7] 尹祖钰.基于主成分分析和递归特征消除的支持向量机分类方法研究[D].哈尔滨工业大学,2016.
[8] Abreu PH, Santos MS, Abreu MH.Predicting breast cancer recurrence using machine learning techniques:a systematic review[J].ACM Comput Surv, 2016, 49: 1-40.
[9] 许泽兵,翟昭华,何 菲,等.CT引导下经皮肺穿刺活检并发症的相关因素Logistic分析[J].川北医学院学报,2011,26:167-171.
[10] Anzidei M, Sacconi B, Fraioli F, et al.Development of a prediction model and risk score for procedure-related complications in patients undergoing percutaneous computed tomography-guided lung biopsy[J].Eur J Cardiothorac Surg, 2015, 48: e1-e6.
[11] Chiappetta M, Rosella F, Dall'armi V, et al.CT guided fineneedle agobiopsy of pulmonary nodules:predictive factors for diagnosis and pneumothorax occurrence[J].Radiol Med, 2016,121:635-643.
[12]陈万海,沈晓文,孙新刚,等.经皮肺活检常见并发症风险因素分析[J].介入放射学杂志, 2012, 21: 168-171.
[13] 何 闯,李 扬,杨 丽,等.CT引导下肺实性结节切割活检术后出血与气胸的多因素分析[J].介入放射学杂志,2017,26: 654-659.
[14]朱 柠,何 剑,夏敬文,等.CT引导下经皮肺穿刺并发症的影响因素[J].临床肺科杂志, 2014, 19: 483-485.
[15]陈克敏,黄 蔚,吴志远.CT引导下肺活检和并发症的预防[J].介入放射学杂志, 2011, 20: 163-165.
[16]李国栋,周正荣,李文涛,等.CT导引下经皮肺组织活检术常见并发症及穿刺体会[J].介入放射学杂志,2007,16:847-849.
[17] Min L,Xu X,Song Y,et al.Breath-hold after forced expiration before removal of the biopsy needle decreased the rate of pneumothorax in CT-guided transthoracic lung biopsy[J].Eur J Radiol, 2013, 82: 187-190.
[18] Akkermans R.2013 annual congress of the European Respiratory Society[J].Lancet Respir Med, 2013, 1: 594-595.
[19]Yeow KM,Su IH,Pan KT,et al.Risk factors of pneumothorax and bleeding-multivariate analysis of 660 CT-guided coaxial cutting needle lung biopsies[J].Chest, 2004, 126: 748-754.
[20] Niu XK, Bhetuwal A, Yang HF.CT-guided core needle biopsy of pleural lesions:evaluating diagnostic yield and associated complications[J].Korean J Radiol, 2015, 16: 206-212.
[21] Cox JE, Chiles C, McManus CM, et al.Transthoracic needle aspiration biopsy: variables that affect risk of pneumothorax[J].Radiology, 1999, 212: 165-168.
[22] Rizzo S,Preda L,Raimondi S,et al.Risk factors for complications of CT-guided lung biopsies[J].Radiol Med, 2011, 116: 548-563.
[23]杨肖华,黄新宇,汪国祥.CT引导下经皮肺穿刺活检术并发症的影响因素分析[J].介入放射学杂志,2013,22:658-662.
[24]Nour-Eldin NE, Alsubhi M, Emam A, et al.Pneumothorax complicating coaxial and non-coaxial CT-guided lung biopsy:comparative analysis of determining risk factors and management of pneumothorax in a retrospective review of 650 patients [J].Cardiovasc Intervent Radiol, 2016, 39: 261-270.
[25]Kakizawa H,Toyota N,Hieda M,et al.Risk factors for severity of pneumothorax after CT-guided percutaneous lung biopsy using the single-needle method[J].Hiroshima J Med Sci, 2010, 59:43-50.
[26] Saji H,Nakamura H,Tsuchida T,et al.The incidence and the risk of pneumothorax and chest tube placement after percutaneous CT-guided lung biopsy:the angle of the needle trajectory is a novel predictor[J].Chest, 2002, 121: 1521-1526.

