微导管复合塑形在弹簧圈栓塞伴有胚胎型大脑后动脉的破裂后交通动脉瘤术中的应用
杜世伟, 李静伟, 陈 健, 刘 洋, 孙力泳, 李桂林, 张鸿祺
伴有胚胎型大脑后动脉(fetal posterior cerebral artery,fPCA)的后交通动脉瘤(posterior communicating artery aneurysm,PCoAA)临床上常见,治疗相对困难[1-4]。治疗中需将瘤腔隔绝于循环外,还需保持后交通动脉通畅,否则可能造成丘脑和大脑后动脉供血区域大面积梗死[5]。血管内介入栓塞是治疗破裂动脉瘤重要手段之一,主要方法包括单纯弹簧圈栓塞和支架辅助弹簧圈栓塞[6]。但由于担心支架辅助栓塞后抗血小板治疗会增加破裂动脉瘤再破裂危险,多数情况下更倾向于急性期单纯弹簧圈栓塞治疗[7-8]。微导管塑形是动脉瘤栓塞术中关键技术,是实现栓塞策略的保障,对单纯弹簧圈栓塞中小型(<10 mm)动脉瘤尤为重要[9-11]。本研究采用微导管复合塑形、单纯弹簧圈栓塞治疗急性期伴有fPCA的中小型破裂PCoAA患者,取得较好效果,现报道如下。
1 材料与方法
1.1 临床资料
收集2015年6月至2016年12月首都医科大学宣武医院采用微导管复合塑形、单纯弹簧圈栓塞治疗的51例伴有fPCA的中小型破裂PCoAA患者,均经CT、DSA明确诊断为急性期蛛网膜下腔出血(SAH)性PCoAA,fPCA由患侧压颈试验及后循环造影明确。其中男37例,女14例;年龄41~72岁,平均(49±6)岁;病程 3~72 h,平均(10.1±3.4) h;首发症状为头痛46例(90.1%),患侧动眼神经麻痹5例(9.95%);Hunt-Hess分级Ⅰ级 14 例(27.5%),Ⅱ级 23例(45.1%),Ⅲ级 8例(15.7%),Ⅳ级 4例(7.8%),Ⅴ级 2例(3.9%)。瘤腔直径 2.1~10.0 mm,平均(6.1±1.8)mm;宽颈(颈体比大于 1 ∶2或颈宽度≥4 mm)21例(41.2%),窄颈 30例(58.8%);囊状45例(88.2%),分叶状 6例(11.8%)。
患者纳入标准:①CT证实入院前72 h内发生SAH;②CTA/DSA证实PCoAA伴fPCA,瘤腔直径≤10 mm;③责任动脉瘤为PCoAA;④微导管复合塑形技术行单纯弹簧圈栓塞;⑤患者或家属签署手术同意书;⑥临床随访(电话/门诊/住院)和影像学随访(CTA/DSA)6个月以上。排除标准:①PcoAA破裂出血>72 h;②多发颅内动脉瘤,但CT、DSA不支持PCoAA为责任病变;③采用其它血管内治疗或开颅动脉瘤夹闭治疗;④6个月以上随访信息缺乏;⑤并发其它疾患,预期寿命不足6个月。
1.2 介入治疗
手术在气管插管全身麻醉下进行,DSA造影明确责任病灶PCoAA伴同侧fPCA后作患侧颈内动脉3D旋转造影,根据重建图像复合塑形微导管;路图下通过直接推送微导管到位或通过微导丝将微导管导引至动脉瘤远端,回拉微导管到位;根据瘤体形态大小及与后交通动脉关系,顺次填入弹簧圈,直至填塞满意(填塞过程需不断调整弹簧圈和微导管,避免误栓后交通动脉)。
复合塑形微导管方法要点:①测量瘤体轴线方向与载瘤动脉角度、瘤体中心至载瘤动脉对侧血管壁距离,确定微导管头端第1弯曲塑形;②根据瘤体至颈内动脉虹吸弯距离确定微导管第2弯曲位置;③观察虹吸弯平面与瘤体指向关系,将第1弯向左或向右形成对应角度,确定微导管头端指向;④如果载瘤动脉床突上段迂曲明显,可于微导管2弯曲间加塑弯曲,使之能与血管壁有更好贴合。
1.3 评价标准
观察评价术中微导管塑形准确性、微导管塑形稳定性、栓塞操作相关并发症(术中血栓事件、瘤体再破裂等)、动脉瘤栓塞程度和后交通动脉保留程度(术后即刻和随访时)、随访时神经功能恢复情况。
根据微导管到位方式(直接推送到位,微导丝导引微导管至动脉瘤远端后再回拉微导管到位,微导丝直接导引到位)、微导管头端与瘤体长轴吻合程度评价微导管塑形准确性,微导管到位后头端方向与瘤体长轴方向一致视为微导管塑形准确。根据栓塞过程微导管头端位置评价微导管塑形稳定性,成功完成瘤体栓塞前微导管头端位置稳定,无意外脱出视为微导管塑形稳定。根据Raymond分级评价动脉瘤栓塞程度(完全栓塞,瘤腔、瘤颈均未见对比剂充盈为1级;瘤颈残留,瘤颈有对比剂充盈为2级;瘤腔残留,瘤颈、瘤腔均有对比剂充盈为3级)。后交通动脉保留程度分为血流无影响、部分影响和闭塞。根据改良Rankin量表(mRS)评分评价神经功能恢复情况,0~2分为预后良好,4~6分为预后不良。
1.4 统计学分析
所有数据均经SPSS 16.0软件处理。患者年龄、病程、瘤腔直径、mRS评分等计量资料以均数±标准差表示,微导管塑形准确性、稳定性、并发症发生、动脉瘤栓塞程度、后交通动脉保留等计数资料以频数和百分比表示。
2 结果
51例51枚伴有fPCA的中小型破裂PCoAA均通过微导管复合塑形技术成功完成单纯弹簧圈栓塞(图1),术后即刻血管造影显示Raymond分级1级 43枚(84.3%),2级 8枚(15.7%);后交通动脉均保留,49例血流无影响,2例部分影响。1例术中发生破裂再出血,保守治疗后恢复良好(mRS评分1分)。
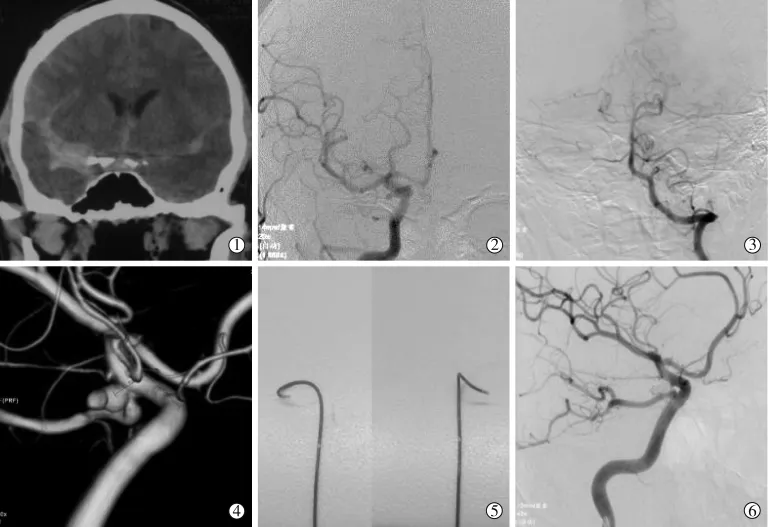
图1 微导管复合塑形技术行单纯弹簧圈栓塞影像
术中证实微导管塑形准确率为90.2%,其中微导管直接推送到位36例,回拉到位11例,导丝导引微导管到位4例;微导管到位后头端与瘤体长轴方向一致率为90.2%;栓塞过程微导管位置稳定率为 88.2%(表 1)。 术后随访 6~24 个月,平均(15±3)个月,mRS 评分为平均(0.9±0.3)分,48 例(94.1%)预后良好,3例(5.9%)预后不良,无患者死亡。术后6个月复查造影显示Raymond 1级41枚(80.4%),2级 8枚(15.7%),3级 2枚(3.9%)(表 1)。
3 讨论
临床上PCoAA伴fPCA并不罕见,前循环造影可发现瘤体位于颈内动脉和后交通动脉交界区,大脑后动脉P2以远分支经由同侧后交通动脉供血,而后循环造影常发现同侧P1段未见显影[12]。这种解剖发育的特殊性给此类动脉瘤治疗带来较大困难,尤其是介入栓塞治疗,既需致密栓塞动脉瘤,又需保持后交通动脉通畅,否则术后可能引起严重并发症[1,13-15]。 为了保护后交通动脉通畅,很多情况下需采用不同支架辅助栓塞术式,但对急性期破裂动脉瘤,支架辅助栓塞术后抗血小板治疗可能引起瘤体再破裂,因此越来越多学者提倡对急性期破裂动脉瘤尽可能采用单纯弹簧圈栓塞治疗[10,16-18]。
微导管塑形技术是动脉瘤栓塞基本技术,也是关键技术,是动脉瘤成功填塞的前提条件[9-11]。理想的微导管塑形,一可使微导管在无微导丝导引下沿血管顺行或逆行走行进入瘤腔,降低微导管到位时瘤体破裂风险;二可为微导管头端提供稳定支撑,降低弹簧圈填塞时微导管头端自瘤腔脱出风险,填塞时微导管头端呈笔刷样摆动表明微导管稳定;三可增加填塞时微导管可控性,一旦出现微导管头端提前脱出,其良好塑形有助于头端再次进入瘤腔,到达理想位置。只有在理想的微导管塑形保障下,才能增加填塞过程安全可控性。尤其是对PCoAA伴fPCA患者,既采用单纯弹簧圈栓塞,又保留后交通动脉的先决条件是微导管塑形理想。目前微导管塑形多取决于术者经验,通常有单弯塑形或复合塑形[9,11,18]。 复合塑形需根据瘤体长轴与载瘤动脉间角度、载瘤动脉近端走行及栓塞策略,相比单弯塑形提高了微导管到位性和微导管头端稳定性,尤其适合复杂部位动脉瘤栓塞。颈内动脉在虹吸弯处形成不同程度弯曲,随后多数情况下先向内、后向上外走行,发出后交通动脉。伴有fPCA的PCoAA多源于颈内动脉和后交通动脉分叉处,累及颈内动脉和部分/全部后交通动脉起始,瘤体指向可分为向后外侧、后内侧和后侧。微导管复合塑形前需在3D血管成像上测量瘤体轴线方向与载瘤动脉角度、瘤体中心至载瘤动脉对侧血管壁距离,以确定微导管头端第1弯曲位置;根据瘤体至颈内动脉虹吸弯距离,确定第2弯曲位置;观察虹吸弯平面与瘤体指向关系,将第1弯曲向左或向右形成对应角度,确定微导管头端指向。如果载瘤动脉床突上段迂曲明显,可在微导管2弯曲间加塑弯曲,使其能与血管壁有更好贴合。本组患者通过这种方式塑形微导管,走行完全符合血管解剖,结果有70.6%患者微导管直接推送顺利到位,90.2%患者微导管头端与瘤体长轴方向吻合,填塞时微导管第1弯曲抵靠载瘤动脉对侧血管壁,为填塞中微导管头端提供了稳固支撑,仅11.8%患者发生微导管意外脱出,但多可沿弹簧圈或通过直接推送再次到位;瘤腔均获Raymond 1、2级栓塞,其中58.8%为宽颈动脉瘤;后交通动脉均得到理想保留,无一发生术后再破裂。对于大/巨大动脉瘤,栓塞过程中不可避免地会出现微导管头端移位。即使按照以上塑形方法微导管可稳定到位,填塞过程中也极有可能在致密填塞瘤体前脱出,因此常需将头端塑形成大C状或猪尾状。由于复合塑形策略在大/巨大动脉瘤填塞中的作用并不如中小动脉瘤明显,本研究未纳入大/巨大动脉瘤患者。
微导管复合塑形目前还是一项经验性技术。一些研究尝试采用术前3D打印出的微导管计划形状指导微导管塑形[19]。这样可一定程度上降低主观因素影响,使微导管塑形更加合理。
本研究结论认为,微导管复合塑形增加了介入栓塞治疗伴有fPCA的急性期破裂PCoAA术中微导管到位性、可控性和稳定性,有助于对这一复杂类型PCoAA进行栓塞并保护血管,尤其适用于有单纯弹簧圈栓塞指征的中小型破裂动脉瘤,是一项安全可靠的介入治疗技术。本研究为小样本回顾性经验总结,尚需进一步开展对照研究。
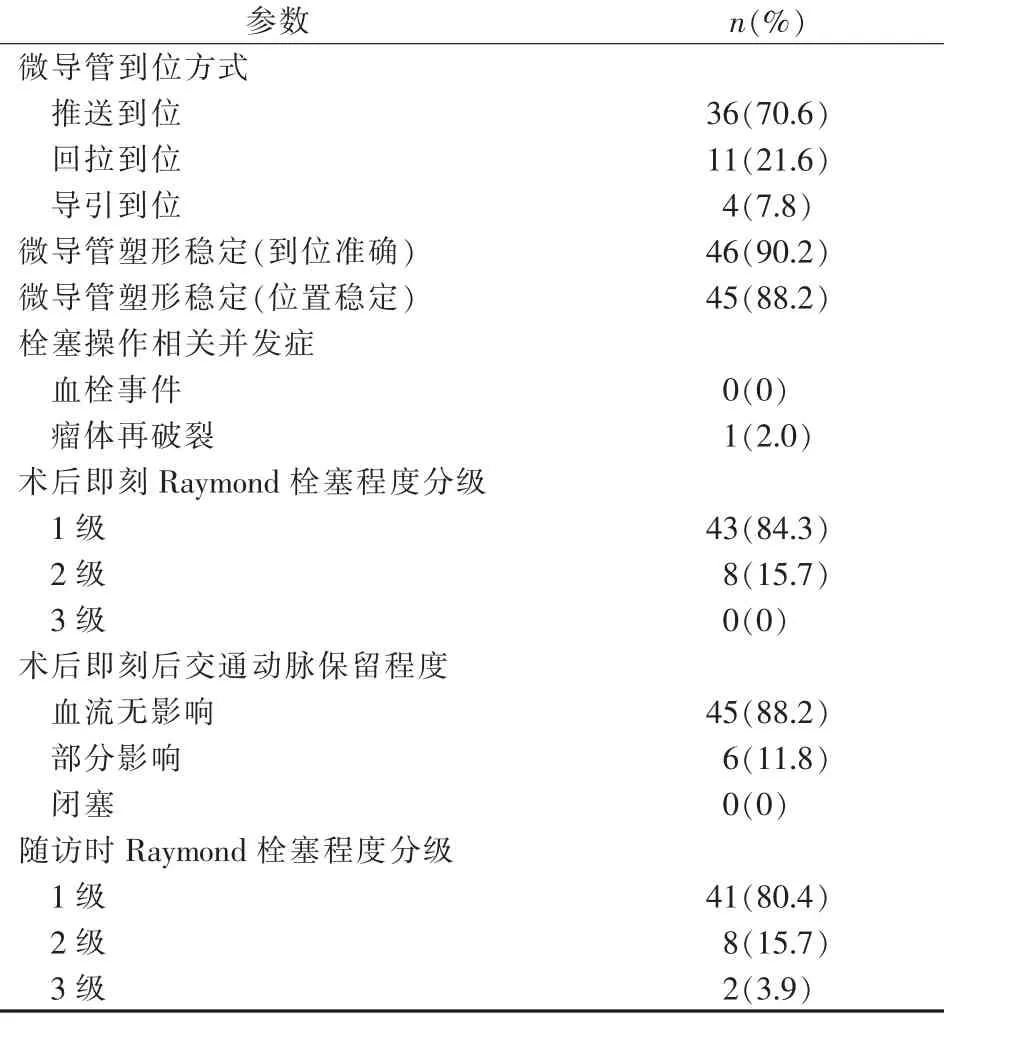
表1 51例患者术中栓塞及随访情况
[1] Matsumura H, Kato N, Fujiwara Y, et al.Endovascular treatments for posterior cerebral artery aneurysms and vascular insufficiency of fetal-type circulation after parent artery occlusion[J].J Clin Neurosci, 2016, 32: 41-46.
[2] Daou B,Valle-Giler EP,Chalouhi N,et al.Patency of the posterior communicating artery following treatment with the Pipeline Embolization Device[J].J Neurosurg, 2017, 126: 564-569.
[3] Vedantam A, Rao VY, Shaltoni HM, et al.Incidence and clinicalimplicationsofcarotid branch occlusion following treatment of internal carotid artery aneurysms with the pipeline embolization device[J].Neurosurgery, 2015, 76: 173-178.
[4] Kan P,Duckworth E,Puri A,et al.Treatment failure of fetal posterior communicating artery aneurysms with the pipeline embolization device[J].J Neurointerv Surg, 2016, 8: 945-948.
[5] Nakano Y,Saito T,Yamamoto J,et al.Surgical treatment for a ruptured true posterior communicating artery aneurysm arising on the fetal-type posterior communicating artery:two case reports and review of the literature[J].J UOEH, 2011, 33: 303-312.
[6] Chen Z, Niu Y, Tang J, et al.Endovascular treatment of posterior communicating artery aneurysms in the presence of the fetal variant of posterior cerebral artery[J].Interv Neuroradiol, 2015,21:456-461.
[7] Lü X,Li Y, Yang X, et al.Potential proneness of fetal-type posterior cerebral artery to vascular insufficiency in parent vessel occlusion of distal posterior cerebral artery aneurysms[J].J Neurosurg, 2012, 117: 284-287.
[8] Yoon PH,Lee JW,Lee YH,et al.Dual microcatheter coil embolization ofacutely ruptured wide-necked intracranial aneurysms[J].Interv Neuroradiol, 2017, 23: 477-484.
[9] 李 立,李天晓,薛绛宇,等.单纯弹簧圈栓塞治疗颅内微小动脉瘤[J].中华介入放射学电子杂志, 2015, 3: 60-62.
[10]彭 亚,宣井岗,陈荣华,等.血管内栓塞治疗颅内破裂微小动脉瘤的疗效分析[J].中国脑血管病杂志,2013,10:13-17.
[11] 刘 伟,郭庆东,付洛安,等.微导管塑形技术治疗颈内动脉-后交通动脉瘤[J].中华神经外科疾病研究杂志,2013,12:362-363.
[12] Bisaria KK.Anomalies of the posterior communicating artery and their potential clinical significance[J].J Neurosurg, 1984, 60:572-576.
[13]Bechan RS,Sprengers ME,Majoie CB,et al.Stent-assisted coil embolization of intracranial aneurysms:complications in acutely rupturedversusunruptured aneurysms[J].AJNR Am J Neuroradiol,2016, 37:502-507.
[14]Namba K,Higaki A,Kaneko N,et al.Microcatheter shaping for intracranial aneurysm coiling using the 3-dimensional printing rapid prototyping technology:preliminary result in the first 10 consecutive cases[J].World Neurosurg, 2015, 84: 178-186.
[15] Li H, Guan J, Liu J, et al.Treatment of acutely ruptured widenecked intracranial aneurysms using self-expanding stent[J].Int J Clin Exp Med,2015,8:1259-1264.
[16] Kim S, Choi JH, Kang M, et al.Safety and efficacy of intravenous tirofiban as antiplatelet premedication for stentassisted coiling in acutely ruptured intracranial aneurysms [J].AJNR Am J Neuroradiol, 2016, 37: 508-514.
[17]Li C, Li Y.Stent-assisted coiling of ruptured wide-necked intracranial aneurysms[J].Interv Neuroradiol, 2013, 19: 283-288.
[18] He W, Hauptman J, Pasupuleti L, et al.True posterior communicating artery aneurysms: are they more prone to rupture?A biomorphometric analysis[J].J Neurosurg, 2010,112:611-615.
[19]徐 超,王 波,韩建一,等.3D打印辅助微导管塑形在颅内动脉瘤栓塞术中应用[J].介入放射学杂志,2017,26:1-5.

