丙烯腈诱导的氧化应激对大鼠肝脏内质网应激信号通路的影响
潘丽,魏倩,高霞,石影,郑爱,薛红丽,李芝兰,*
1. 兰州大学公共卫生学院,兰州730000 2. 兰州市妇幼保健院,兰州730000
丙烯腈(acrylonitrile,ACN)是石化工业中合成腈纶纤维等高分子材料的重要中间单体[1],属于高毒类有机氰化物。Abo-Salem等[2]用50 mg·kg-1ACN对雄性Wistar大鼠染毒后,发现血清AST、ALT、直接胆红素、总胆红素升高,肝汇管区炎症、组织混乱,肝细胞毗邻的汇管区出现气球样变,淋巴细胞浸润及脂肪滴,Guang等[3]对大鼠ACN灌胃染毒后,发现大鼠肝脏组织MDA含量升高,CAT活性降低,GSH含量降低;金娜[4]对小鼠的研究也得到相似的结果,提示ACN可通过扰乱机体的氧化平衡状态,诱导实验动物肝组织损伤。彗星实验发现ACN染毒剂量与肝细胞DNA拖尾率存在剂量-反应关系,提示ACN可造成肝细胞DNA损伤[5]。
氧化应激是指因抗氧化机制受损引发的自由基和活性氧与蛋白、脂质及核酸等体内高分子反应,致使后者的结构功能出现损害的状态[6]。内质网应激(endoplasmic reticulum stress,ERS)是指当外界毒物或刺激引起内质网(endoplasmic reticulum,ER)的内环境发生改变,导致ER内未折叠蛋白或错误折叠蛋白堆积,ER为了应对其内环境的改变而发生的应激反应。最近几年的相关研究发现,大多数物质引起的肝脏损伤与氧化应激有关[7-8],而氧化应激的产物ROS,可通过氧化内质网膜,影响内质网膜上Ca2+离子泵的功能,引起细胞内Ca2+平衡紊乱,诱发ERS和细胞凋亡[9],故氧化应激是ERS的敏感因子。体外实验研究发现ERS诱导剂毒胡萝卜素(thapsigargin,TG)及布雷菲尔德菌素 A(blefeldans A,BFA)诱导的海马神经元细胞凋亡与细胞内ROS的积累有关,且芹菜素(apigenin,AP)、N-乙酰半胱氨酸(N-acetylcysteine,NAC)、GSH等抗氧化剂可明显通过抑制ROS的产生而降低TG及BFA引起的ERS,提示TG及BFA诱导海马神经元细胞ERS是通过ROS的积累产生氧化应激所致,AP可通过抗氧化的作用抑制ERS引起的细胞凋亡和ERS相关蛋白的表达[10],认为氧化应激可诱导ERS的产生。当发生ERS时,细胞可依赖相应的信号转导调节机制来应对ERS以保证细胞的正常功能。但当应激反应过强,机体无法完成损伤修复时,则启动相应的凋亡通路诱导细胞凋亡的发生。NAC是L-半胱氨酸的乙酰化合物,可通过干扰自由基的生成和清除已生成自由基来发挥抗氧化作用,增加机体应对氧化应激的能力。
近年来的研究发现,许多肝脏疾病的发病机制与ERS诱导的细胞凋亡相关[11],而关于ACN引起的肝损伤是否与ERS有关,目前尚未见报道。故本文以ACN对SD大鼠慢性染毒,同时设定N-乙酰半胱氨酸(NAC)干预组,探讨ACN慢性染毒引起大鼠肝脏氧化损伤对ERS信号通路的影响,为ACN肝脏毒性机制深入研究提供科学依据。
1 材料与方法(Materials and methods)
1.1 实验动物及分组
SPF级成年健康雄性SD大鼠50只,体重250~300 g,由甘肃中医药大学医学实验动物中心提供(动物合格证号:SCXK(甘)2011-0001),适应性饲养1周后,按照体重随机分为5组,每组10只,以12.5、25.0、50.0 mg·kg-1ACN[12]灌胃染毒,NAC组先用300.0 mg·kg-1NAC灌胃30 min后再灌50.0 mg·kg-1ACN[13],以玉米油(0.5 mL·(100 g)-1)作为阴性对照组,1次每天、6天每周,共计13周。大鼠染毒期间实验室温度(22±1)℃,湿度50%,昼夜交替各12 h,自由饮水,普通饲料喂养。
1.2 试剂
丙烯腈(分析纯,纯度>99%)购于天津四通化工厂,NAC购买于美国Amresco公司,GSH、GSH-Px、MDA、SOD、CAT试剂盒购于南京建成生物工程研究所,BCA蛋白定量试剂盒购于上海碧云天生物有限公司,GRP78一抗(兔抗大鼠)、CHOP一抗(小鼠抗大鼠)、caspase-12一抗(兔抗大鼠)购于美国SAB公司,GAPDH一抗(兔抗大鼠)购于美国Abcam公司,β-tubulin一抗(兔抗大鼠)、HRP标记的山羊抗兔二抗、HPR标记的山羊抗小鼠二抗购于Elabscience公司,引物由上海生物工程有限公司设计合成。
1.3 氧化还原相关酶的测定
染毒结束后,处死大鼠。每组随机选取6只大鼠,称取100~200 mg肝脏组织按重量(g):匀浆介质(mL)=1:9的比例充分研磨,低温离心(4 ℃,2 500 r·min-1,10 min)后分装上清,按照试剂盒操作说明的步骤完成氧化还原酶指标的测定。
1.4 RT-PCR检测步骤
实验开始前将所需实验器材高压灭菌,采用Trizol法提取肝脏总RNA,0.1% DEPC水溶解 RNA后测定RNA浓度并定量至500 ng·μL-1备用。根据20 μL RNA反转录反应体系(Total RNA 10 μL,RNase Free dH2O 6 μL,5×PrimeScript RT Master Mix Perfect Real Time 4 μL)条件,42 ℃反转录反应60 min后70 ℃加热5 min终止反应,完成肝脏RNA反转录为cDNA。采用实时荧光定量PCR检测肝脏组织GRP78、PERK、CHOP、caspase-12、β-actin mRNA表达水平(引物序列见表1),PCR反应体系为20 μL,反应条件为95 ℃预变性2 min,95 ℃变性10 s,55 ℃退火15 s,40个循环。最后采用Pfaffl法分析mRNA的相对表达量[14]。
1.5 Western Blot检测步骤
提取肝脏组织蛋白进行定量与变性制备蛋白样品,进行SDS-PAGE凝胶电泳,电泳结束后将目的蛋白转移至PVDF膜上,4 ℃、200 mA转膜75 min后220 mA转膜75 min。在TBST配制的5%脱脂奶粉中封闭3 h,4 ℃水平摇床过夜孵育一抗(GRP78、CHOP、caspase-12、GAPDH、β-tubulin*由于实验中目的蛋白分子量与内参蛋白分子量接近,选择一个内参蛋白无法区分,所以实验选择GAPDH、β-tubulin 2个内参蛋白。蛋白一抗用含5%脱脂奶粉的TBST稀释,稀释比例分别为1:500、1:1000、1:500、1:2000、1:1000),TBST漂洗5次,每次5 min,室温水平摇床孵育二抗2 h后(山羊抗兔单克隆二抗稀释比例为1:2000,山羊抗小鼠单克隆二抗稀释比例为1:4000,二抗均用5%TBST稀释),取出目的蛋白条带,TBST漂洗5次,每次5 min。将目的蛋白的PVDF膜放置在凝胶成像曝光仪中滴加ECL发光液曝光,保存目的蛋白条带,采用Image J图像分析软件进行蛋白条带灰度值分析,目的蛋白相对表达量的计算公式为:

1.6 统计分析
2 结果(Results)
2.1 ACN染毒及NAC干预对大鼠肝脏抗氧化能力及脂质过氧化的影响
单因素方差分析结果显示,低、中ACN组大鼠肝脏GSH含量与对照组比较均降低(P<0.05);低ACN组大鼠肝脏GSH-Px活力与对照组比较升高(P<0.05)。低、高ACN组大鼠肝脏SOD活力及MDA含量与对照组比较均升高(P<0.05)。中、高ACN组大鼠肝脏CAT活力与对照组比较均降低(P<0.05)。NAC干预后可逆转ACN诱导的大鼠肝脏GSH含量、MDA含量及SOD活力的改变。结果见表2。
2.2 ACN染毒及NAC干预对大鼠肝脏ERS相关基因表达水平的影响
RT-PCR结果显示,高ACN组大鼠肝脏GRP78、CHOP、caspase-12 mRNA表达水平与对照组比较均升高(P<0.05);低、中ACN组大鼠肝脏GRP78、CHOP mRNA表达水平与对照组比较均升高(P<0.05)。NAC干预后,大鼠肝脏CHOP、caspase-12 mRNA表达水平与高ACN组比较均降低(P<0.05)。结果见表3。

表1 引物序列Table 1 Primer sequence

表2 丙烯腈(ACN)染毒及N-乙酰半胱氨酸(NAC)干预对大鼠肝脏抗氧化能力及脂质过氧化的影响Table 2 Effects of acrylonitrile (ACN) on oxidative damage and lipid peroxidation and the intervention in effects of N-acetylcysteine (NAC) in rats liver
注:与对照组比较,*P<0.05,与高ACN组比较,#P<0.05。
Note: compared with control,*P<0.05; compared with high ACN group,#P<0.05.

表3 ACN染毒及NAC干预对大鼠肝脏内质网应激(ERS)相关基因表达水平的影响Table 3 Effect of ACN on expression of endoplasmic teticulum stress (ERS) related genes and the intervention in effects of NAC in rats liver
注:与对照组比较,*P<0.05,与高ACN组比较,#P<0.05。
Note: compared with control,*P<0.05; compared with high ACN group,#P<0.05.
2.3 ACN染毒及NAC干预对大鼠肝脏ERS相关蛋白表达水平的影响
Western Blot结果显示,高ACN组大鼠肝脏GRP78、CHOP、caspase-12蛋白表达水平与对照组比较均升高。NAC干预后,大鼠肝脏GRP78、CHOP、caspase-12蛋白表达水平与高ACN染毒组比较均降低。结果见表4。
3 讨论(Discussion)
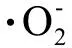

图1 ACN染毒及NAC干预对大鼠肝脏内质网应激相关蛋白表达水平的影响的免疫印记图Fig. 1 Western Blot analysis on effect of ACN on expression of ERS related proteins and the intervention in effects of NAC in rats liver

分组(Groups)GRP78CHOPcaspase-12对照组(Control)0.47±0.080.76±0.060.75±0.08高ACN组(50.0 mg·kg-1 ACN)0.93±0.13*1.05±0.10*1.07±0.13*NAC组(300 mg·kg-1 NAC+50 mg·kg-1 ACN)0.60±0.20#0.77±0.12#0.86±0.16#F16.14620.22110.179P0.0000.0000.002
注:与对照组比较,*P<0.05,与高ACN组比较,#P<0.05。
Note: compared with control,*P<0.05; compared with high ACN group,#P<0.05.
内质网是机体内蛋白质合成、折叠及运输场所,也是细胞内Ca2+储存的主要场所[19]。在紫外线、缺氧、营养物质缺乏、病毒、氧化应激、毒性物质等各类理化因素存在的情况下可损伤内质网的功能从而诱发ERS[20]。正常状态下,内质网中存在的分子伴侣葡萄糖调节蛋白78(glucose-regulated protein,GRP78)与内质网膜上的双链RNA样内质网激酶(double-stranded RNA like endoplasmic reticulum kinase,PERK)、活化转录因子6(activating transcription factor-6,ATF6)和肌醇需要酶1(inositol-requiring enzyme-1,IRE1)3种跨膜蛋白相互结合而没有活性,当ERS发生时,大量的未折叠蛋白或错误折叠蛋白将会在内质网腔内聚集而扰乱内质网的正常功能,此时GRP78将与3种跨膜蛋白发生解离,转而去结合堆积的未折叠或错误折叠蛋白,起到协助蛋白折叠的功能,降低ERS,因此GRP78已被广泛认为是ERS发生的标志性分子[21]。同时,与GRP78解离的3种感受蛋白被暴露激活,通过PERK、ATF6、IRE1这3种途径启动ERS。ERS作为细胞自我保护机制,正常情况下参与机体应对外在刺激的多重信号传导及基因网络调控,具有保护细胞维持其免受损伤的作用,但当ERS过度时,可通过多种方式导致细胞信号错误[22],反而激活ERS相关的凋亡蛋白CHOP及caspase-12等,导致细胞凋亡[23]。CHOP是一种ERS特异性转录因子[24],也是ERS介导细胞由抗凋亡向促凋亡转化的重要信号分子[25]。ERS过强时,可通过 IRE-1、PERK 和 ATF6 的活化促进 CHOP 的大量表达,进而抑制抗凋亡蛋白Bcl-2蛋白的表达,使细胞对ERS的敏感性增加,促进凋亡[26];caspase-12是一类鼠源性的内质网膜结合蛋白,正常情况下,caspase-12以无活性的酶原形式(procaspase-12)存在,当活化之后转变为有活性的caspase-12,可介导细胞凋亡过程,其机制是活化后的caspase-12 进一步激活ERS分子caspase-9,活化后的caspase-9 有效切割和活化下游的caspase-3,最终引起细胞凋亡,因此caspase-12被认为是ERS介导凋亡路径的重要标志物[27]。ERS发生后,GRP78与复合物分离,转而去结合堆积在内质网腔内的未折叠蛋白,从而使caspase-12暴露活化,启动细胞凋亡途径[28]。本研究中,ACN染毒后上调肝脏GRP78 mRNA及蛋白表达水平启动ERS,再通过上调CHOP、caspase-12 mRNA及蛋白表达水平启动了ERS相关凋亡通路,认为ACN引起的大鼠肝脏氧化损伤可能是诱导肝脏ERS发生的原因之一。NAC干预后,可明显下调肝脏GRP78、CHOP、caspase-12 mRNA及蛋白表达水平而阻止ERS的发生,进一步说明ACN引起的大鼠肝脏氧化损伤是引起ERS发生的原因之一。
致谢:感谢北京大学公共卫生学院崔富强研究员在文章修改中给予的帮助。
通讯作者简介:李芝兰(1962-),女,硕士研究生导师,教授,兰州大学公共卫生学院儿少卫生与妇幼保健学研究所所长,研究方向为妇女劳动卫生与生殖健康。
参考文献(References):
[1] 赵乾龙. 丙烯腈诱导的氧化应激对雄性大鼠睾丸细胞NF-κB信号通路影响的研究[D]. 兰州: 兰州大学, 2016: 1
Zhao Q L. Effects of acrylonitrile-induced oxidative stress on NF-κB signaling pathway in testis cells of male rats [D]. Lanzhou: Lanzhou University, 2016: 1 (in Chinese)
[2] Abo-Salem O M, Abd-Ellah M F, Ghonaim M M. Hepatoprotective activity of quercetin against acrylonitrile-induced hepatotoxicity in rats [J]. Journal of Biochemical & Molecular Toxicology, 2015, 25(6): 386-392
[3] Guang X, Rong L, Wen X, et al. Curcumin pretreatment protects against acute acrylonitrile-induced oxidative damage in rats [J]. Toxicology, 2010, 267(1-3): 140-146
[4] 金娜. 丙烯腈对小鼠肝、脑、睾丸组织脂质过氧化及抗氧化能力影响的研究[D]. 兰州: 兰州大学, 2011: 10-11
Jin N. Effects of acrylonitrile on lipid peroxidation and antioxidant capacity in liver, brain and testis of mice [D]. Lanzhou: Lanzhou University, 2011: 10-11 (in Chinese)
[5] Nakagawa Y, Toyoizumi T, Sui H, et al.Invivo, comet assay of acrylonitrile, 9-aminoacridine hydrochloride monohydrate and ethanol in rats [J]. Mutation Research/Genetic Toxicology & Environmental Mutagenesis, 2015, 786-788: 104-113
[6] 赵文玺, 金梅花, 李天, 等. 草苁蓉水萃取物对四氯化碳致肝损伤小鼠肝脏氧化应激的干预作用[J]. 中国中药杂志, 2013, 38(6): 875-878
Zhao W X, Jin M H, Li T, et al. Effects of aqueous extract ofBoschniakiarossicaon liver oxidative stress in mice with liver injury induced by carbon tetrachloride [J]. Chinese Journal of Traditional Chinese Medicine, 2013, 38 (6): 875-878 (in Chinese)
[7] 王超, 李侃, 张燕翔, 等. 槲皮素固体分散体对小鼠四氯化碳急性肝损伤氧化应激的影响[J]. 现代预防医学, 2013, 40(15): 2872-2876
Wang C, Li K, Zhang Y X, et al. The effects of quercetin solid dispersion on the oxidative stress of acute liver injury in mice [J]. Modern Preventive Medicine, 2013, 40(15): 2872-2876 (in Chinese)
[8] 李桃园, 王昕, 赵旋, 等. 柚皮素对四氯化碳致小鼠化学性肝损伤中氧化应激介质生成影响的实验研究[J]. 中国临床药理学杂志, 2010, 26(6): 420-423
Li T Y, Wang X, Zhao X, et al. Experimental study on the effect of naringin on the formation of oxidative stress media in mice with chemical liver injury induced by carbon tetrachlorium [J]. Chinese Journal of Clinical Pharmacology, 2010, 26(6): 420-423 (in Chinese)
[9] Zhou Y T, Xiao H B, Ming-Gang B I. ROS and endoplasmic reticulum stress [J]. Chinese Pharmacological Bulletin, 2011, 27(5): 597-600
[10] Choi A Y, Choi J H, Lee J Y, et al. Apigenin protects HT22 murine hippocampal neuronal cells against endoplasmic reticulum stress-induced apoptosis [J]. Neurochemistry International, 2010, 57(2): 143-152
[11] Reddy R K, Mao C, Baumeister P, et al. Endoplasmic reticulum chaperone protein GRP78 protects cells from apoptosis induced by topoisomerase inhibitors: Role of ATP binding site in suppression of caspase-7 activation [J]. Journal of Biological Chemistry, 2003, 278(23): 20915-20924
[12] 尚文静. 丙烯腈对大鼠外周血内皮祖细胞功能的影响[D]. 上海: 复旦大学, 2012: 11-13
Shang W J. Effects of acrylonitrile on endothelial function of peripheral blood endothelial cells in rats [D]. Shanghai: Fudan University, 2012: 11-13 (in Chinese)
[13] Esmat A, El-Demerdash E, El-Mesallamy H, et al. Toxicity and oxidative stress of acrylonitrile in rat primary glial cells: Preventive effects of N -acetylcysteine [J]. Toxicology Letters, 2007, 171(3): 111-118
[14] 陈军义. 丙烯腈对雄性大鼠血清性激素分泌及睾酮合成酶mRNA表达的影响[D]. 兰州: 兰州大学, 2016: 25-27
Chen J Y. Effects of acrylonitrile on serum sex hormone secretion and testosterone synthase mRNA expression in male rats [D]. Lanzhou: Lanzhou University, 2016: 25-27 (in Chinese)
[15] Pi J, Zhang Q, Fu J, et al. ROS signaling, oxidative stress and Nrf2 in pancreatic beta-cell function [J]. Toxicology and Applied Pharmacology, 2010, 244(1): 77-83
[16] Franco R, Schoneveld O J, Pappa A, et al. The central role of glutathione in the pathophysiology of human diseases [J]. Archives of Physiology & Biochemistry, 2008, 113(4-5): 234-258
[17] Klaunig J E, Wang Z, Pu X, et al. Oxidative stress and oxidative damage in chemical carcinogenesis [J]. Toxicology and Applied Pharmacology, 2010, 254(2): 86-99
[18] Farombi E O, Adelowo O A, Ajimoko Y R. Biomarkers of oxidative stress and heavy metal levels as indicators of environmental pollution in African cat fish (Clariasgariepinus) from Nigeria Ogun River [J]. International Journal of Environmental Research and Public Health, 2007, 4(2): 158-165
[19] Gong J, Wang X Z, Wang T, et al. Molecular signal networks and regulating mechanisms of unfolded protein response [J]. Journal of Zhejiang University-Science B (Biomedicine and Biotechnology), 2017, 18(1): 1-14
[20] Wu J, Kaufman R J. From acute ER stress to physiological roles of the unfolded protein response [J]. Cell Death and Differentiation, 2006, 13(3): 374-384
[21] Zhu X, Zhang X, Yu L, et al. Hepatic overexpression of GRP94 in a rabbit model of parenteral nutrition-associated liver disease [J]. Gastroenterology Research and Practice, 2015: Article ID 269831
[22] Xu X, Liu T, Zhang A, et al. Reactive oxygen species-triggered trophoblast apoptosis is initiated by endoplasmic reticulum stress via activation of caspase-12, CHOP, and the JNK pathway in infection in mice [D]. Bristol: University of Bristol, 2012, 80(6): 2121-2132
[23] Hitomi J, Katayama T, Taniguchi M, et al. Apoptosis induced by endoplasmic reticulum stress depends on activation of caspase-3 via caspase-12 [J]. Neuroscience Letters, 2004, 357(2): 127-130
[24] Oyadomari S, Mori M. Roles of CHOP/GADD153 in endoplasmic reticulum stress [J]. Cell Death and Differentiation, 2004, 11(4): 381-389
[25] Tabas I, Ron D. Integrating the mechanisms of apoptosis induced by endoplasmic reticulum stress [J]. Nature Cell Biology, 2011, 13(3): 184-190
[26] Puthalakath H, O'Reilly L A, Gunn P, et al. ER stress triggers apoptosis by activating BH3-only protein Bim [J]. Cell, 2007, 129(7): 1337-1349
[27] Pal S, Ghosh M, Ghosh S, et al. Atorvastatin induced hepatic oxidative stress and apoptotic damage via MAPKs, mitochondria, calpain and caspase 12 dependent pathways [J]. Food & Chemical Toxicology, 2015, 83: 36-47
[28] Tan Y, Dourdin N, Wu C, et al. Ubiquitous calpains promote caspase-12 and JNK activation during endoplasmic reticulum stress-induced apoptosis [J]. Journal of Biological Chemistry, 2006, 281(23): 16016-16024

