磺胺类抗生素对不同革兰氏阴性菌的毒物兴奋效应研究
程逸飞, 曾鸿鹄, 于洋, 王大力, 孙昊宇, 林志芬, 莫凌云,*
1. 桂林理工大学环境科学与工程学院,桂林 541004 2. 污染控制与资源化研究国家重点实验室,同济大学环境科学与工程学院,上海 200092 3. 环境保护部固体废物与化学品管理技术中心,北京 100029
Hormesis是指生物体在不同剂量化学物质刺激下产生的、以双相剂量-反应曲线为特征的一种适应性反应,即有毒化学物质对生物体在高剂量时表现负面影响,但在低剂量时却表现为有益作用的现象[1],其中的低剂量通常为低于NOAEL(no observed adverse effect level)的剂量区间[2-3]。Hormesis效应在对毒物有不同敏感性的个体和类型之间有着相似的定量特征[4],Calabrese和Baldwin[5]将其概括为很小的刺激反应幅度,很窄的刺激反应范围。最大的刺激反应幅度一般不会超过对照组的2倍。通常情况下,这种反应只比对照组高30%~60%[3]。有文献中表明,6%的促进率即可认为是hormesis效应[6]。
目前,在各类生物(包括动物、植物、微生物)、各类毒物(包括致癌物和非致癌物)及各类生命现象(包括肿瘤形成、生殖、生长、寿命及代谢等)中都发现了hormesis现象。其范围几乎涵盖了包括重金属化合物、氰化物、多环芳烃、多氯联苯、有机砷化合物以及农药和一些抗生素在内的大量有毒物质[7]。Calabrese[8]由此预测,hormesis效应是一种普遍存在的生物学现象,并呼吁将hormesis模型替代线性模型与阈值模型而作为剂量-效应评价的缺省模型。因此,研究hormesis效应对有毒物质的生态风险评估具有重要意义。
抗生素自发现以来,被大量用于人类医疗保健、动物养殖和农业生产当中,具有种类多、应用范围广的特点。磺胺类抗生素(SAs)作为一种典型抗生素,它的滥用引起的环境问题和耐药性问题日益受到人们的重视[9-15]。在我们前面的研究中发现,SAs可以对费氏弧菌(Aliivibriofischeri)的发光产生hormesis效应,并且认为可能与其群体感应(quorum-sensing)系统密切相关[16]。群体感应这个术语由Fuqua等[17]在1994年被提出,其定义为当细菌的数量达到一定的密度(quorum)时才能发生的感应现象(sensing)。群体感应最早由美国的Nealson等[18]在A.fischeri中观察到的,在该细菌中群体感应控制着生物发光现象。直到20世纪90年代的研究发现,类似于发光菌A.fischeri的群体感应现象存在于其他的革兰氏阴性菌中,如植物肿胀病菌(Agrobacterium)、气单胞菌属(Aeromonas)等[19](如图1)。

图1 大肠杆菌和费氏弧菌的群体感应系统注:C6、C8、AinS、AinR、LuxR、LuxI、SdiA、FtsZ分别是信号分子C6、信号分子C8、AinS蛋白、AinR蛋白、LuxR蛋白、LuxI蛋白、SdiA蛋白、FtsZ蛋白。Fig. 1 Quorum sensing system of Escherichia coli and Aliivibrio fischeriNote:C6, C8, AinS, AinR, LuxR, LuxI, SdiA, FtsZ are respectively N-3-oxo-hexanoyl homoserine lactone, octanoyl homoserine lactone, AinS protein, AinR protein, LuxR protein, LuxI protein, SdiA protein, FtsZ protein.
但是不同的革兰氏阴性菌其QS系统不同。比如典型的革兰氏阴性菌A.fischeri,它可以通过自身合成信号分子,按照信号分子的不同分为2类:AHL信号分子和AI-2信号分子。其中AHL信号分子根据碳链的长度不同分为C6和C8 2种,分别由LuxR/LuxI和AinR/AinS调节,相互作用共同调节A.fischeri的发光[16]。而对于另一种革兰氏阴性菌大肠杆菌(Escherichiacoli),E.coli无法通过自身产生AHL信号分子,但其存在着LuxR蛋白的同源蛋白SdiA[20],其下游蛋白为FtsZ[21]。外源的 AHL能作用于E.coli的SdiA蛋白,促进下游蛋白FtsZ的表达进而促进细菌的生长[22]。那么具有不同的QS系统的E.coli和A.fischeri,SAs是否对它们都具有hormesis效应呢?
本文以大肠杆菌(Escherichiacoli)为受试生物,选取了4种典型的磺胺类抗生素——磺胺氯哒嗪 (SCP)、磺胺吡啶 (SPY)、磺胺甲氧哒嗪 (SMP)、磺胺多辛 (SDX)为受试化合物,测定了4种抗生素对E.coli的0~24 h 的毒性作用,以OD600作为测试终点进行毒性表征。考察了不同浓度培养基下磺胺类抗生素对大肠杆菌是否能产生hormesis效应;对比了不同磺胺对同为革兰氏阴性菌的大肠杆菌和费氏弧菌的hormesis效应,并基于2种菌的QS系统对hormesis效应产生的机制进行了分析。
1 材料与方法(Materials and methods)
1.1 试剂和生物
本实验所用的4种磺胺类药物,即SCP、SPY、SMP、SDX均购买自 Sigma-Aldrich Co. LLC (上海),具体试剂信息如表1。进行毒性测试所用化合物配制使用助溶剂二甲基亚砜(dimethyl sulfoxide,DMSO)。大肠杆菌Escherichiacoli(E.coli)MG1655购买自Biovector 生物科技有限公司。
1.2 培养基
Luria-Bertani(LB)培养基的配方如下:1%胰蛋白胨、0.5%酵母浸膏和1%NaCl,pH调节到7.0~7.2。Mueller-Hinton (MH)培养基,其配方如下:0.3%的牛肉粉、1.75%酸水解酪蛋白和0.15%淀粉,pH调节至7.2~7.4。配好后,放入高压蒸汽灭菌锅内121 ℃灭菌21 min。
1.3 抗生素对大肠杆菌生长抑制的测定
大肠杆菌接种到5 mL的LB培养基中,在37 ℃培养至OD600(600 nm 处的光密度)到0.5左右。将此菌液稀释1×105倍后,加入100孔板中。孔板中每个孔按照“80 μL培养基+80 μL药物+40 μL菌液”的方式配制成200 μL的体系。然后将200孔板放入37 ℃、180 r·min-1的自动检测仪中,连续检测24 h的吸光度(600 nm)情况。单一毒性计算方式按照下式:
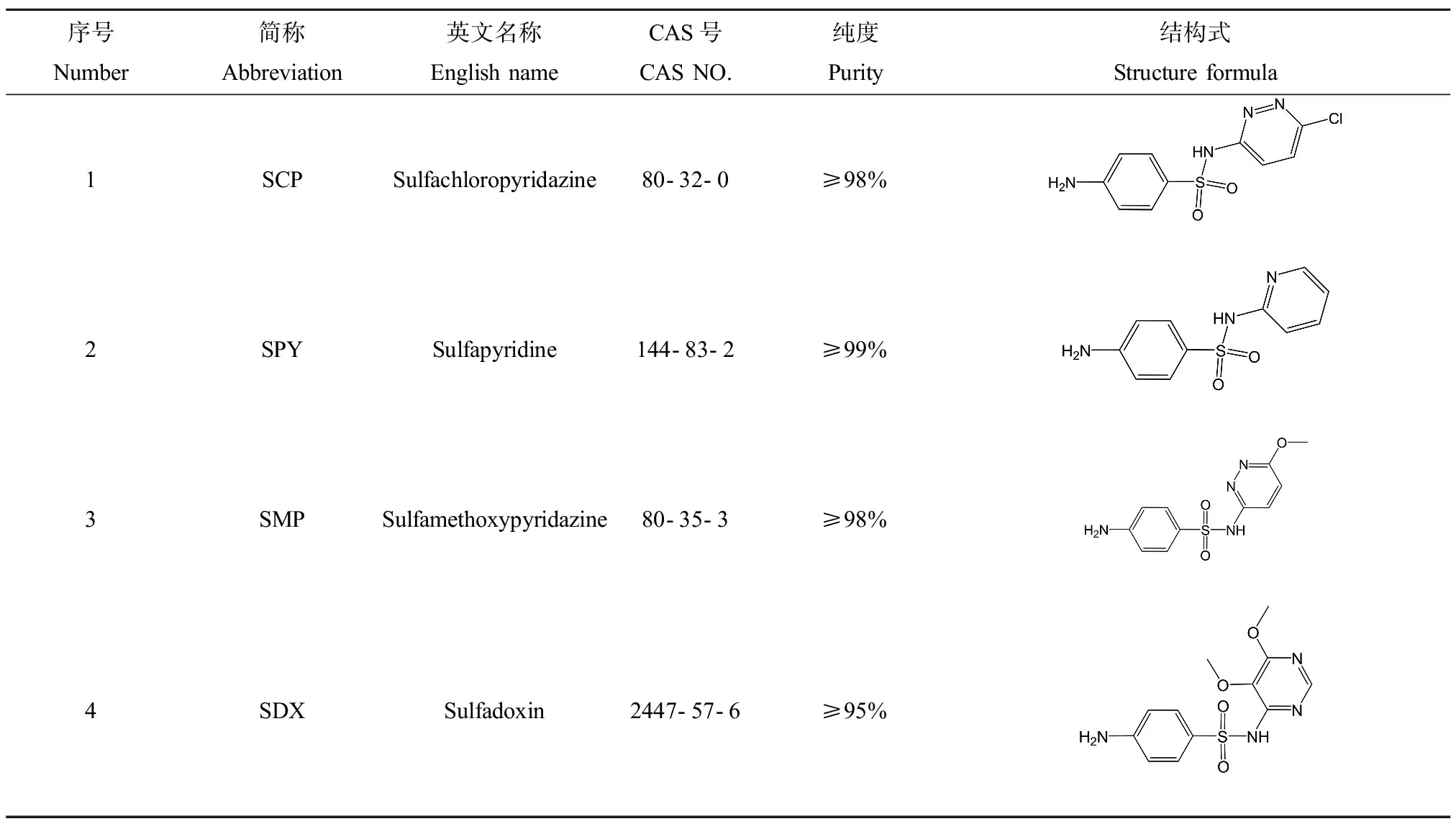
表1 实验药品信息Table 1 Experimental drug information
(1)
式(1)中,Inhibition为第i组实验浓度下的抑制率;OD600,0为对照组的吸光度;OD600,i为抗生素浓度为i时大肠杆菌的OD600。
1.4 Hormesis效应曲线的拟合
本实验的拟合模型选用Deng等[23]提出的Hormesis拟合模型,即:
(2)
式(2)中,x表示受试化合物的浓度;m表示效应底值;a表示最低剂量点的中值;b表示a点处的斜率;p表示最高剂量点的中值;q表示p点处的斜率。
2 结果与讨论(Results and discussion)
2.1 SAs在原倍MH培养基下对E. coli的hormesis效应
为了考察磺胺类抗生素对E.coli的hormesis效应,我们首先测定了磺胺多辛 (SDX)对E.coli的生长的影响,并对实验组和对照组之间进行了差异显著性检验,在24 h下的剂量-效应曲线和差异显著性检验如图2所示(实验组和对照组之间的差异显著性分别由*(P<0.05),**(P<0.01),***(P<0.005)表示。
从图2可以看出,SDX在原倍MH培养基的条件下对E.coli生长的剂量-效应曲线表现为传统的S型剂量-效应曲线,在低浓度段没有表现出显著的促进作用。但是,Vichi等[24]的研究表明,只有在部分消耗的培养基中,阿霉素对细胞生长才存在hormesis效应。Belz等[25]也发现,银胶菊碱对莴苣根生长的hormesis效应只发生在低于最大浓度的培养条件下。以此推测,培养基的浓度对E.coli的生长会产生影响,改变培养基的浓度或许会导致SAs对E.coli生长存在hormesis效应。
2.2 SAs在不同浓度MH培养基下对E.coli的hormesis效应
我们考察了在不同浓度培养基条件下(0.4倍、0.6倍、0.8倍MH培养基)SDX对E.coli生长的影响,在24 h下的剂量-效应曲线如图3所示。
从图3中可以看出,在0.4MH和0.6MH培养基中,SDX对E.coli的生长均存在显著的促进作用,SDX对E.coli生长的最大促进率(Emax)约为22.33%;而在0.6倍的MH培养基中,Emax约为17.78%;在0.8倍的MH培养基中,SDX对E.coli的生长促进作用则十分微弱且不显著。实验结果表明,通过改变培养基的浓度,SDX对E.coli可以产生hormesis效应。且随着培养基浓度的减小,产生的hormesis效应逐渐增强,在0.4MH培养基下产生的hormesis效应最强。
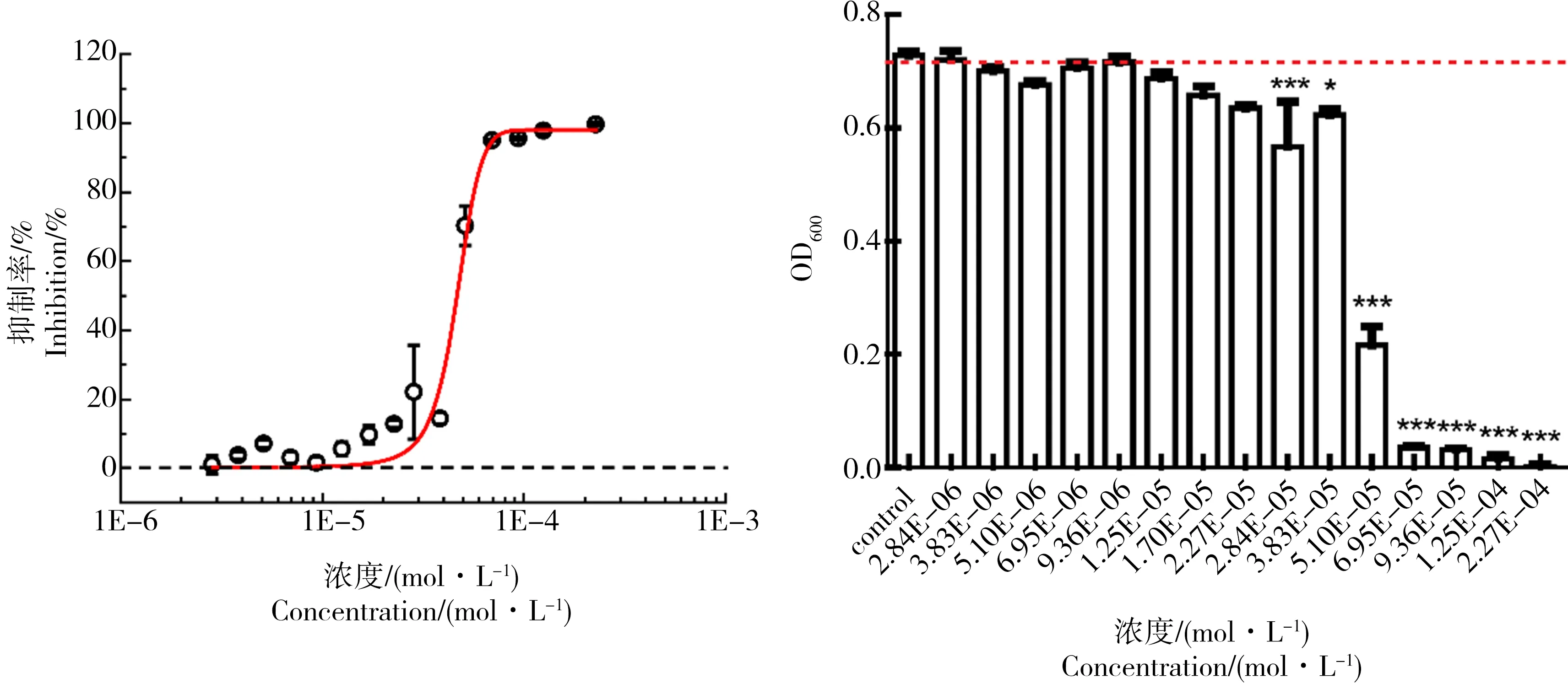
图2 原倍MH培养基下,SDX对E. coli生长的剂量-效应曲线和显著性检验Fig. 2 Dose-response curve and significance test of SDX on Escherichia coli growth under MH medium
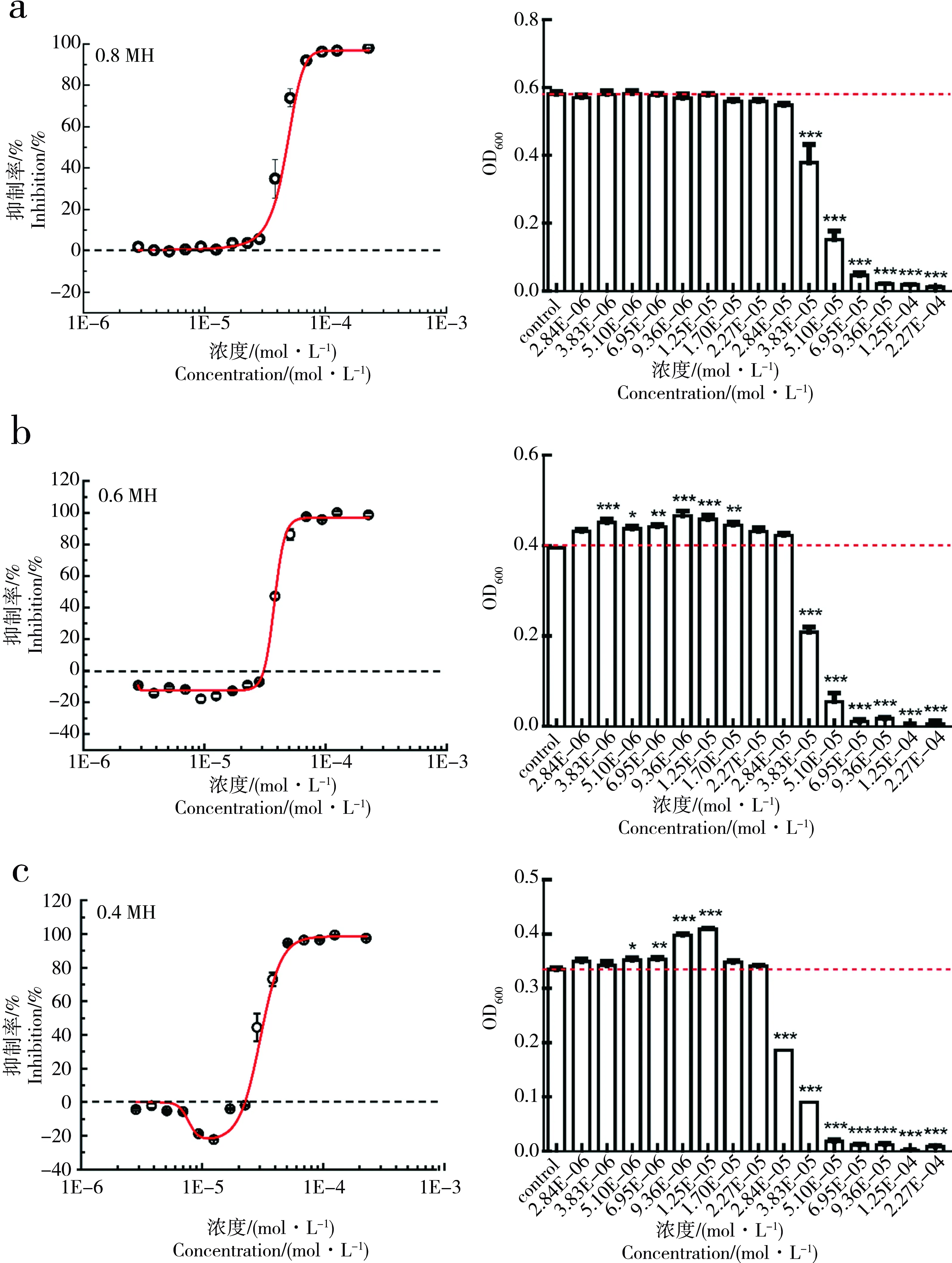
图3 不同浓度MH培养基下,SDX对E. coli生长的剂量-效应曲线和显著性检验注: a、b、c分别为0.8MH、0.6MH、0.4MH下,SDX对E.coli生长的剂量-效应曲线和显著性检验。Fig. 3 Dose-response curves and significance test of SDX on growth of E. coli under different concentrations of MH mediaNote: a, b, c are respectively dose-response curve and significance test of SDX on E. coli growth under 0.8, 0.6, 0.4-fold dilutions of MH media.
除了培养条件外,时间也是决定hormesis是否发生的一个重要因素。Calabrese等[7]指出,hormesis只可能在暴露发生后或发生过程中的某些特定时间发生。可见,hormesis效应的产生受到培养条件、时间等多因素的影响,所以这种因培养条件改变而引起horemsis效应改变的现象可能同样存在于其他的化合物暴露的情况中。
2.3 SAs在0.4MH培养基下对E. coli的hormesis效应
为了进一步验证SAs对E.coli生长的促进作用是否具有普遍性,接下来我们选取了另外3种SAs对E.coli在0.4MH培养基下进行了实验,实验结果如图4所示。
由图4可以看出,在0.4MH培养基的条件下,SCP、SPY和SMP对E.coli均存在显著的促进作用,Emax分别为13.23%、18.72%和15.37%。即在0.4MH培养基的条件下,3种SAs对E.coli均存在hormesis效应,且最大促进率均在10%和20%之间。
那么对于与E.coli具有不同QS系统的A.fischeri,SAs是否对它具有hormesis效应呢?如果有,SAs对E.coli与对A.fischeri的hormesis之间是否存在什么联系?这样的联系能否延伸到所有革兰氏阴性菌?
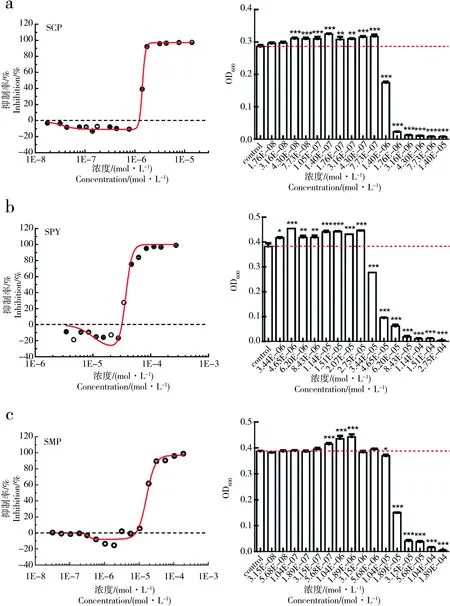
图4 0.4倍MH培养基下,SAs对E. coli生长的剂量-效应曲线和显著性检验注:a、b、c分别为0.4MH培养基下,SCP、SPY、SMP对E. coli的生长剂量-效应曲线和显著性检验。Fig. 4 The dose-response curve and significance test of SAs to E. coli growth under 0.4-fold dilutions of MH mediaNote: a, b, c are respectively dose-response curve and significance test of SCP, SPY, SMP on E. coli growth under 0.4-fold dilutions of MH media.

图5 SAs对Aliivibrio fischeri发光的剂量效应曲线Fig. 5 The dose-response curve of SAs on A. fischeri luminescence
2.4 SAs对E. coli与对A. fischeri的hormesis效应的比较
为了找到SAs对E.coli与对A.fischeri的hormesis效应之间的联系,我们对比了本文SAs作用E.coli的实验结果与前期SAs作用A.fischeri的实验结果[26](图5)。
根据图5可知,6种SAs对A.fischeri的最大促进率达到75%左右,而SAs对E.coli的最大促进率仅为15%左右(图4)。综上所述,SAs对E.coli和A.fischeri都存在hormesis效应,但对E.coli的hormesis效应明显要弱于对A.fischeri的hormesis效应。
同作为革兰氏阴性菌,是什么导致了hormesis效应上的差异?
检测终点不同可能是导致hormesis效应差异的重要原因之一[26]。A.fischeri是以其发光值作为测试终点,是分子水平上的检测;而E.coli是以细菌密度为测试终点,是个体水平上的检测。两者相比,发光值作为分子水平上的检测会更加敏感,这可能导致了2种菌之间hormesis效应上的差异。
除了检测终点的不同之外,E.coli与A.fischer之间存在着不同的群体感应系统可能是导致hormesis效应差异的另一重要原因。在低剂量时,SAs主要通过以下3个途径促进A.fischer的发光:1) SAs与LuxR结合,形成LuxR~SA复合物,该复合物启动细菌的QS现象最终促进A.fischeri发光[23]。2) SAs可以促进LitR蛋白的生成,进而促进luxR的表达,产生更多的LuxR蛋白,促进发光[16]。3) SAs可以促进细菌内LuxI的表达,进而促进细菌体内自诱导物AHL的产生,自诱导物AHL与LuxR蛋白结合,促进下游荧光素酶的表达进而促进A.fischeri发光[27]。
在E.coli中存在着LuxR的同源蛋白SdiA[28]。根据Sun等[29]的研究可知,SAs可以通过作用于E.coli的SdiA蛋白,导致了sdiA mRNA的表达量增加,进而促进了细菌生长。此过程类似于SAs作用于A.fischeri的LuxR/LuxI群体感应系统。但相比之下,A.fischeri的群体感应系统更加复杂,因此可能导致SAs对于A.fischeri的hormesis效应比对E.coli更强。
可见,SAs对于此2类不同的测试生物,不同的测试终点,只要在合适的条件下都可以产生hormesis效应。本研究通过SAs作用A.fischeri和E.coli的0~24 h慢性毒性实验数据证实了SAs对于这2种不同的革兰氏阴性菌均存在hormesis效应,进而通过分析2种菌的QS系统,推测在合适的条件下,SAs可以通过作用于QS系统,使所有与A.fischeri和E.coli存在类似的QS系统的革兰氏阴性菌产生Hormesis效应。本研究的结果为抗生素的生态风险评价提供了依据,并且对未来关于hormesis效应的研究和关于革兰氏阴性菌的群体感应现象的研究提供实验依据。
通讯作者简介:莫凌云(1973-),女,硕士生导师,副研究员,主要研究方向为混合污染物毒理学。
参考文献(References):
[1] 黄璐琦, 郭兰萍, 张小波, 等. Hormesis 概念、机理及其在中药研究中的应用[C]. 天津: 2010年中国药学大会暨第十届中国药师周论文集, 2010
Huang L Q, Guo L P, Zhang X B, et al. Hormesis and its application in medicinal plant growth[C]. Tianjin: 2010 China Pharmaceutical Conference and the Tenth Chinese Pharmacists Week Essays, 2010 (in Chinese)
[2] Vandenberg L N, Colborn T, Hayes T B, et al. Hormones and endocrine-disrupting chemicals: Low-dose effects and nonmonotonic dose responses[J]. Endocrine Reviews, 2012, 33(3): 378-455
[3] Calabrese E J, Baldwin L A. Hormesis: A generalizable and unifying hypothesis [J]. Critical Reviews in Toxicology, 2001, 31(4-5): 353-424
[4] Calabrese E J, Baldwin L A. Hormesis and high-risk groups[J]. Regulatory Toxicology and Pharmacology, 2002, 35(3): 414-428
[5] Calabrese E J, Baldwin L A. The dose determines the stimulation (and poison): Development of a chemical hormesis database [J]. International Journal of Toxicology, 1997, 16(6): 545-559
[6] Migliore L, Rotini A, Thaller M C. Low doses of tetracycline trigger theE.coligrowth: A case of hormetic response [J]. Dose-Response, 2013, 11(4): 1-12
[7] Calabrese E J, Blain R B. The hormesis database: The occurrence of hormetic dose responses in the toxicological literature[J]. Regulatory Toxicology and Pharmacology, 2011, 61(1): 73-81
[8] Calabrese E J. Hormesis is central to toxicology, pharmacology and risk assessment [J]. Human and Experimental Toxicology, 2010, 29(4): 249-261
[9] Pei R, Kim S C, Carlson K H, et al. Effect of river landscape on the sediment concentrations of antibiotics and corresponding antibiotic resistance genes (ARG) [J]. Water Research, 2006, 40(12): 2427-2435
[10] Martinez J L. Environmental pollution by antibiotics and by antibiotic resistance determinants[J]. Environmental Pollution, 2009, 157(11): 2893-2902
[11] Jiang L, Hu X, Xu T, et al. Prevalence of antibiotic resistance genes and their relationship with antibiotics in the Huangpu River and the drinking water sources, Shanghai, China [J]. Science of the Total Environment, 2013, 458: 267-272
[12] Karkman A, Johnson T A, Lyra C, et al. High-throughput quantification of antibiotic resistance genes from an urban wastewater treatment plant [J]. FEMS Microbiology Ecology, 2016, 92(3): 104
[13] Rodriguez-Mozaz S, Chamorro S, Marti E, et al. Occurrence of antibiotics and antibiotic resistance genes in hospital and urban wastewaters and their impact on the receiving river [J]. Water Research, 2015, 69: 234-242
[14] Thiele-Bruhn S, Beck I C. Effects of sulfonamide and tetracycline antibiotics on soil microbial activity and microbial biomass [J]. Chemosphere, 2005, 59(4): 457-465
[15] Karunasagar I, Pai R, Malathi G R, et al. Mass mortality ofPenaeusmonodonlarvae due to antibiotic-resistantVibrioharveyiinfection[J]. Aquaculture, 1994, 128(3): 203-209
[16] You R, Sun H, Yu Y, et al. Time-dependent hormesis of chemical mixtures: A case study on sulfa antibiotics and a quorum-sensing inhibitor ofVibriofischeri[J]. Environmental Toxicology and Pharmacology, 2016, 41: 45-53
[17] Fuqua W C, Winans S C, Greenberg E P. Quorum sensing in bacteria: The LuxR-LuxI family of cell density-responsive transcriptional regulators [J]. Journal of Bacteriology, 1994, 176(2): 269
[18] Nealson K H, Platt T, Hastings J W. Cellular control of the synthesis and activity of the bacterial luminescent system [J]. Journal of Bacteriology, 1970, 104(1): 313-322
[19] De Kievit T R, Iglewski B H. Bacterial quorum sensing in pathogenic relationships [J]. Infection and Immunity, 2000, 68(9): 4839-4849
[20] Ahmer B M M, Van Reeuwijk J, Timmers C D, et al.Salmonellatyphimuriumencodes an SdiA homolog, a putative quorum sensor of the LuxR family, that regulates genes on the virulence plasmid [J]. Journal of Bacteriology, 1998, 180(5): 1185-1193
[21] Fuqua W C, Winans S C, Greenberg E P. Quorum sensing in bacteria: The LuxR-LuxI family of cell density-responsive transcriptional regulators [J]. Journal of Bacteriology, 1994, 176(2): 269-275
[22] Wang X D, de Boer P A J, Rothfield L I. A factor that positively regulates cell division by activating transcription of the major cluster of essential cell division genes ofEscherichiacoli[J]. The EMBO Journal, 1991, 10(11): 3363-3372
[23] Deng Z X, Lin Z F, Zou X M, et al. Model of hormesis and its toxicity mechanism based on quorum sensing: A case study on the toxicity of sulfonamides toPhotobacteriumphosphoreum[J]. Environmental Science and Technology, 2012, 46(14): 7746-7754
[24] Vichi P, Tritton T R. Stimulation of growth in human and murine cells by adriamycin [J]. Cancer Research, 1989, 49(10): 2679-2682
[25] Belz R G, Cedergreen N. Parthenin hormesis in plants depends on growth conditions [J]. Environmental and Experimental Botany, 2010, 69(3): 293-301
[26] Calabrese E J. Hormesis: From marginalization to mainstream: A case for hormesis as the default dose-response model in risk assessment[J]. Toxicology and Applied Pharmacology, 2004, 197(2): 125-136
[27] Defoirdt T, Brackman G, Coenye T. Quorum sensing inhibitors: How strong is the evidence? [J]. Trends in Microbiology, 2013, 21(12): 619-624
[28] Whitehead N A, Barnard A M L, Slater H, et al. Quorum-sensing in Gram-negative bacteria [J]. FEMS Microbiology Reviews, 2001, 25(4): 365-404
[29] Sun H, Ge H, Zheng M, et al. Mechanism underlying time-dependent cross-phenomenon between concentration-response curves and concentration addition curves: A case study of sulfonamides-erythromycin mixtures onEscherichiacoli[J]. Scientific Reports, 2016, 6: 33718

