纳米材料对藻细胞毒性效应及致毒机理
范功端,陈薇,郑小梅,彭慧萍
1. 福州大学土木工程学院,福州 350108 2. 福州大学新能源材料研究所,福州 350108
纳米材料是指某一维度小于100 nm的固体超细材料[1-2],可分为碳基纳米材料(包括C60、氧化石墨烯、单壁碳纳米管和多壁碳纳米管等)和无机纳米材料(包括金属、金属氧化物及量子点等)[3],详见图1。纳米材料被广泛应用于商业领域中,如填充剂、遮光剂、催化剂、半导体和化妆品等[4]。纳米材料应用广泛,同时产量也在不断扩增。2004年时纳米材料的产量高达2 000吨,在2011—2012年间纳米材料的产量增加至58 000吨[5]。表1总结了纳米材料在不同性能中的应用[6]。
纳米材料的环境行为与生态效应是当前国际环境科学研究的热点和前沿[7]。2003年,Service在Science杂志上发表了关于纳米材料的毒性研究[8]。2004—2005年,美国环保局(EPA)斥资362万美元对纳米安全性进行评估[9]。2012年,Wang等[10]发现纳米CuO能够诱导人体肺上皮细胞(A539细胞)产生活性氧类(reactive oxygen species, ROS),使线粒体的膜电位下降,同时能够破坏A539细胞的DNA链。目前已有许多研究总结了纳米材料的近期发展,同时大部分研究对纳米材料的毒性进行了重点关注。例如Nel等[11]在Science上就纳米材料的毒性及机理进行了讨论;Lam等[12]着重讨论了单壁碳纳米管与双壁碳纳米管对小鼠肺部、心脏等的毒性作用;Monterio-Riviere等[13]将双壁碳纳米管作用于人类表皮角化细胞,48 h后发现浓度为0.4 mg·mL-1的双壁碳纳米管实验组的人类表皮角化细胞释放促炎细胞因子白细胞介素-8。

图1 纳米材料的分类及结构示意图Fig. 1 Classification and structure of nanomaterials

性能Properties应用Application光学Optics1)防反射涂层Anti-reflective coating2)用于癌症诊断的基于光的传感器Light-based sensor for cancer diagnosis磁性Magnetism1)增加存储介质密度Increase storage density2)磁性纳米颗粒可用于MRI图像的细节和对比度的改进Magnetic nanoparticles can be used to improve the details and contrast of MRI images机械Machinery1)高性能的小组件,例如小型电子设备的电容High-performance small components, such as the capacitance of small electronic devices2)显示器Monitors3)高导电性材料Highly conductive materials生物医学Biomedicine1)用于伤口敷料的抗菌银涂层Antibacterial silver coating for wound dressings2)疾病监测传感器(量子点) Disease Monitoring Sensors (Quantum Dots)3)自动释药系统Automatic drug delivery system环保Environmental protection1)清理污染土壤及污染物,例如石油 Clean up contaminated soils and pollutants, such as oil2)可生物降解聚合物Biodegradable polymer3)工业废气处理Industrial exhaust gas treatment4)有效过滤水体Effective filtration of water个人护理Personal care1)无机防晒霜Inorganic sunscreen2)乳化技术Emulsification technology
纳米材料在生产、运输、使用和废弃等过程中必将进入水环境,并与水环境中广泛存在的溶解性有机质、水生生物及其他污染物发生反应,将使其物化性质发生一定程度的改变(图2)。同时,水体中含有藻类,藻类作为水生生态系统中的初级生产者,能够利用光合作用合成有机物,是食物链的最基础环节,在整个水生生态系统中起着重要的作用[14],对水环境变化非常敏感。因此,研究纳米材料对水中有机质、藻类等的毒性效应十分重要。
本文主要介绍了不同种类纳米材料对藻类的毒性效应,分析了影响纳米材料毒性效应的因素,探讨了纳米材料对藻类的致毒机理,旨在为今后运用纳米材料提供理论依据。
1 不同纳米材料对藻类的毒性效应(Toxic effects of different nanomaterials on algae)
纳米材料的相关毒性研究约有78%基于体内实验,22%基于体外实验[3]。由于藻类在水生生态系统中的重要地位,因此,目前大多数研究均选取藻类作为纳米毒理学的受试生物。表2总结了不同类型纳米材料对不同藻种的毒性研究。
1.1 纳米金属
由于金属纳米粒子具有独特的光学和电磁学性质等物化性质[20],因此在催化、分子识别和生物医学等领域应用广泛。金属纳米粒子种类繁多,进入环境后不同的金属纳米粒子对不同藻类的作用形式不同。


图2 纳米粒子进入环境的重要途径(根据文献[6]修改)Fig. 2 Important way for nanoparticles to enter the environment (Modified according to reference [6])
目前虽然已有部分种类的金属纳米粒子被用于研究其对藻类的毒理现象,但仍有许多金属纳米粒子对藻类造成的影响研究尚少。因此仍有必要研究其他种类金属纳米粒子对藻类的影响。
1.2 纳米氧化物
相对于金属纳米粒子,利用纳米金属氧化物进行藻类毒性实验研究所采用的纳米金属氧化物种类较多,如纳米CuO、纳米ZnO、纳米CeO2、纳米SiO2、纳米TiO2和纳米Al2O3等。通过Ji等[14]的实验结果发现,纳米TiO2和纳米ZnO对小球藻具有明显的毒性效应,且纳米ZnO对小球藻的毒性效应不能单单解释为纳米ZnO在溶液中溶出了Zn2+,其致毒机理还包括产生ROS对藻类造成损伤等。Aruoja等[31]发现,纳米ZnO、纳米TiO2和纳米CuO对月牙藻的毒性大小为纳米ZnO>纳米CuO>纳米TiO2,纳米CuO对月牙藻的毒性效应可以认为是从金属氧化粒子中溶出的金属离子造成的。Franklin等[32]发现,纳米ZnOpower和纳米ZnOdispersant从统计学意义上类似于ZnO和ZnCl2,其生长抑制的IC50(72 h)值范围从49 μg Zn·L-1~69 μg Zn·L-1。刘建新等[33]发现,在24 h时浓度为45 mg·L-1的纳米ZnO对羊角月牙藻的生长抑制率高达95%。Hall等[34]的毒性实验结果发现羊角月牙藻(IC251 ~ 2 mg·L-1)对纳米TiO2比网纹水蚤(IC259.4 ~ 26.4 mg·L-1)和黑头呆鱼(IC25>340 mg·L-1)更敏感。Hoecke等[35]对纳米CeO2对藻细胞的毒性效应做了5种猜想并通过实验加以验证。Pakrashi等[36]的研究表明,不同粒径的纳米Al2O3以及从纳米Al2O3中溶出的Al3+均能够对藻类产生毒性作用。Roy等[37]发现P25 TiO2对小球藻与栅藻的毒性效应有一定的区别。邓祥元等[38]发现,当纳米CeO2的浓度低于80 mg·L-1时可促进蛋白核小球藻的生长,当纳米CeO2的浓度大于80 mg·L-1时其对蛋白核小球藻表现出抑制作用,同时随着纳米CeO2浓度的不断增大,蛋白核小球藻体内的丙二醛(MDA)含量不断增大。
在纳米金属氧化物中,不同纳米金属氧化物对藻细胞的毒性大不相同,同时不同受试藻种对不同纳米金属氧化物的敏感程度也不同,因此,纳米金属氧化物藻细胞毒性效应的研究仍有很大的开发空间。
1.3 碳纳米材料
碳纳米管根据石墨片层数的不同可分为单壁纳米碳管(single-walled carbon nanotubes, SWCNTs)和多壁纳米碳管(multi-walled carbon nanotubes, MWCNTs)两类。已有人采用经超声处理和搅拌的2种双壁碳纳米管对骨藻和假微型海链藻进行毒性比较发现经超声处理的双壁碳纳米管对2种藻类的毒性更大[39]。Blaise等[40]发现单壁碳纳米管对月牙藻的72 h-IC25值是1.04 mg·L-1。还有研究表明多壁碳纳米管对杜氏藻的96 h-EC50值为(0.82±0.02) mg·L-1,认为这是由于多壁碳纳米管的遮光效应和团聚作用造成的[19]。杨晓静等[41]研究了单壁碳纳米管对小球藻的生长抑制影响发现在0.01 ~ 500 mg·L-1浓度内,96 h-EC50为261.5 mg·L-1,它能够抑制小球藻的生长。
碳纳米材料还包括C60、氧化石墨烯(GO)等材料。Wahid等[42]发现GO能够有效降低藻细胞的分裂速率。Nougeira等[43]认为,GO对月牙藻具有毒性的原因是GO促进细胞内部产生ROS及细胞膜破裂。Jian等[44]发现,GO对蛋白核小球藻的EC50约为37.3 mg·L-1,GO对蛋白核小球藻的遮蔽作用贡献率大约为16.4%。Hana等[45]发现,浓度为26.7 mg·L-1的C60对小球藻的生长抑制效果优于浓度为40 mg·L-1的C60。
目前,碳纳米管在医疗、环境监测中被广泛应用,碳纳米管对不同受试藻种的EC50值各不相同,因此仍有必要对不同藻种进行试验。
1.4 其他纳米材料
量子点是由有限数目的原子组成的一种三维团簇,尺寸大小在纳米量级。钟秋[46]发现硫化镉量子点对斜生栅藻的生长具有抑制作用,且当浓度为1 mg·L-1时对斜生栅藻具有显著抑制作用。
金属有机骨架材料是由金属离子与芳香多酸有机配体通过配位键作用形成的一类新型纳米多孔材料。随着纳米材料的广泛应用,包括金属有机骨架材料在内的纳米终将不可避免地通过各种途径进入水体、大气与土壤等环境。但以金属有机骨架材料为代表的致毒机理研究尚未深入。
2 纳米材料藻类毒性的影响因素(Factors affecting the toxicity of nanomaterials to algae)
不同种类的纳米材料对不同藻类的毒性效应不尽相同。一般而言,纳米材料的物化性质(如粒径、晶面结构等)、浓度不同,外界条件不同(如pH、溶解性有机质等),藻细胞自身的种类不同均会影响纳米材料对藻类的毒性。
2.1 纳米材料的物理化学性质对藻类的毒性影响
纳米粒子由于自身粒径大小的不同导致其对藻类的毒性大小也不同。Rodea-Palomares等[47]研究发现,当CeO2纳米粒子的粒径小于50 nm时对藻类的毒性最大。Tedescoa等[48]指出较大粒径的纳米粒子产生的毒性较小,这表明了生物对纳米粒子的反应中,粒径是一个关键因素。大部分的研究表明,通常纳米粒子的粒径越小,比表面积较大[49],因此它的毒性越大[50-51]。Hund-Rinke等[51]发现,粒径为25 nm的TiO2对藻类的EC50值为44 mg·L-1,而粒径为100 nm的TiO2对藻类的毒性相比粒径为25 nm的TiO2却小很多。Hoecke等[35]研究了粒径为14 nm、20 nm和29 nm的纳米CeO2对月牙藻的毒性效应,结果发现粒径为29 nm的纳米CeO2对月牙藻的抑制效果最明显。目前,纳米粒子的形状、外表与毒性大小的关系仍然不明确[52-53]。
张宁[54]研究了同一尺寸不同晶型纳米二氧化钛对小球藻的毒性效应,通过实验发现2种晶型的nTiO2对小球藻有不同程度的抑制作用,随着浓度增大,nTiO2(锐钛矿)的毒性逐渐增大,对小球藻的抑制率可高达83%。牟凤伟[55]通过检测斜生栅藻SOD和POD的生成情况,判断不同类型碳纳米管的毒性,结果发现4种碳纳米管的毒性大小为:短型双壁碳纳米管(short DWCNTs)>双壁碳纳米管(DWCNTs)>短型单壁碳纳米管(short SWCNTs)>单壁碳纳米管(SWCNTs)。
一般而言,纳米粒子浓度越大,对藻类的毒性越大。大多数研究表明纳米粒子对藻类的毒性存在剂量-效应关系,如Manier等[56]发现团聚的纳米CeO2对月牙藻的生长有抑制作用,且浓度越大,抑制效果越明显。其他的纳米粒子也已被发现对藻类具有剂量-效应关系,如纳米Fe、纳米Ni、纳米Ag等[16, 25, 57]。
由此可见,纳米材料的物化性质(如粒径、晶面结构等)、浓度均对藻类产生不同的毒性效应,但纳米材料的性质还有很多,如表面粗糙度、光催化性质等,这些性质是否会对藻类造成不同影响尚未可知,因此纳米材料的不同性质对藻类的毒性大小仍需更深入的研究。
2.2 水体性质对藻类的毒性影响
在实际水体中存在着多种多样的溶解性有机质,代表性种类有腐殖酸(HA)和富里酸(FA),它们对水生生态系统中的物理、化学和生物过程有着重要的影响。Xie等[58]发现溶解性有机质在天然水体中能够使C60发生团聚,使C60的形态和尺寸发生明显改变。Lamelas等[59]发现,HA能够改变纳米材料及离子浓度,间接影响其对藻类的毒性。Sun等[60]发现FA能够通过使纳米CuO溶出Cu2+、生成ROS、破坏DNA分子结构和细胞膜的渗透性,使藻细胞受损加剧。纳米材料进入实际水体后,其物理化学性质和细胞毒性必将受到溶解性有机质的影响。这是由于纳米材料表面含有配位体,必将与溶解性有机质发生相互作用,但其是否会使纳米材料毒性增强仍需深入研究。
2.3 不同藻种的影响
目前世界上已知有2 000多种藻类,这些不同的藻类分布于各大湖泊中。不同湖泊中藻种各异,当纳米材料进入水体中,不同藻种对不同纳米材料的敏感程度不同,纳米材料对藻类的毒性作用效果也不同。纳米Au对链带藻与月牙藻的EC50值分别为0.028 mg·L-1和0.014 mg·L-1[15]。Hazani等[16]将杜氏藻与小球藻分别置于纳米Ag悬浮液中,通过检测抗氧化酶系统损伤程度及MDA生成情况发现杜氏藻对纳米Ag的敏感度更高。雷静静等[61]通过纳米NiO对羊角月牙藻、小球藻和四尾栅藻进行毒性实验,对藻密度、叶绿素a、蛋白质浓度、SOD和CAT活力、MDA含量测定发现,纳米NiO对3种藻均具有抑制作用,但月牙藻对纳米NiO的敏感程度较低,小球藻和四尾栅藻对纳米NiO的敏感程度较高。胡冰等[62]通过实验发现纳米TiO2对新月菱形藻和小球藻的96 h-EEC50分别为13.693 mg·L-1和11.655 mg·L-1。

图3 CuO NPs对铜绿微囊藻细胞的致毒机理[17]Fig. 3 Toxic mechanism of CuO NPs on Microcystis aeruginosa [17]
3 纳米材料对藻类的致毒机理(Toxic mechanism of nanomaterials on algae)
Wang等[17]认为纳米CuO对铜绿微囊藻的致毒机理包括Cu2+释放、生成ROS、破坏DNA和改变细胞膜通透性,见图3。同时,还有研究表明,目前已知的纳米材料对藻类的毒性机理包括破坏细胞膜或膜电位、蛋白质氧化、遗传毒性,能量传递中断,形成活化氧或释放有毒成分等[63],见图4。目前,纳米材料对藻类的致毒机理还未彻底弄清,可能的机理包括金属离子释放、ROS生成和遮光效应等,纳米粒子可能通过一种或多种机制共同作用导致藻细胞死亡。
3.1 金属离子毒性
Vogelsberger等[64]发现1 mg·L-1金属及金属氧化物纳米粒子在水中大约能够溶解出1 μg的金属离子,因此金属离子对藻细胞的影响不可忽略。但不同研究者对金属离子对藻细胞的影响持有不同观点。一些学者认为纳米粒子对藻类的毒性主要来源于纳米粒子溶解于水中的金属离子。Miao等[65]认为,纳米Ag对海链藻的毒性作用是由于纳米Ag溶出了Ag+造成的。同样的Franklin等[32]认为纳米ZnOpower和纳米ZnOdispersant从统计学意义上类似于ZnO和ZnCl2,而纳米ZnO对羊角月牙藻的毒性主要取决于从纳米ZnO中溶解的Zn2+。而另一部分学者却认为金属离子对藻类的毒性作用并不明显。Saison等[66]研究发现,纳米CuO能够诱导莱衣藻产生ROS,改变细胞内部结构,使藻细胞光合系统受损,叶绿素含量显著降低,而将Cu2+加入至藻细胞悬浮液中,检测到的ROS浓度较低。Navarro等[67]也得出类似的结果。可见,不同纳米粒子对不同藻类作用所得出的致毒机理大不相同,因此仍需对金属及金属氧化物纳米粒子溶出的金属离子毒性开展更深入的研究。
3.2 氧化损伤
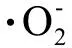
3.3 纳米粒子的遮光效应
纳米粒子的遮光效应将减少光系统II的功能光学截面[19]。Fabienne等[72]通过实验研究认为,抑制小球藻和月牙藻的生长是由于纳米碳管的遮光效应,并且生成了藻-纳米碳管聚合物。Lin等[73]的研究发现,在莱茵衣藻细胞表面吸附有许多QD,这可能是由于羧基与藻细胞壁上含胺基团的亲和能力较强。由于QD吸附于细胞表面,使营养物质摄取及细胞内外气体交换受到一定影响,从而抑制了藻细胞光合作用活性,但是在实验中没有发现细胞的死亡。但也有实验结果表明,纳米粒子对藻细胞没有遮蔽效应。如Wang等[17]通过高浓度纳米CuO遮挡铜绿微囊藻细胞悬浮液发现藻类的生长没有受到抑制,由此认为低浓度纳米CuO对铜绿微囊藻没有遮光效应。Hund-Rinke和Simon[51]利用遮光装置进行实验发现TiO2对斜栅藻的毒性效应也不存在遮光效应。

图4 纳米粒子对藻类的致毒机理[63]Fig. 4 Toxic mechanism of nanoparticles on algae[63]
由此可以看出不同纳米材料对不同藻种的毒性作用是否具有遮光效应均不同,因此有必要对不同种类的纳米粒子进行试验,探讨不同种类纳米粒子对不同藻种的毒性效应的致毒机理是否具有遮光效应。
4 结论与展望(Conclusion and prospect)
纳米材料的应用越来越广泛,但其对环境的影响也备受人们的关注。了解纳米材料的性质、毒性及致毒机理等尤为重要。目前,对纳米材料对藻类的毒性效应已有一定的研究基础,同时也就纳米材料对藻类的毒性效应达成一定的共识,例如纳米粒子的粒径、晶面结构等因素均能够影响其对藻类的毒性作用;纳米材料对藻类的致毒机制是氧化损伤,同时,金属纳米粒子由于能够溶出金属离子在一定程度上对某些藻类也造成了一定损伤。
虽然已有许多关于纳米材料对藻类的毒性研究,但仍需进一步深入的研究问题有:(1)纳米材料种类、尺度、维度、形貌、金属离子和配位体含量等对藻细胞毒性的影响规律目前尚未有深入研究。(2)由于纳米材料与水体中的藻种种类繁多,因此仍有很大一部分的纳米材料对水体中不同藻类的作用效果尚未探明。(3)目前大多数研究均选取藻类作为靶标评价纳米材料的毒性效应,但随着食物链的传递,其他生物体内积累的纳米材料毒性不容忽视,因此还应选取各地区具有代表性的高等生物进行纳米毒性安全评估。(4)水体环境复杂,在溶解性有机质和多种污染物存在的实际水体中,纳米材料进入水体后与水中的溶解性有机质是否会发生协同或拮抗作用,同时进入水体中的纳米材料的物化性质的改变对纳米材料藻细胞毒性的影响及作用机理是否发生一系列改变仍需要做进一步研究。
通讯作者简介:范功端(1984-),男,副教授,博士,硕士生导师,研究方向为水处理理论与技术,发表论文50余篇。
参考文献(References):
[1] Lin D, Xing B. Phytotoxicity of nanoparticles: Inhibition of seed germination and root growth[J]. Environmental Pollution, 2007, 150(2): 243-250
[2] Nagarajan R. Nanoparticles: Building Blocks for Nanotechnology[M]. Kluwer Academic/Plenum Publishers, 2008: 2-14
[3] Rocha T L, Gomes T, Sousa V S, et al. Ecotoxicological impact of engineered nanomaterials in bivalve molluscs: An overview[J]. Marine Environmental Research, 2015, 111: 74-88
[4] Biswas P, Wu C Y. Nanoparticles and the environment [J]. Journal of the Air and Waste Management Association, 2005, 55(6): 708-746
[5] Nowack B, Bucheli T D. Occurrence, behavior and effects of nanoparticles in the environment [J]. Environmental Pollution, 2007, 150(1): 5-22
[6] Farré M, Gajda-Schrantz K, Kantiani L, et al. Ecotoxicity and analysis of nanomaterials in the aquatic environment[J]. Analytical and Bioanalytical Chemistry, 2009, 393(1): 81-95
[7] Service R F. Nanotechnology grows up [J]. Science, 2004, 332(6034): 1140-1143
[8] Service R F. Nanomaterials show signs of toxicity [J]. Science, 2003, 300(5617): 243
[9] 章军,杨军,朱心强. 纳米材料的环境和生态毒理学研究进展[J]. 生态毒理学报, 2006, 1(4): 350-356
Zhang J, Yang J, Zhu X Q. The advancement of environmental and ecotoxicological research of nanomaterials [J]. Asian Journal of Ecotoxicology, 2006, 1(4): 350-356 (in Chinese)
[10] Wang Z, Li N, Zhao J, et al. CuO nanoparticle interaction with human epithelial cells: Cellular uptake, location, export, and genotoxicity [J]. Chemical Research in Toxicology, 2012, 25(7): 1512-1521
[11] Nel A, Xia T, Mädler L, et al. Toxic potential of materials at the nanolevel [J]. Science, 2006, 311(5761): 622-627
[12] Lam C W, James J T, Mccluskey R, et al. A review of carbon nanotube toxicity and assessment of potential occupational and environmental health risks [J]. Critical Reviews in Toxicology, 2006, 36(3): 189-217
[13] Monterio-Riviere N A, Nemanich R J, Inman A O, et al. Multi-walled carbon nanotube interactions with human epidermal keratinocytes [J]. Toxicology Letters, 2005, 155(3): 377-384
[14] Ji J, Long Z, Lin D. Toxicity of oxide nanoparticles to the green algaeChlorellasp. [J]. Chemical Engineering Journal, 2011, 170(s2-3): 525-530

[16] Hazani A A, Ibrahim M M, Shehata A I, et al. Ecotoxicity of Ag-nanoparticles on two microalgae,ChlorellavulgarisandDunaliellatertiolecta[J]. Archives of Biological Sciences, 2013, 65(4): 1447-1457
[17] Wang Z, Li J, Zhao J, et al. Toxicity and internalization of CuO nanoparticles to prokaryotic algaMicrocystisaeruginosaas affected by dissolved organic matter [J]. Environmental Science and Technology, 2011, 45(14): 6032-6040
[18] Nogueira P F M, Nakabayashi D, Zucolotto V. The effects of graphene oxide on green algaeRaphidocelissubcapitata[J]. Aquatic Toxicology, 2015, 166: 29-35
[19] Wei L, Thakkar M, Chen Y, et al. Cytotoxicity effects of water dispersible oxidized multiwalled carbon nanotubes on marine alga,Dunaliellatertiolecta[J]. Aquatic Toxicology, 2010, 100(2): 194-201
[20] Dash A, Singh A P, Chaudhary B R, et al. Effect of silver nanoparticles on growth of eukaryotic green algae[J]. Nano-Micro Letters, 2012, 4(3): 158-165
[21] Chae Y, An Y J. Toxicity and transfer of polyvinylpyrrolidone-coated silver nanowires in an aquatic food chain consisting of algae, water fleas, and zebrafish [J]. Aquatic Toxicology, 2016, 173: 94
[22] Ivask A, Kurvet I, Kasemets K, et al. Size-dependent toxicity of silver nanoparticles to bacteria, yeast, algae, crustaceans and mammalian cellsinvitro[J]. PloS One, 2014, 9(7): e102108
[23] Pillai S, Behra R, Nestler H, et al. Linking toxicity and adaptive responses across the transcriptome, proteome, and phenotype ofChlamydomonasreinhardtiiexposed to silver [J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(9): 3490-3495
[24] Oukarroum A, Bras S, Perreault F, et al. Inhibitory effects of silver nanoparticles in two green algae,ChlorellavulgarisandDunaliellatertiolecta[J]. Ecotoxicology and Environmental Safety, 2012, 78(2): 80-85
[25] Burchardt A D, Carvalho R N, Valente A, et al. Effects of silver nanoparticles in diatomThalassiosirapseudonanaand cyanobacteriumSynechococcussp. [J]. Environmental Science and Technology, 2012, 46(20): 11336-11344
[26] Tuominen M, Schultz E, Sillanpää M. Toxicity and stability of silver nanoparticles to the green algaPseudokirchneriellasubcapitatain boreal freshwater samples and growth media [J]. Nanomaterials and the Environment, 2013, 1: 48-57
[27] Iswarya V, Manivannan J, De A, et al. Surface capping and size-dependent toxicity of gold nanoparticles on different trophic levels [J]. Environmental Science and Pollution Research, 2015, 1: 1-15
[28] Bozich J, Lohse S, Torelli M, et al. Surface chemistry, charge and ligand type impact the toxicity of gold nanoparticles toDaphniamagna[J]. Environment Science Nano, 2014, 1(3): 260-270
[29] 傅凤,刘振乾,陈传红. 纳米铜粉对浮游植物生长的影响[J]. 生态科学, 2007, 26(2): 126-130
Fu F, Liu Z Q, Chen C H. Pilot study about effects of copper nanoparticle on phytoplankton growth [J]. Ecologic Science, 2007, 26(2): 126-130 (in Chinese)
[30] 李芳芳,潘容,张偲,等. 纳米铜粉对中肋骨条藻的毒性效应[J]. 中国环境科学, 2015, 35(9): 2874-2880
Li F F, Pan R, Zhang C, et al. Inhibition effects of copper nanoparticles on the growth ofSkeletonemacostatum[J]. China Environmental Science, 2015, 35(9): 2874-2880 (in Chinese)
[31] Aruoja V, Dubourguier H C, Kasemets K, et al. Toxicity of nanoparticles of CuO, ZnO and TiO2to microalgaePseudokirchneriellasubcapitata[J]. Science of the Total Environment, 2009, 407(4): 1461-1468
[32] Franklin N M, Rogers N J, Apte S C, et al. Comparative toxicity of nanoparticulate ZnO, bulk ZnO, and ZnCl2to a freshwater microalga (Pseudokirchneriellasubcapitata): The importance of particle solubility[J]. Environmental Science and Technology, 2007, 41(24): 8484-8490
[33] 刘建新,杜青平,陈展明,等. 纳米氧化锌对羊角月牙藻毒性效应及其在藻细胞内外的分布[J]. 生态毒理学报, 2016, 11(5): 103-110
Liu J X, Du Q P, Chen Z M, et al. Toxicities of ZnO nanoparticles onSelenastrumcapricornutumand its distributions in intra- and extra-cells [J]. Asian Journal of Ecotoxicology, 2016, 11(5): 103-110 (in Chinese)
[34] Hall S, Bradley T, Moore J T, et al. Acute and chronic toxicity of nano-scale TiO2particles to freshwater fish, cladocerans, and green algae, and effects of organic and inorganic substrate on TiO2toxicity [J]. Nanotoxicology, 2009, 3(2): 91-97
[35] Hoecke K V, Quik J T K, Mankiewiczboczek J, et al. Fate and effects of CeO2nanoparticles in aquatic ecotoxicity tests [J]. Environmental Science and Technology, 2009, 43(12): 4537-4546
[36] Pakrashi S, Dalai S, Prathna T C, et al. Cytotoxicity of aluminium oxide nanoparticles towards fresh water algal isolate at low exposure concentrations [J]. Aquatic Toxicology, 2013, 132-133(10): 34-45
[37] Roy R, Parashar A, Bhuvaneshwari M, et al. Differential effects of P25 TiO2nanoparticles on freshwater green microalgae:ChlorellaandScenedesmusspecies [J]. Aquatic Toxicology, 2016, 176: 161-171
[38] 邓祥元,胡小丽,成婕,等. 纳米二氧化铈对蛋白核小球藻的生物学效应研究[J]. 生态毒理学报, 2016, 11(5): 111-116
Deng X Y, Hu X L, Cheng J, et al. Effects of nanoparticle CeO2on the physiology ofChlorellapyrenoidosa[J]. Asian Journal of Ecotoxicology, 2016, 11(5): 111-116 (in Chinese)
[39] Kwok K W, Leung K M, Flahaut E, et al. Chronic toxicity of double-walled carbon nanotubes to three marine organisms: Influence of different dispersion methods [J]. Nanomedicine, 2010, 5(6): 951-961
[40] Blaise C, Gagné F, Férard J F, et al. Ecotoxicity of selected nano-materials to aquatic organisms [J]. Environmental Toxicology, 2008, 23(5): 591-598
[41] 杨晓静,陈灏,闫海,等. 纳米二氧化钛和单壁碳纳米管对普通小球藻生长的抑制效应[J]. 生态毒理学报, 2010, 5(1): 38-43
Yang X J, Chen H, Yan H, et al. Effects of nano-TiO2and single-walled carbon nanotubes on the growth ofChlorellavulgaris[J]. Asian Journal of Ecotoxicology, 2010, 5(1): 38-43 (in Chinese)
[42] Wahid M H, Eroglu E, Chen X, et al. Entrapment ofChlorellavulgariscells within graphene oxide layers [J]. RSC Advances, 2013, 3(22): 8180-8183
[43] Nogueira P F, Nakabayashi D, Zucolotto V. The effects of graphene oxide on green algaeRaphidocelissubcapitata[J]. Aquatic Toxicology (Amsterdam, Netherlands), 2015, 166(8): 29
[44] Jian Z, Cao X, Wang Z, et al. Mechanistic understanding toward the toxicity of graphene-family materials to freshwater algae [J]. Water Research, 2016, 111: 18-27
[45] Hana H, Kubatova K, Zemanova Z, et al. Evaluation of effects of C60fullerene and its derivatives on selected microorganisms [J]. 材料科学与工程: 中英文B版, 2013, 13(7): 409-417
[46] 钟秋. 纳米二氧化铈和硫化镉量子点对水生生物的毒性研究[D]. 武汉: 华中师范大学, 2013: 22-23
Zhong Q. The toxicity of nano cerium dioxicide and cadmium sulfide quantum dots to tow aquatic organisms [D]. Wuhan: Central China Normal University, 2013: 22-23 (in Chinese)
[47] Rodea-Palomares I, Boltes K, Fernandez-Pinas F, et al. Physicochemical characterization and ecotoxicological assessment of CeO2nanoparticles using two aquatic microorganisms [J]. Toxicological Sciences, 2011, 199(1): 135-145
[48] Tedescoa S, Doyle H, Blasco J, et al. Oxidative stress and toxicity of gold nanoparticles inMytilusedulis[J]. Aquatic Toxicology, 2010, 100: 178-186
[49] 白伟,张程程,姜文君,等. 纳米材料的环境行为及其毒理学研究进展[J]. 生态毒理学报, 2009, 4(2): 174-182
Bai W, Zhang C C, Jiang W J, et al. Progress in studies on environmental behaviors and toxicological effects of nanomaterials [J].Asian Journal of Ecotoxicology, 2009, 4(2): 174-182 (in Chinese)
[50] Tedesco S, Doyle H, Blasco J, et al. Exposure of the blue mussel,Mytilusedulis, to gold nanoparticles and the pro-oxidant menadione[J]. Comparative Biochemistry and Physiology Part C Toxicology and Pharmacology, 2010, 151(2): 167-174
[51] Hund-Rinke K, Simon M. Ecotoxic effect of photocatalytic active nanoparticles (TiO2) on algae and Daphnids [J]. Environmental Science and Pollution Research, 2006, 13(4): 225-232
[52] Matzke M, Jurkschat K, Backhaus T. Toxicity of differently sized and coated silver nanoparticles to the bacteriumPseudomonasputida: Risks for the aquatic environment?[J]. Ecotoxicology, 2014, 23: 818-829
[53] Coleman J G, Kennedy A J, Bednar A J, et al. Comparing the effects of nanosilver size and coating variations on bioavailability, internalization, and elimination, usingLumbriculusvariegatus[J]. Environmental Toxicology and Chemistry, 2013, 32(9): 2069-2077
[54] 张宁. 人工纳米材料对藻类的生物效应研究[D]. 天津: 天津理工大学, 2011: 16-19
Zhang N. Biological effects of artificial nanomaterials on alga [D]. Tianjin: Tianjin University of Technology, 2011: 16-19 (in Chinese)
[55] 牟凤伟. 不同类型的碳纳米管对斜生栅藻的毒性效应研究[D]. 长沙: 中南林业科技大学, 2013 : 43-44
Mou F W. The toxicity effects of different types of CNTs onScenedesmusobliquus[D]. Changsha: Central South University of Forestry and Technology, 2013: 43-44 (in Chinese)
[56] Manier N, Bado-Nilles A, Delalain P, et al. Ecotoxicity of non-aged and aged CeO2nanomaterials towards freshwater microalgae [J]. Environmental Pollution, 2013, 180(3): 63-70
[57] 汪静, 刘娅琛, 曲冰, 等. 金属纳米颗粒对蛋白核小球藻生长活性的影响[J]. 大连海洋大学学报, 2011, 26(5): 386-390
Wang J, Liu Y C, Qu B, et al. The effect of the metal nanoparticles (Fe/Ni) on growth in algaChlorellapyrenoidosa[J]. Journal of Dalian Ocean University, 2011, 26(5): 386-390 (in Chinese)
[58] Xie B, Xu Z, Guo W, et al. Impact of natural organic matter on the physicochemical properties of aqueous C60 nanoparticles [J]. Environmental Science and Technology, 2008, 42(8): 2853-2859
[59] Lamelas C, Slaveykova V I. Comparison of Cd(II), Cu(II), and Pb(II) biouptake by green algae in the presence of humic acid [J]. Environmental Science and Technology, 2007, 41(11): 4172-4178
[60] Sun P, Shijirbaatar A, Jing F, et al. Distinguishable transport behavior of zinc oxide nanoparticles in silica sand and soil columns[J]. Science of the Total Environment, 2015, 505: 189-198
[61] 雷静静,冯佳,谢树莲. 纳米氧化镍对3种绿藻的毒性效应[J]. 中国环境科学, 2013, 33(10): 1842-1849
Lei J J, Feng J, Xie S L. Toxic effects of nNiO on three species of green algae [J]. China Environmental Science, 2013, 33(10): 1842-1849 (in Chinese)
[62] 胡冰,王华,张冬冬,等. 纳米TiO2和Cu(Ⅱ)、Zn(Ⅱ)对小球藻和新月菱形藻的毒性研究[J]. 大连海洋大学学报, 2015(5): 489-493
Hu B, Wang H, Zhang D D, et al. Toxicity of TiO2nanoparticles, Cu(Ⅱ) and Zn(Ⅱ) toChlorellasp. andNitzschiaclosterium[J]. Journal of Dalian Ocean University, 2015(5): 489-493 (in Chinese)
[63] Klaine S J, Alvarez P J J, Batley G E, et al. Nanomaterials in the environment: Behavior, fate, bioavailbility and effects[J]. Environmental Toxicology and Chemistry, 2008, 27(9): 1825-1851
[64] Vogelsberger W, Schmidt J, Roelofs F. Dissolution kinetics of oxidic nanoparticles: The observation of an unusual behaviour [J]. Colloids and Surfaces A Physicochemical and Engineering Aspects, 2008, 324(1-3): 51-57
[65] Miao A J, Schwehr K A, Xu C, et al. The algal toxicity of silver engineered nanoparticles and detoxification by exopolymeric substances [J]. Environmental Pollution, 2009, 157(11): 3034-3041
[66] Saison C, Perreault F, Daigle J C, et al. Effect of core-shell copper oxide nanoparticles on cell culture morphology and photosynthesis (photosystem II energy distribution) in the green alga,Chlamydomonasreinhardtii[J]. Aquatic Toxicology, 2010, 96(2): 109-114
[67] Navarro E, Piccapietra F, Wagner B, et al. Toxicity of silver nanoparticles toChlamydomonasreinhardtii[J]. Environmental Science and Technology, 2008, 42(23): 8959-8964
[68] 王震宇,赵建,李娜,等. 人工纳米颗粒对水生生物的毒性效应及其机制研究进展[J]. 环境科学, 2010, 31(6): 1409-1418
Wang Z Y, Zhao J, Li N, et al. Review of ecotoxicity and mechanism of engineered nanoparticles to aquatic organisms [J]. Environmental Science, 2010, 31(6): 1049-1418 (in Chinese)
[69] Xia T, Kovochich M, Liong M, et al. Cationic polystyrene nanosphere toxicity depends on cell-specific endocytic and mitochondrial injury pathways [J]. ACS Nano, 2008, 2(1): 85-96
[70] 马菲菲,孙雪梅,韩倩,等. 不同粒径TiO2颗粒对海洋微藻的毒性效应[J]. 海洋学报, 2015, 37(10): 100-105
Ma F F, Sun X M, Han Q, et al. Toxic effects of TiO2particles with different size on the marine microalga [J]. Haiyang Xuebao, 2015, 37(10): 100-105 (in Chinese)
[71] Wang J, Zhang X, Chen Y, et al. Toxicity assessment of manufactured nanomaterials using the unicellular green algaChlamydomonasreinhardtii[J]. Chemosphere, 2008, 73(7): 1121-1128
[72] Fabienne S, Bucheli T D, Lukhele L P, et al. Are carbon nanotube effects on green algae caused by shading and agglomeration?[J]. Environmental Science and Technology, 2011, 45(14): 6136-6144
[73] Lin S, Bhattacharya P, Rajapakse N C, et al. Effects of quantum dots adsorption on algal photosynthesis [J]. Journal of Physical Chemistry C, 2009, 113(25): 10962-10966

