MgSO4处理对西兰花芽苗菜生理活性物质和抗氧化能力的影响
初 婷,彭 畅,郭丽萍*
(青岛农业大学食品科学与工程学院,山东 青岛 266109)
流行病学研究表明,经常摄入西兰花、甘蓝等十字花科蔬菜有助于预防肺癌、胃癌、乳腺癌、胰腺癌等癌症的发生[1],这主要是因为在这些蔬菜中含有丰富的硫代葡萄糖苷(简称硫苷),其在黑芥子酶的作用下生成的异硫氰酸酯通过抑制体内Ⅰ相致癌酶的产生,诱导产生Ⅱ相解毒酶并增强其活性,从而起到预防和治疗癌症的作用[1]。此外,异硫氰酸酯还具有抑菌、抗氧化、抗炎及预防心血管疾病等作用[2]。硫苷根据侧链结构可以分为脂肪族、芳香族和吲哚族硫苷[3]。
研究表明,西兰花中脂肪族硫苷含量较多,占总硫苷的70%左右,其中萝卜硫苷含量最多,占硫苷总量的50%以上[4];西兰花芽苗菜中硫苷含量是成熟西兰花的10~100 倍[5]。萝卜硫苷的降解产物萝卜硫素是目前发现的抗癌作用最强的异硫氰酸酯[6],引起了国内外的广泛关注,因此西兰花芽苗作为一种新型的具有保健功能的蔬菜和功能食品原料具有广阔的前景。此外,西兰花芽苗菜中还含有丰富的酚类物质、花色苷和抗坏血酸等,它们都是重要的抗氧化物质,能够消除体内过多的自由基[7]。
随着西兰花芽苗菜生理活性的进一步证实[8],如何提高西兰花芽苗菜中生物活性物质的积累已成为研究热点。硫苷作为十字花科中一种特有的含硫物质,有学者试图通过硫肥的添加而提高植物中硫苷含量。Yang Runqiang等[9]研究了含硫化合物K2SO4、ZnSO4和甲硫氨酸等对西兰花芽苗生理活性物质的影响,发现ZnSO4处理后西兰花芽苗生长受到抑制,但其中的总硫苷、总酚、异硫氰酸酯和抗坏血酸物质的含量显著增加,黑芥子酶活力也显著提高。Aires等[10]对西兰花芽苗同时施加K2SO4和KCl,但并未发现硫苷含量有所增加,其中的总酚、抗坏血酸等物质含量也无显著变化。当抗坏血酸存在时,Mg2+可以提高黑芥子酶活性,从而促进硫苷分解生成异硫氰酸酯[11]。MgSO4作为植物生长过程中常用的肥料,对于西兰花芽苗菜中抗坏血酸、总酚、硫苷和异硫氰酸酯的富集以及抗氧化能力的影响鲜见报道。
本实验在西兰花种子发芽过程中,通过外源喷施25、50 mmol/L和75 mmol/L的MgSO4溶液,研究西兰花芽苗菜在发芽5 d和8 d时的生长状况和叶绿素、硫苷、异硫氰酸酯、总酚、抗坏血酸含量以及黑芥子酶活力、抗氧化能力的变化,为西兰花芽苗菜的工业化生产及相应功能性食品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
西兰花种子购于杭州三雄种苗有限公司。
萝卜硫素标准品、硫酸酯酶、抗坏血酸、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;二氯甲烷、没食子酸、福林-酚试剂、牛血清白蛋白、考马斯亮蓝、铁氰化钾、三氯化铁、硫酸镁 国药集团上海化学试剂有限公司;乙腈(色谱纯) 上海陆都化学试剂厂;葡萄糖测定试剂盒 南京建成生物工程公司。
1.2 仪器与设备
UV-2000紫外可-见分光光度计 尤尼柯(上海)仪器有限公司;AE100电子天平 上海天达仪器有限公司;TDL-5离心机 上海安亭科学仪器厂;1200高效液相色谱(high performance liquid chromatography,HPLC)仪 美国安捷伦公司;光照培养箱 上海高致精密仪器有限公司;DK-S24型电热恒温水浴锅 龙口市先科仪器有限公司。
1.3 方法
1.3.1 西兰花种子发芽方法
将西兰花种子用次氯酸钠消毒后,用蒸馏水洗至中性,于30 ℃恒温水浴锅中浸泡4 h。浸泡后的西兰花种子均匀播种于铺有蛭石的4 个小盒中,置于带有自动喷雾的发芽机中,于25 ℃条件下发芽(16 h光照、8 h黑暗),1 d后,停止喷雾,每天喷施MgSO4溶液20 mL,浓度分别为25、50、75 mmol/L,以喷施蒸馏水作为对照,分别于发芽5、8 d后取样测定。
1.3.2 芽苗菜芽长与鲜质量的测定
将每个浓度的西兰花芽苗都随机抽取30 根芽苗为一个样本,测量其长度,并称质量,计算每根芽苗的质量。
1.3.3 叶绿素含量的测定
按王学奎[12]的方法,取1.0 g西兰花芽苗加入10 mL 95%的乙醇溶液研磨至组织变白,静置5 min后过滤,以95%乙醇为空白,在波长665 nm和649 nm处测定吸光度。按式(1)计算叶绿素含量。
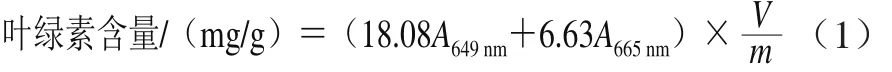
式中:V表示叶绿素提取的体积/mL;m表示样品的质量/g。
1.3.4 总硫苷含量的测定
根据Tian Ming等[13]的方法。取0.5 g西兰花芽苗,加入3.0 mL蒸馏水研磨均匀,于37 ℃水浴酶解反应1 h以使硫苷完全被内源黑芥子酶酶解;同时,另取一份样品,加入3.0 mL酸化甲醇研磨成匀浆后,于80 ℃加热5 min灭酶,以此为对照。然后向样品中加入2.0 mL 100%甲醇和2~3 mg活性炭,使其中的多酚类化合物沉淀后,10 000×g离心10 min,收集上清液。用葡萄糖试剂盒测定葡萄糖含量,由硫苷分解生成的葡萄糖的物质的量与硫苷的物质的量相等,以此计算硫苷物质的量,结果以鲜质量计,单位为μmol/g。
1.3.5 黑芥子酶活力的测定
黑芥子酶活力的测定按郭丽萍等[14]的方法。以每分钟被黑芥子酶转化生成1 nmol葡萄糖为1 个酶活力单位,酶活力单位为U/mg。
1.3.6 萝卜硫素含量的测定
根据参考文献[14]的方法。取0.5 g西兰花芽苗菜,加4 mL蒸馏水研磨,利用内源酶进行酶解后,加入二氯甲烷萃取,蒸干二氯甲烷后用体积分数10%乙腈溶解,进HPLC分析。检测波长为254 nm,紫外检测器,流速为0.6 mL/min,柱温为30 ℃。洗脱程序:0 min~25 min~30 min,乙腈洗脱体积分数为10%~60%~100%。结果以mg/g鲜质量表示。
1.3.7 抗坏血酸含量的测定
采用王志英等[15]的方法测定抗坏血酸的含量。用20 g/L草酸提取西兰花芽苗菜中抗坏血酸,然后用HPLC进行分析测定。SB-C18色谱柱;检测波长254 nm;流速0.8 mL/min;柱温30 ℃;进样量20 μL;流动相为V(0.1%草酸)∶V(甲醇)=95∶5。结果以鲜质量表示。
1.3.8 总酚含量的测定
总酚含量的测定参考文献[14]的方法。称取0.2 g西兰花芽苗菜,加入50%甲醇研磨匀浆后离心,取上清液1 mL,加入1 mL福林-酚试剂、2 mL 20 g/L Na2CO3,暗处反应2 h,于765 nm波长处测定吸光度。以没食子酸作标准曲线,结果以鲜质量表示。
1.3.9 H2O2清除率的测定
H2O2清除率的测定参考文献[16]。称取0.5 g的西兰花芽苗,加入5.0 mL 50%乙醇进行研磨,将匀浆液10 000×g离心15 min,取上清液1 mL,加入4 mL 10 mmol/L的H2O2溶液,用蒸馏水定容至100 mL,在248 nm波长处测定吸光度(A1);同时测定不加样品的H2O2溶液(A0)和不加H2O2溶液的样品(A2)的吸光度。H2O2清除率按式(2)计算。
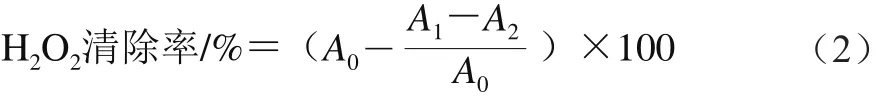
1.3.10 DPPH自由基清除率的测定
取1.0 mL 1.3.9节的上清液,与0.3 mL 40 μmol/L DPPH无水乙醇溶液、2.0 mL蒸馏水混合,摇匀后于室温下避光放置30 min,于517 nm波长处测定吸光度(A1)。同时测定不加样品的DPPH无水乙醇溶液的吸光度(A0)和不加DPPH无水乙醇溶液的样品液的吸光度(A2)。DPPH自由基清除率按式(3)计算。)
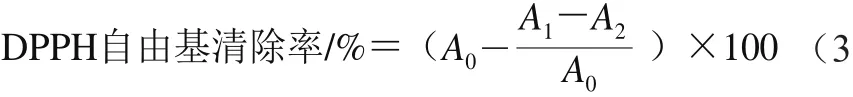
1.4 数据分析
实验设3 次重复,各指标重复测定3 次,结果以表示。实验数据采用SPSS 19.0软件进行统计分析,均值间比较采用Duncan’s多重比较,在0.05水平上进行显著性检验。
2 结果与分析
2.1 MgSO4处理对西兰花芽苗菜芽长与鲜质量的影响
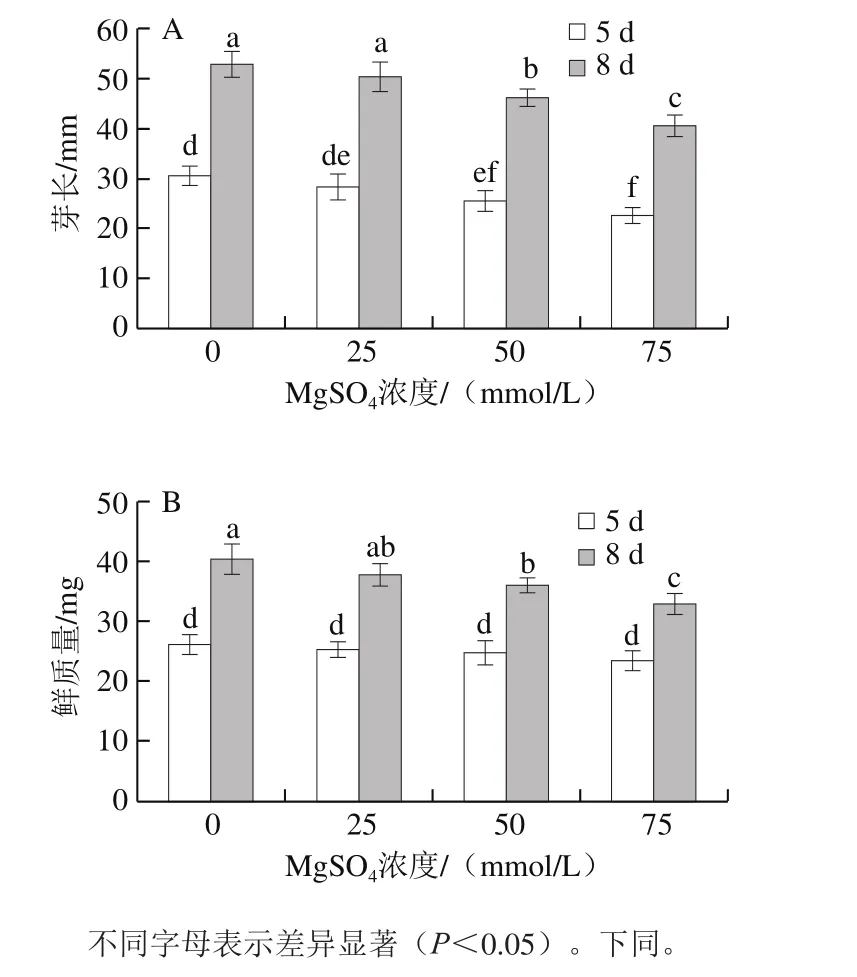
图1 MgSO4处理对西兰花芽苗菜芽长(A)和鲜质量(B)的影响Fig. 1 Effect of MgSO4 treatment on sprout length (A) and fresh weight (B) of broccoli sprouts
图1结果表明,MgSO4对西兰花芽苗菜造成了一定的胁迫作用,降低了其产量。25 mmol/L MgSO4处理下,西兰花芽苗菜芽长和鲜质量与对照组相比均无显著差异,虽然不同浓度处理组芽苗菜在发芽5 d时的芽长与对照组相比下降(图1A),但是鲜质量却与对照组无显著差异(图1B);与对照组相比,在发芽8 d时50 mmol/L MgSO4处理组芽苗菜的芽长和鲜质量分别降低12.6%和10.8%,75 mmol/L MgSO4处理组分别降低23.3%和18.6%。
2.2 MgSO4处理对西兰花芽苗菜叶绿素含量的影响
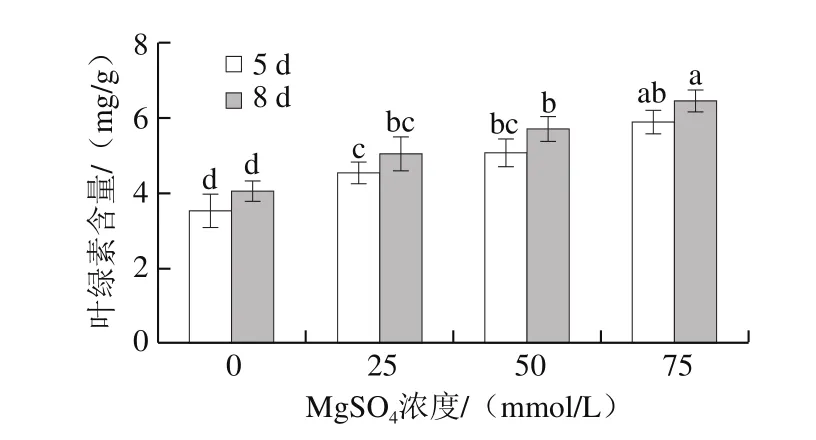
图2 MgSO4处理对西兰花芽苗菜叶绿素含量的影响Fig. 2 Effect of MgSO4 treatment on chlorophyll content in broccoli sprouts
如图2所示,发芽5 d和8 d时,不同浓度MgSO4处理组西兰花芽苗菜中叶绿素含量无显著性差异。MgSO4处理显著提高了西兰花芽苗菜中叶绿素含量,叶绿素含量随着MgSO4浓度的增大逐渐增加; 25、50 mmol/L和75 mmol/L MgSO4处理组西兰花芽苗菜中叶绿素含量在发芽5 d时分别较对照组增加29.0%、44.0%和67.3%;在发芽8 d时,分别增加25.1%、41.9%和60.1%。
2.3 MgSO4处理对西兰花芽苗菜总硫苷含量的影响
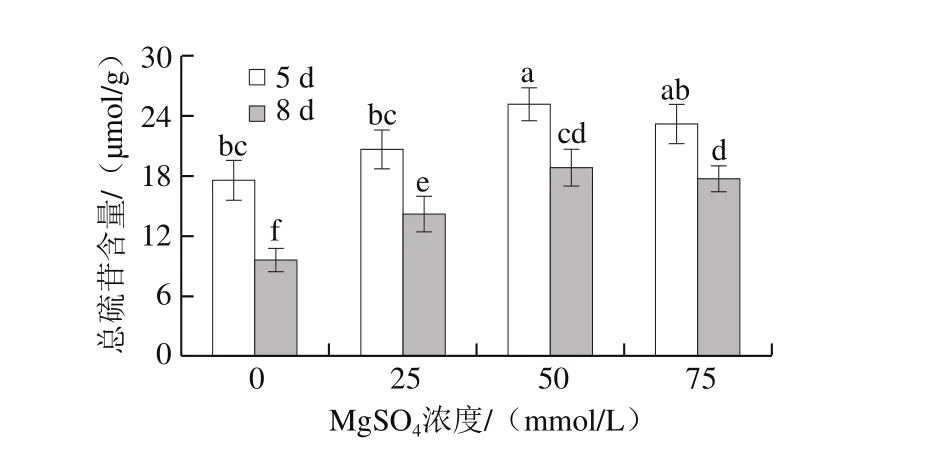
图3 MgSO4处理对西兰花芽苗菜总硫苷含量的影响Fig. 3 Effect of MgSO4 treatment on total glucosinolate content in broccoli sprouts
图3结果表明,发芽8 d的西兰花芽苗菜中总硫苷含量显著低于发芽5 d的,MgSO4处理显著提高了西兰芽苗菜中总硫苷含量。随着MgSO4浓度的增大,总硫苷含量先增加后降低,经50 mmol/L MgSO4处理后芽苗菜中总硫苷含量最高;50 mmol/L MgSO4处理组的芽苗菜,总硫苷含量在发芽5、8 d时分别是对照、25、75 mmol/L MgSO4处理组的1.42、1.21、1.08 倍和1.93、1.33、1.06 倍;在50 mmol/L MgSO4处理下,发芽8 d时的芽苗菜较发芽5 d时总硫苷含量下降了25.08%。
2.4 MgSO4处理对西兰花芽苗菜黑芥子酶活力的影响
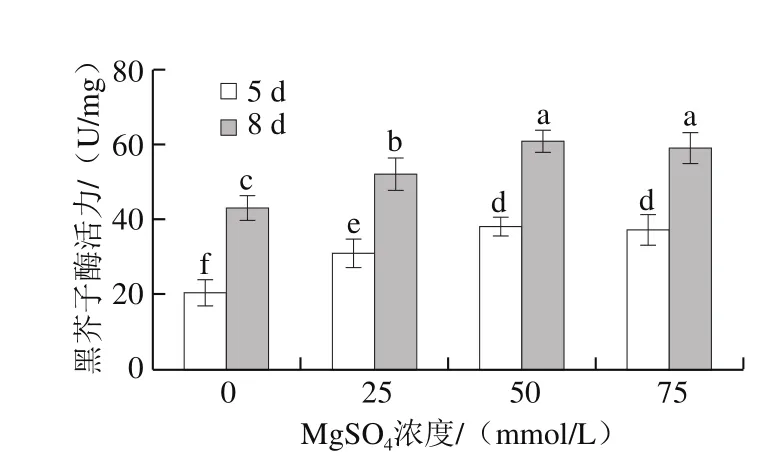
图4 MgSO4处理对西兰花芽苗菜黑芥子酶活力的影响Fig. 4 Effect of MgSO4 treatment on myrosinase activity in broccoli sprouts
由图4可知,MgSO4处理显著提高了黑芥子酶活力,对于发芽时间相同的芽苗菜,50 mmol/L和75 mmol/L MgSO4处理组之间无显著差异。在50 mmol/LMgSO4处理下,发芽5 d和8 d芽苗菜的黑芥子酶活力分别是对照组的1.83 倍和1.41 倍;0、25、50 mmol/L和75 mmol/L MgSO4处理后,发芽8 d的西兰花芽苗菜中黑芥子酶活力分别是发芽5 d的2.06、1.69、1.59 倍和1.59 倍。
2.5 MgSO4处理对西兰花芽苗菜萝卜硫素含量的影响
从图5可知,对于相同浓度MgSO4处理组,发芽8 d的西兰花芽苗菜中萝卜硫素含量显著低于发芽5 d的;MgSO4处理显著提高了芽苗菜中萝卜硫素含量,但对于发芽时间相同的芽苗菜,50 mmol/L和75 mmol/L MgSO4处理组之间无显著差异;50 mmol/L MgSO4处理下,发芽5 d和8 d的芽苗菜中萝卜硫素含量分别较对照组增加了54.5%和68.2%。
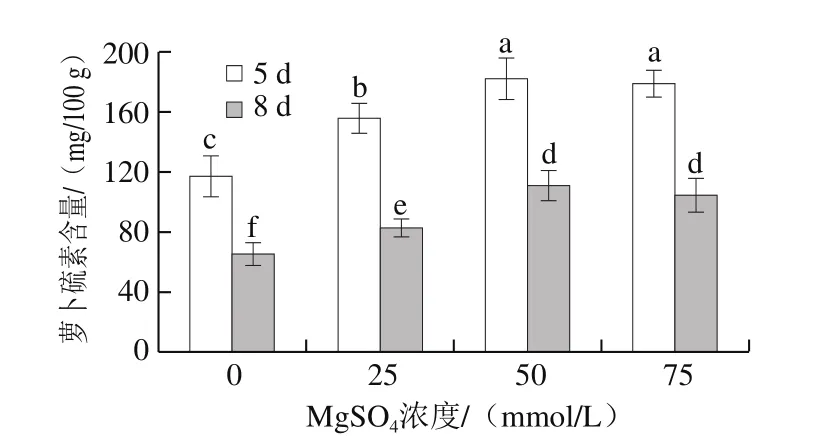
图5 MgSO4处理对西兰花芽苗菜萝卜硫素含量的影响Fig. 5 Effect of MgSO4 treatment on sulforaphane content in broccoli sprouts
2.6 MgSO4处理对西兰花芽苗菜总酚和抗坏血酸含量的影响
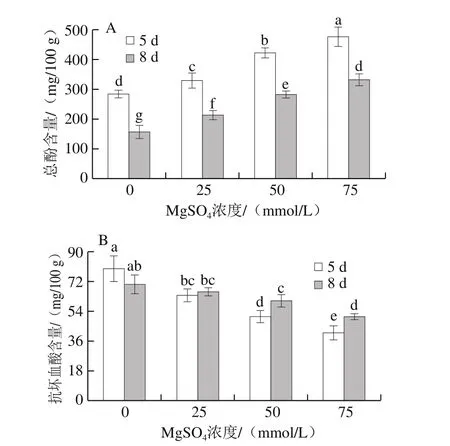
图6 MgSO4处理对西兰花芽苗菜总酚(A)和抗坏血酸(B)含量的影响Fig. 6 Effect of MgSO4 treatment on the contents of total phenoics (A)and ascorbic acid (B) in broccoli sprouts
西兰花芽苗菜中总酚含量随着MgSO4浓度的增加不断增加(图6A),且发芽5 d的芽苗菜中总酚含量高于发芽8 d的;25、50 mmol/L和75 MgSO4处理下,发芽5 d的芽苗菜中总酚含量分别较对照组高15.4%、47.7%和66.9%,而发芽8 d的芽苗菜中总酚含量分别较对照组高32.8%、78.3%和109.6%。与此相反,经MgSO4处理后,抗坏血酸含量却显著降低(图6B),对照组和25 mmol/L MgSO4处理组芽苗菜在发芽5 d和8 d时抗坏血酸含量无显著差异;50 mmol/L和75 mmol/LMgSO4处理组芽苗菜在发芽8 d时时抗坏血酸含量高于发芽5 d的;75 mmol/L MgSO4处理组在发芽5 d和8 d时抗坏血酸含量分别比对照组低48.9%和28.7%。
2.7 MgSO4处理对西兰花芽苗菜DPPH自由基清除率和H2O2清除率的影响
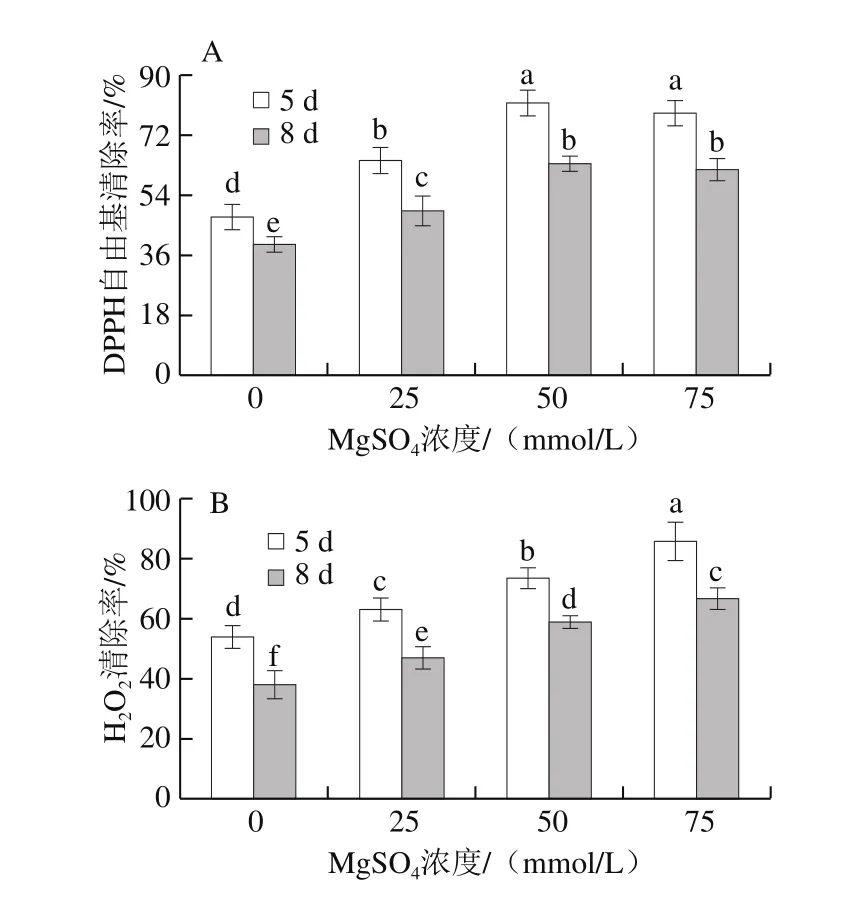
图7 MgSO4处理对西兰花芽苗菜DPPH自由基清除率(A)和H2O2清除率(B)的影响Fig. 7 Effect of MgSO4 treatment on scavenging capacity against DPPH radical (A) and H2O2 (B) of broccoli sprouts
图7A结果表明,菜在发芽5 d的西兰花芽苗清除DPPH自由基的能力显著高于发芽8 d的,经MgSO4处理后,清除DPPH自由基的能力显著增强,但50 mmol/L和75 mmol/L MgSO4处理组之间无显著差异;50 mmol/L MgSO4处理组芽苗菜在发芽5 d和8 d时,其DPPH自由基清除率分别是对照组的1.7 倍和1.6 倍,发芽5 d的芽苗菜DPPH自由基清除率较发芽8 d的提高28.1%。而西兰花芽苗菜的H2O2清除率随着MgSO4浓度的增加逐渐增强,25、50 mmol/L和75 mmol/L MgSO4处理组在发芽5 d和8 d时,对DPPH自由基清除率分别是对照组的1.17、1.37、1.59 倍和1.24、1.55、1.76 倍。
3 讨 论
有活力的种子经吸水后开始萌发,期间发生了一系列生理生化变化,如淀粉、蛋白质水解,大分子物质合成,亚细胞结构变化和细胞伸长等。西兰花芽苗菜喷施不同浓度的MgSO4溶液处理后,发芽5 d芽苗菜的生长无显著变化,显著降低了发芽8 d芽苗菜的芽长和鲜质量;表明过量的MgSO4溶液对西兰花芽苗菜造成胁迫效应,作用大小与喷施时间和浓度有关。镁是叶绿素卟啉环位于中央位置的一个具有螯合效应的中心金属元素,它是形成叶绿素结构的重要元素,且MgSO4能显著提高大豆根系的叶绿素含量[17],本实验也得到相似的结果,MgSO4显著提高了西兰花芽苗菜中叶绿素含量。
Falk等[18]研究表明,植物中30%的硫来源于硫苷,给植物施用硫肥,其可以以硫的形式进入到植物体内,对于硫苷的合成起到了很大的帮助;然而,当植物缺乏硫时,其中的硫苷就会被分解,产生的硫以硫源形式合成其他含硫的物质或者供给植物生长,这大大降低了硫苷的含量。植物在生长过程中,伴随着硫苷的合成与分解,硫苷含量逐渐下降[19],本研究中发芽8 d西兰花芽苗菜中总硫苷含量也显著低于发芽5 d芽苗菜,主要是因为随着芽苗菜的生长硫苷在芽苗中得到稀释。当植物遭受适当的胁迫(如热激、低氧、NaCl等)[20-21]或添加外源物质(茉莉酸、油菜素内酯、蔗糖、茉莉酸甲酯)[22-24]时,硫苷作为植物中重要的次生代谢产物,其含量会得到积累;但是当胁迫作用到一定程度后,次生代谢产物含量不会继续增加[20]。本研究中,总硫苷含量经MgSO4处理后显著增加,50 mmol/L MgSO4处理时达到最高,且与75 mmol/L MgSO4处理组之间无显著差异。一方面的原因可能是MgSO4对西兰花芽苗造成的胁迫效应,使硫苷含量得到积累;另一个原因可能是MgSO4作为硫源,促进了硫苷的合成,但具体机理有待于进一步阐明。
硫苷在黑芥子酶的作用下,生成异硫氰酸酯等化合物,芸薹属植物中存在表皮特异硫蛋白,其可以使硫苷朝着腈类物质的方向水解,从而降低异硫氰酸酯含量,而腈类物质是没有抗癌等生物活性的[25]。因此,硫苷的含量和黑芥子酶的活性对于异硫氰酸酯的形成至关重要。黑芥子酶活性的变化与植物的种类和品种密切相关,在发芽5 d的甘蓝芽苗菜中黑芥子酶活力先增大后减小[15],发芽5 d的萝卜芽苗菜中黑芥子酶活力高于发芽3 d和7 d的芽苗菜[26],而西兰花芽苗菜在发芽的7 d内,黑芥子酶活力随发芽时间的延长逐渐增强[14]。本研究中,发芽8 d的西兰花芽苗菜中黑芥子酶活力显著高于发芽5 d的。研究发现,单独的Mg2+存在时,黑芥子酶活力无显著变化,但当与抗坏血酸共存时,能显著提高黑芥子酶活力从而提高异硫氰酸酯的形成[11]。抗坏血酸可以使黑芥子酶的活性中心构象发生变化从而改变其活力,低浓度的抗坏血酸能够提高黑芥子酶活力,但是当浓度过高时会抑制酶活力使异硫氰酸酯含量降低[27-28]。本实验中,MgSO4显著提高了西兰花芽苗菜的黑芥子酶活力,可能是在抗坏血酸的存在下,Mg2+联合抗坏血酸使得黑芥子酶活力增加。萝卜硫素是西兰花芽苗菜中含量最高的异硫氰酸酯,占总量的67%左右[14]。本研究中,萝卜硫素的变化趋势与硫苷变化趋势基本一致,50 mmol/L MgSO4处理组西兰花芽苗菜中萝卜硫素含量最高;虽然发芽8 d的芽苗菜中黑芥子酶活力高于发芽5 d的,由于其底物总硫苷含量在发芽5 d的芽苗菜中较高,因此导致发芽5 d的芽苗菜总有较高的异硫氰酸酯含量。
本研究中,随着MgSO4浓度的增加,抗坏血酸的含量减低,这与Guo Liping等[21]用NaCl处理西兰花芽苗菜的结果相似,一种原因可能是一部分抗坏血酸作为抗氧化物质抵御MgSO4造成的胁迫效应,另一个原因可能是抗坏血酸合成过程中重要的酶——L-半乳糖酸-1,4-内酯脱氢酶活性降低所致。NaCl等胁迫可以提高植物中酚类物质等次生代谢产物的含量,而当胁迫达到一定程度后,次生代谢产物含量不会进一步增加[21]。本实验中MgSO4也对西兰花芽苗菜造成一定的胁迫效应,因此使酚类物质得到积累以抵御胁迫。总酚、抗坏血酸是西兰花芽苗菜中重要的抗氧化物质,硫苷和萝卜硫素也具有一定的抗氧化作用[7,29]。虽然抗坏血酸含量经MgSO4处理后显著下降,但硫苷、萝卜硫素和总酚的含量显著增加,因此西兰花芽苗菜经MgSO4处理后清除DPPH自由基和H2O2的能力均显著提高。
4 结 论
西兰花芽苗菜经MgSO4处理后,发芽8 d的芽苗菜生长受到抑制,芽长和鲜质量显著下降。叶绿素含量随MgSO4浓度的增大逐渐增加,但发芽5 d和8 d的芽苗菜之间无显著差异。发芽5 d的芽苗菜中总硫苷含量显著高于发芽8 d的,但发芽8 d芽苗菜的黑芥子酶活力高于发芽5 d的;MgSO4处理显著提高了芽苗菜中总硫苷含量、黑芥子酶活力,但是50 mmol/L和75 mmol/L MgSO4处理组之间差异不显著,萝卜硫素含量的变化趋势与总硫苷含量一致。总酚含量随MgSO4浓度的增大逐渐增加,而抗坏血酸含量却逐渐降低;MgSO4处理显著提高了西兰花芽苗菜清除DPPH自由基和H2O2的能力。这些结果为西兰花芽苗菜的开发和利用提高了科学的理论依据。
[1] HIGDON J, DELAGE B, WILLIAMS D, et al. Cruciferous vegetables and human cancer risk: epidemiologic evidence and mechanistic basis[J]. Pharmacological Research, 2007, 55(3): 224-236.DOI:10.1016/j.phrs.2007.01.009.
[2] TRAKA M, MITHEN R. Glucosinolates, isothiocyanates and human health[J]. Phytochemistry Reviews, 2009, 8(1): 269-282. DOI:10.1007/s11101-008-9103-7.
[3] AGERBIRK N, OLSEN C E. Glucosinolate structures in evolution[J]. Phytochemistry, 2012, 77: 16-45. DOI:10.1016/j.phytochem.2012.02.005.
[4] PÉREZ-BALIBREA S, MORENO D A, GARCÍA-VIGUERA C.Genotypic effects on the phytochemical quality of seeds and sprouts from commercial broccoli cultivars[J]. Food Chemistry, 2011, 125(2):348-354. DOI:10.1016/j.foodchem.2010.09.004.
[5] FAHEY J W, ZHANG Y, TALALAY P. Broccoli sprouts: an exceptionally rich source of inducers of enzymes that protect against chemical carcinogens[J]. Proceedings of the National Academy of Sciences, 1997, 94(19): 10367-10372. DOI:10.1073/pnas.94.19.10367.
[6] JUGE N, MITHEN R F, TRAKA M. Molecular basis for chemoprevention by sulforaphane: a comprehensive review[J]. Cellular and Molecular Life Sciences, 2007, 64(9): 1105-1127. DOI:10.1007/s00018-007-6484-5.
[7] GUO R F, YUAN G F, WANG Q M. Effect of sucrose and mannitol on the accumulation of health-promoting compounds and the activity of metabolic enzymes in broccoli sprouts[J]. Scientia Horticulturae,2011, 128(3): 159-165. DOI:10.1016/j.scienta.2011.01.014.
[8] AKHLAGHI M, BANDY B. Dietary broccoli sprouts protect against myocardial oxidative damage and cell death during ischemiareperfusion[J]. Plant Foods for Human Nutrition, 2010, 65(3): 193-199. DOI:10.1007/s11130-010-0182-4.
[9] YANG Runqiang, GUO Liping, JIN Xiaolin, et al. Enhancement of glucosinolate and sulforaphane formation of broccoli sprouts by zinc sulphate via its stress effect[J]. Journal of Functional Foods, 2015, 13:345-349. DOI:10.1016/j.jff.2015.01.007.
[10] AIRES A, ROSA E, CARVALHO R. Effect of nitrogen and sulfur fertilization on glucosinolates in the leaves and roots of broccoli sprouts (Brassica oleracea var. Italica)[J]. Journal of the Science of Food and Agriculture, 2006, 86(10): 1512-1516. DOI:10.1002/jsfa.2535.
[11] LUDIKHUYZE L, RODRIGO L, HENDRICKX M. The activity of myrosinase from broccoli (Brassica oleracea L. cv. Italica): influence of intrinsic and extrinsic factors[J]. Journal of Food Protection, 2000,63(3): 400-403. DOI:10.4315/0362-028X-63.3.400.
[12] 王学奎. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社,2006: 134-136.
[13] TIAN Ming, XU Xiaoyun, LIU Yanlong, et al. Eあect of Se treatment on glucosinolate metabolism and health-promoting compounds in the broccoli sprouts of three cultivars[J]. Food Chemistry, 2016, 190(1):374-380. DOI:10.1016/j.foodchem.2015.05.098.
[14] 郭丽萍, 王志英, 杨润强, 等. 西兰花种子发芽过程中生理活性物质含量的变化[J]. 中国食品学报, 2016, 16(3): 160-167. DOI:10.16429/j.1009-7848.2016.03.022.
[15] 王志英, 郭丽萍, 李倩倩, 等. 甘蓝苗生长过程中主要生理生化变化[J]. 食品科学, 2015, 36(3): 6-11. DOI:10.7506/spkx1002-6630-201503002.
[16] 郭丽萍, 王凤舞, 刘翠翠. 木糖与甘氨酸美拉德反应产物抗氧化性能的研究[J]. 食品工业科技, 2012, 33(7): 79-81.
[17] 王芳, 刘鹏, 朱靖文. 镁对大豆根系活力叶绿素含量和膜透性的影响[J]. 农业环境科学学报, 2004, 23(2): 235-239.
[18] FALK K L, TOKUHISA J G, GERSHENZON J. The effect of sulfur nutrition on plant glucosinolate content: physiology and molecular mechanisms[J]. Plant Biology, 2007, 9(5): 573-581. DOI:10.1055/s-2007-965431.
[19] GUO L P, YANG R Q, WANG Z Y, et al. Glucoraphanin,sulforaphane and myrosinase activity in germinating broccoli sprouts as affected by growth temperature and plant organs[J]. Journal of Functional Foods, 2014, 9: 70-77. DOI:10.1016/j.jff.2014.04.015.
[20] GUO L P, YANG R Q, ZHOU Y L, et al. Heat and hypoxia stresses enhance the accumulation of aliphatic glucosinolates and sulforaphane in broccoli sprouts[J]. European Food Research and Technology, 2016,242(1): 107-116. DOI:10.1007/s00217-015-2522-y.
[21] GUO Liping, YANG Runqiang, WANG Zhiying, et al. Effect of NaCl stress on health-promoting compounds and antioxidant activity in the sprouts of three broccoli cultivars[J]. International Journal of Food Sciences and Nutrition, 2014, 65(4): 476-481. DOI:10.3109/09637486.2013.860583.
[22] GUO L P, YANG R Q, GU Z X. Cloning of genes related to aliphatic glucosinolate metabolism and the mechanism of sulforaphane accumulation in broccoli sprouts under jasmonic acid treatment[J].Journal of the Science of Food and Agriculture, 2016, 96(13): 4329-4336. DOI:10.1002/jsfa.7629.
[23] BAENAS N, GARCÍA-VIGUERA C, MORENO D A. Biotic elicitors effectively increase the glucosinolates content in Brassicaceae sprouts[J]. Journal of Agricultural and Food Chemistry, 2014, 62(8):1881-1889. DOI:10.1021/jf404876z.
[24] GUO R F, HOU Q M, YUAN G F, et al. Effect of 2,4-epibrassinolide on main health-promoting compounds in broccoli sprouts[J]. LWTFood Science and Technology, 2014, 58(1): 287-292. DOI:10.1016/j.lwt.2014.02.047.
[25] ANGELINO D, JEFFERY E. Glucosinolate hydrolysis and bioavailability of resulting isothiocyanates: Focus on glucoraphanin[J].Journal of Functional Foods, 2014, 7: 67-76. DOI:10.1016/j.jff.2013.09.029.
[26] YUAN G, WANG X, GUO R, et al. Effect of salt stress on phenolic compounds, glucosinolates, myrosinase and antioxidant activity in radish sprouts[J]. Food Chemistry, 2010, 121(4): 1014-1019.DOI:10.1016/j.foodchem.2010.01.040.
[27] GUO Q, GUO L, WANG Z, et al. Response surface optimization and identification of isothiocyanates produced from broccoli sprouts[J]. Food Chemistry, 2013, 141(3): 1580-1586. DOI:10.1016/j.foodchem.2013.04.026.
[28] GU Z X, GUO Q H, GU Y J. Factors influencing glucoraphanin and sulforaphane formation in Brassica plants: a review[J]. Journal of Integrative Agriculture, 2012, 11(11): 1804-1816. DOI:10.1016/S2095-3119(12)60185-3.
[29] VALGIMIGLI L, IORI R. Antioxidant and pro-oxidant capacities of ITCs[J]. Environmental and Molecular Mutagenesis, 2009, 50(3): 222-237. DOI:10.1002/em.20468.

