饲养方式对宰后苏尼特羊肉一磷酸腺苷激活的蛋白激酶活力及糖酵解的影响
侯艳茹,马晓冰,苏 琳,赵雅娟,罗玉龙,赵丽华,靳 烨*
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
苏尼特羊是内蒙古地区优秀的肉羊种群,其肉质具有细嫩、味美多汁、易消化等特点,受到广大消费者的喜爱[1]。饲养方式是影响肉品品质的重要因素,Fluharty等[2]的研究表明,合理的舍饲育肥能够提高动物的生长育肥性能,还可以改善肉质。本团队研究发现,放牧条件下苏尼特羊肉的色泽和嫩度都优于圈养条件,且营养成分更丰富[3-4],这说明饲养方式对肉品品质有所影响。一磷酸腺苷激活的蛋白激酶(AMP-activated protein kinase,AMPK)是蛋白激酶级联的下游组件,属于代谢敏感的丝氨酸/苏氨酸蛋白激酶,其主要功能是根据机体的能量需求调节整个机体的能量平衡[5-6]。AMPK能够调节机体的糖代谢,糖酵解是引起动物宰后肌肉pH值下降的主要原因,而动物宰后的pH值变化速度与幅度可以影响肌肉的色泽、嫩度、系水力、蒸煮损失等品质指标[7-9],所以动物宰后糖酵解的程度直接影响肉质的好坏。饲养方式会对肉品品质产生影响,而AMPK能够通过调节动物宰后糖酵解的程度而影响肉质。所以,研究饲养方式对动物宰后AMPK活性以及糖酵解指标的影响,通过调控AMPK的活性来改变糖酵解的进程进而影响肉质,无疑是改善肉品品质的新思路。
本研究以不同饲养条件下(放牧和圈养)12 月龄苏尼特羊背最长肌为实验材料,对AMPK活力、AMPK基因mRNA相对表达量以及糖酵解指标进行测定,并分析了AMPK与糖酵解指标之间的相关性,旨在为通过调控AMPK活性改善宰后肉品品质提供依据。
1 材料与方法
1.1 材料与试剂
选取来自内蒙古巴彦淖尔市海流图镇12 月龄苏尼特羊放牧和圈养各10 只,其中每种饲养方式公母各半,体质量(43.56±6.24)kg,胴体质量(21.29±4.69)kg。宰后1 h内取背最长肌,切成100 mg小块,立即放入无酶无菌冻存管中,投入液氮中冷冻保存,然后置于-80 ℃冰箱中,作为实验用材料。
RNAiso Plus RNA提取裂解液、PrimeScriptTMRT reagent Kit反转录试剂盒、SYBR Premix Ex TaqTM实时荧光定量试剂盒 大连宝生物工程有限公司;DNase/RNase-free无菌水 北京天根生物技术有限责任公司;绵羊磷酸化腺苷酸活化蛋白激酶(p-AMPK)酶联免疫吸附检测试剂盒、己糖激酶测定试剂盒、乳酸测定试剂盒、肌/肝糖原测定试剂盒、总蛋白定量测定试剂盒(二喹啉甲酸比色法) 南京建成生物工程研究所;Tris-HCl缓冲液、D-甘露醇 美国Amresco公司;乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、乙二醇双(2-氨基乙基醚)四乙酸(ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA) 美国Sigma公司;二硫苏糖醇(DL-dithiothreitol,DTT) 德国Merck公司;氟化钠、焦磷酸钠 天津永大化学试剂厂;浓硫酸、氯化钠国药集团化学试剂有限公司;以上试剂均为分析纯。
1.2 仪器与设备
pH-STAR型胴体pH值直测仪 德国Matthaus公司;TC-P2A全自动测色色差计 上海生物生化实验仪器公司;CL-M嫩度仪 上海精密科学仪器有限公司;5417R低温台式冷冻离心机 德国Eppendorf生物公司;CFX96TM实时定量聚合酶链式反应(polymerase chain reaction,PCR)仪、凝胶成像分析系统 美国Bio-Rad公司;BG-power 3500型稳压稳流电泳仪、水平电泳槽北京百晶生物技术有限公司;PCR扩增仪 北京北方华奥贸易有限责任公司;TU-1810紫外-可见分光光度计北京普析通用仪器有限责任公司;LRH-250生化培养箱上海一恒科学仪器有限公司;XHF-DY高速分散器宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 AMPK的活力测定
取保存于-80 ℃冰箱的样品约0.3 g,按照1∶5(m/V)的比例加入保存于4 ℃冰箱的冷冻匀浆液(0.25 mol/L的D-甘露糖、5 mmol/L的焦磷酸钠、0.05 mol/L的Tris-HCl缓冲液(pH 7.4)、1 mmol/L的DTT、1 mmol/L的EGTA、1 mmol/L的EDTA、50 mmol/L的氟化钠),在3 000 r/min的条件下冰浴匀浆。4 ℃、10 000 r/min冷冻离心5 min,取上清液用于AMPK活力的测定。AMPK活力的测定步骤以及计算参照绵羊p-AMPK酶联免疫检测试剂盒说明书进行。
1.3.2 AMPK基因相对表达量的测定
1.3.2.1 总RNA的提取及检测
依据RNAiso Plus试剂盒的说明书对肌肉中总RNA进行提取[10]。将提取的总RNA置于核酸蛋白分析仪上检测其质量浓度和纯度(A260nm/A280nm)。并用1%(质量分数,下同)的琼脂糖凝胶电泳检测所提取的总RNA的完整性。
1.3.2.2 反转录
按照反转录试剂盒说明书进行反转录操作,将合成的cDNA质量浓度稀释至50 ng/μL。将反转录得到的产物置于-20 ℃冰箱中保存备用[11]。
1.3.2.3 引物序列来源及合成
PRKAA1、PRKAA2、PRKAG3以及GAPDH(内参基因)基因引物序列参照马晓冰的设计[12],由华大科技基因有限公司合成(表1)。

表1 实时荧光PCR引物序列Table 1 Primers used for real-time PCR
1.3.2.4 实时荧光PCR扩增
本实验按照CFX96TM实时荧光PCR检测系统的二步法进行操作。以1.3.2.2节所合成的cDNA为模板,使用实时荧光定量试剂盒进行实时荧光PCR扩增[11]。反应体系为:SYBR Premix Ex Taq II(2×)12.5 µL;上、下游引物(10 µmol/L)各1.0 µL;DNA模板(50 ng/μL)2.0 µL;dH2O 8.5 µL;共25.0 µL。实时荧光PCR条件为:95 ℃预变性30 s;95 ℃变性5 s,58 ℃退火30 s,72 ℃延伸30 s,共35 个循环;72 ℃延伸10min。产物保存于4 ℃冰箱。
1.3.2.5 实时荧光PCR产物检测
使用1%的琼脂糖凝胶电泳,在120 V的电压下进行电泳检测,使用凝胶成像仪拍照分析。
1.3.2.6 基因相对表达量的计算
本实验采用2−ΔΔCt计算法对实时荧光定量PCR数据进行处理和分析,2−ΔΔCt为相对表达量,ΔΔCt=(处理组目的基因Ct值-处理组内参基因Ct值)-(未处理组目的基因Ct值-未处理组内参基因Ct值)[13]。
1.3.3 糖酵解指标的测定
己糖激酶活力的测定按照己糖激酶测定试剂盒的说明书进行操作;乳酸含量的测定按照乳酸测定试剂盒的说明书进行操作;肌糖原含量测定按照肝/肌糖原测定试剂盒的说明书进行操作。
1.3.4 肉品品质相关指标的测定
1.3.4.1 pH值的测定
在屠宰后45 min时,使用胴体直测式pH计测胴体初pH值,记为pH1;静置排酸24 h后测胴体最终pH值,记为pH24。
1.3.4.2 色泽的测定
使用TC-P2A全自动色差仪对肉色进行测定,L*值表示亮度,b*值为黄度,a*值表示红度。每个样品选取3 个位置,重复测定后取平均值。
1.3.4.3 嫩度的测定
沿肌肉方向取2.5 cm×3.0 cm×5.0 cm的肌肉块,用自封袋密封后水浴加热(75 ℃、45 min),冷却至室温后沿着肌纤维的方向将肉块切成3 cm×1 cm×1 cm的条状,使用CLM-3型嫩度仪对剪切力值进行测定。
1.4 数据统计分析
利用SPSS 19.0数据分析软件进行统计分析,所有数值以表示。以P<0.05表示差异显著。
2 结果与分析
2.1 饲养方式对肉质指标的影响
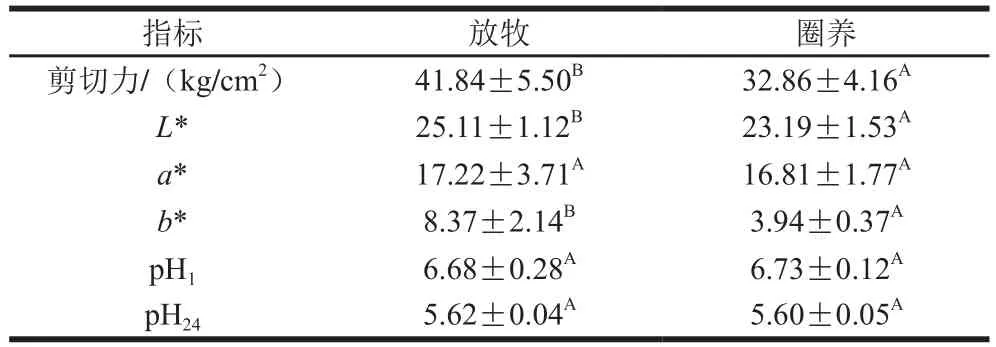
表2 不同饲养方式下的肉质指标(n=10)Table 2 Meat traits under different feeding conditions (n= 10)
由表2可知,放牧条件下苏尼特羊背最长肌的剪切力值显著大于圈养条件(P<0.05),这可能与不同饲养方式下骨骼肌肌纤维的发育、肌肉脂肪的含量以及水分含量有关[3,14]。放牧条件下苏尼特羊背最长肌的L*值、a*值以及b*值均大于圈养条件,其中L*值和b*值差异显著(P<0.05)。两种饲养方式的pH1值和pH24值差异不显著(P>0.05),研究表明不同饲养方式下18 月龄卫山羊羯羊的pH24值差异不显著[15],与本实验结果一致,这可能是因为pH值还受到其他因素的共同影响。
2.2 饲养方式对苏尼特羊AMPK活力和基因相对表达量的影响
2.2.1 饲养方式对AMPK活力的影响
本实验用AMPK磷酸化水平代表AMPK活力,不同饲养方式12 月龄苏尼特羊背最长肌的AMPK活力分别为:放牧条件(8.83±1.07)ng/mL、圈养条件(9.51±1.30)ng/mL。结果表明,放牧条件下苏尼特羊AMPK活力低于圈养条件下,但两种饲养方式差异不显著。AMPK活力会受到运动、缺氧、缺血、应激等多种因素的影响[16-18],圈养条件下,苏尼特羊背最长肌AMPK活力高于放牧条件,推测原因可能是由于圈养的羊和放牧的羊相比,宰前应激反应比较大,导致AMPK的活力升高。但两种饲养方式AMPK活力差异不显著(P>0.05),说明饲养方式对AMPK活力影响较小。
2.2.2 AMPK基因相对表达量测定结果
2.2.2.1 总RNA提取结果
背最长肌肌肉组织中提取的总RNA经1%琼脂糖凝胶电泳检测,凝胶成像结果如图1所示(以其中3 个样品为例)。
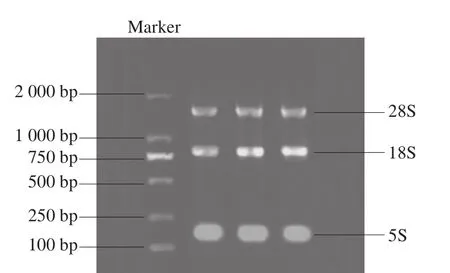
图1 总RNA电泳图Fig. 1 Agarose gel electrophoresis of total RNA
如图1所示,提取的总RNA 3 条条带(28S、18S、5S)完整且清晰明亮,说明所提取的总RNA并无降解。经核酸蛋白分析仪检测,A260nm/A280nm均在1.8~2.1之间,说明提取的总RNA的纯度高,并未被污染,可用于后续的反转录实验。
2.2.2.2 实时荧光PCR产物结果
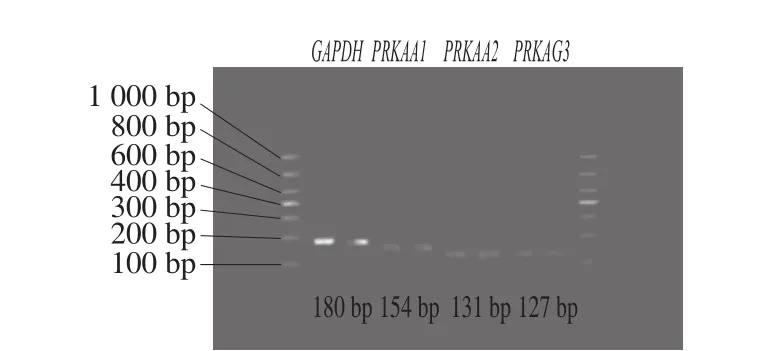
图2 各基因PCR产物电泳图Fig. 2 Agarose gel electrophoresis of the genes
内参基因和各目的基因经实时荧光PCR反应后,得到大量扩增产物,经1%琼脂糖凝胶电泳检测后,凝胶成像结果如图2所示。图中4 个基因的条带单一且清晰明亮,说明经PCR反应后得到的扩增产物单一,没有引物二聚体和非特异性产物,将目的基因的片段与DL1000 DNA Marker比较,其条带大小与所设计的引物目的产物片段大小相一致,说明所设计的引物反应性能良好,符合实时荧光PCR实验要求,经实时荧光PCR后的产物为本实验所需产物。
2.2.2.3 AMPK基因表达规律
AMPK以异源三聚体的形式存在于生物体中,由α、β、γ3 种亚基构成,其中α是催化亚基,β和γ是调节亚基[19]。每个亚基又存在不同的亚型,如α1和α2,β1和β2,γ1、γ2和γ3[20]。由于α是催化亚基,所以目前对AMPK α1和α2这两个亚基的功能等方面的相关研究比较多,因为γ3亚基在骨骼肌中具有高表达[21],且有研究表明PRKAG3基因与糖代谢有关[22-23],所以本实验选择分别编码α1、α2和γ3亚基的PRKAA1、PRKAA2和PRKAG3基因来分析AMPK的mRNA相对表达量。不同饲养方式下苏尼特羊的PRKAA1、PRKAA2以及PRKAG3基因相对表达量如图3所示。
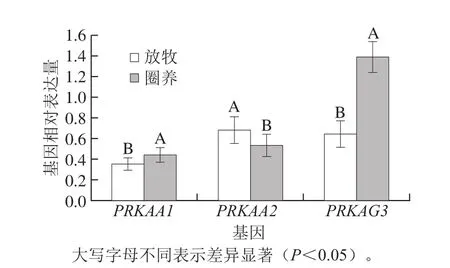
图3 AMPK部分亚基基因表达水平Fig. 3 Gene expression of some subunits of AMPK
如图3所示,不同饲养条件下,苏尼特羊PRKAA1和PRKAG3基因的相对表达量均为圈养条件高于放牧条件,且差异显著(P<0.05),而PRKAA2基因相对表达量为放牧条件显著大于圈养条件(P<0.05)。AMPK α1亚基主要在脂肪细胞中表达[24],由于圈养苏尼特羊比放牧苏尼特羊含有更多的脂肪组织,这可能导致编码AMPK α1亚基的PRKAA1的相对表达量增高。研究表明耐力训练会导致AMPK α2亚基蛋白和基因相对表达量显著增加[25]。较圈养羊而言,放牧的苏尼特羊处于长期运动的生长状况下,可能会导致编码AMPK α2亚基的PRKAA2基因相对表达量显著增加。放牧条件PRKAG3基因相对表达量显著小于圈养条件,可能是由于PRKAG3基因在ⅡB型肌纤维中表达量较高[26],而圈养条件下苏尼特羊背最长肌的ⅡB型肌纤维数量要高于放牧条件[3]。以上结果表明,饲养方式对AMPK的基因相对表达量有显著影响。
2.3 饲养方式对苏尼特羊宰后糖酵解指标的影响

表3 不同饲养方式糖酵解指标(n=10)Table 3 Glycolysis indicators under different feeding conditions (n= 10)
不同饲养条件下苏尼特羊背最长肌宰后糖酵解指标测定结果如表3所示,苏尼特羊背最长肌己糖激酶的活力为圈养条件高于放牧条件,但两种饲养方式差异不显著(P>0.05);乳酸含量也为圈养条件大于放牧条件,且差异显著(P<0.05);放牧条件下肌糖原含量高于圈养条件,但差异不显著(P>0.05)。不同饲养方式会对AMPK的活力以及基因相对表达量有所影响,研究表明AMPK活力会进一步影响糖酵解指标[27],这就造成了糖酵解指标在不同饲养方式下的差异。
2.4 AMPK与糖酵解指标及肉品品质的相关性
2.4.1 AMPK活力与糖酵解指标及肉品品质的相关性
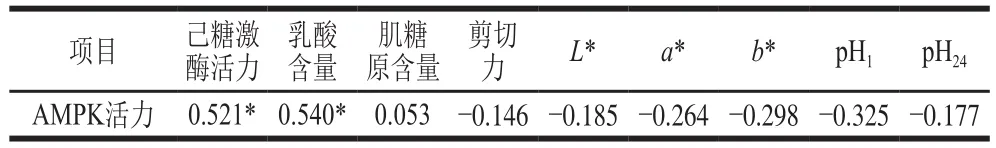
表4 AMPK活力与糖酵解指标及肉品质的相关性Table 4 Correlation coefficients between relative AMPK activity and glycolysis indices and meat quality
由表4可知,AMPK活力与己糖激酶活力以及乳酸含量均呈显著正相关(P<0.05),与肌糖原含量相关程度很低(P>0.05),与剪切力、色泽以及pH值均呈负相关(P<0.05)。Shen Qingwu W.等[28]向小鼠体内腹腔注射AMPK的抑制剂——复合物C,研究显示复合物C抑制了宰后小鼠背最长肌中AMPK的活力以及糖酵解进程。这说明AMPK可以调控宰后动物肌肉的糖酵解。
2.4.2 AMPK基因相对表达量与AMPK活力、糖酵解指标以及肉品品质的相关性
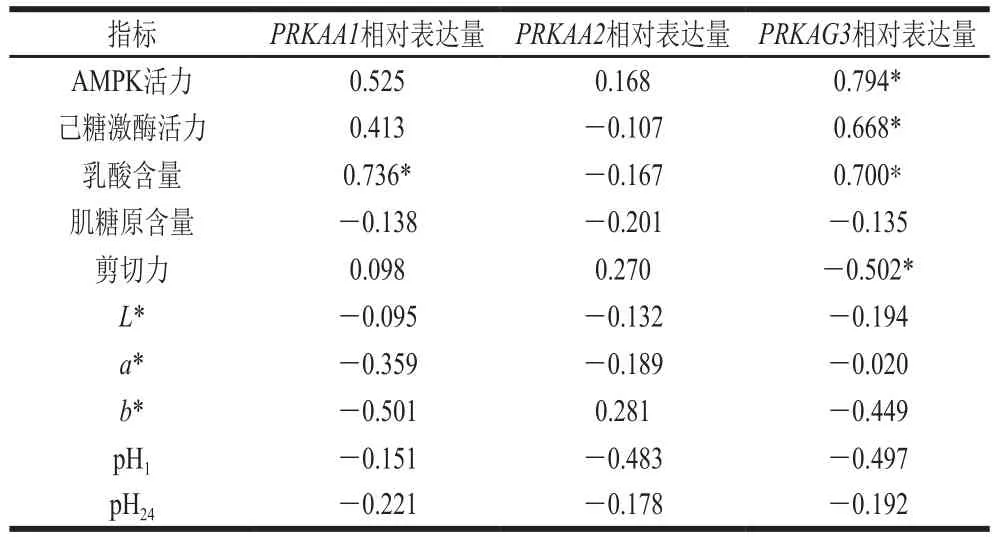
表5 AMPK基因相对表达量与AMPK活力、糖酵解指标及肉品质的相关性Table 5 Correlation coefficients between relative expression of AMPK gene and AMPK activity, glycolysis and meat quality
由表5可知,PRKAA1、PRKAA2和PRKAG3基因相对表达量均与AMPK活力呈正相关,其中PRKAG3基因相对表达量均与AMPK活力呈显著正相关(P<0.05),说明这3 个基因的相对表达量与AMPK活力变化趋势相一致。PRKAA1和PRKAG3基因相对表达量与己糖激酶活力呈正相关,其中PRKAG3基因相对表达量与己糖激酶活力呈显著正相关(P<0.05),而PRKAA2基因相对表达量与己糖激酶活力呈负相关,但相关程度较低。PRKAA1和PRKAG3基因相对表达量均与乳酸含量呈显著正相关(P<0.05)。3 个基因的相对表达量与肌糖原含量均呈负相关,但相关程度较低。PRKAG3基因相对表达量与剪切力呈显著负相关(P<0.05),有研究对PRKAG3基因的单核苷酸多态性(single nucleotide polymorphism,SNP)关联性进行分析,表明T2885C这个SNP与剪切力有密切的联系,可以作为未来肉牛选育的辅助标记[29],这说明PRKAG3基因的相对表达量对肌肉的嫩度有所影响。
以上结果表明,PRKAA1和PRKAG3基因的相对表达量对糖酵解指标有一定的影响,而PRKAA2基因的相对表达量对糖酵解指标影响较小,即AMPK α1亚基和AMPK γ3亚基在机体内相对表达量高时,AMPK活力增加,AMPK活化后促使糖酵解的关键酶己糖激酶的活力增加,从而加速动物宰后糖酵解的进程,使得乳酸大量堆积。乳酸是影响动物宰后pH值的重要因素,pH值又是影响肉品品质的关键指标,这说明AMPK可以通过调控动物宰后糖酵解的进程从而对肉品品质产生影响。也有相关研究表明不同条件下肉质会发生改变,可能是由于AMPK对糖酵解的关键酶己糖激酶、果胶酯酶和乳酸脱氢酶活力的调节,进而改变了糖酵解的速率和程度,最终对肉品品质产生影响[30-31]。
3 结 论
通过对苏尼特羊放牧和圈养两种方式下AMPK活力、AMPK mRNA相对表达量以及糖酵解指标进行测定,发现圈养条件下PRKAA1以及PRKAG3基因表达均显著高于放牧条件,并且AMPK的活力、己糖激酶活力和乳酸含量也高于放牧条件。说明PRKAA1以及PRKAG3基因相对表达量升高会使AMPK的活力增加,AMPK被激活后直接磷酸化糖酵解通路中的关键酶己糖激酶,使己糖激酶活力增加,从而促进糖酵解进程,产生大量乳酸,导致宰后动物肌肉的pH值下降,对肉品品质产生一定影响。因此,未来可通过调控AMPK的活力以改善不同饲养方式下的肉质。
[1] 郭月英, 程海星, 王乐, 等. 苏尼特羊钙蛋白酶抑制蛋白基因表达规律及其与肉质的相关性研究[J]. 食品工业科技, 2015, 36(7): 122-126. DOI:10.13386/j.issn1002-0306.2015.07.017.
[2] FLUHARTY F L, MCCLURE K E, SOLOMON M B, et al. Energy source and ionophore supplementation eあects on lamb growth, carcass characteristics, visceral organ mass, diet digestibility, and nitrogen metabolism[J]. Journal of Animal Science, 1999, 77(4): 816-823.DOI:10.2527/1999.774816x.
[3] 尹丽卿. 不同饲养方式下苏尼特羊肌纤维特性和MyHC基因对肉质的影响[D]. 呼和浩特: 内蒙古农业大学, 2016: 46-47.
[4] 罗玉龙, 王柏辉, 靳志敏, 等. 两种饲养条件对苏尼特羊肉营养品质的影响[J]. 食品科学, 2016, 37(19): 227-231. DOI:10.7506/spkx1002-6630-201619038.
[5] HARDIE D G, HAWLEY S A, SCOTT J W. AMP-activated protein kinase-development of the energy sensor concept[J]. Journal of Physiology, 2006, 574(1): 7-15. DOI:10.1113/jphysiol.2006.108944.
[6] HARDIE D G, CARLING D. The AMP-activated protein kinase-fuel gauge of the mammalian cell[J]. European Journal of Biochemistry,1997, 246(2): 259-273. DOI:10.1111/j.1432-1033.1997.00259.x.
[7] SCHEFFLER T L, SCHEFFLER J M, KASTEN S C, et al. High glycolytic potential does not predict low ultimate pH in pork[J]. Meat Science, 2013, 95(1): 85-91. DOI:10.1016/j.meatsci.2013.04.013.
[8] 马晓冰, 苏琳, 林在琼, 等. 不同品种肉羊肌肉的糖酵解潜力及其与肉品质之间的相关性[J]. 食品科学, 2015, 36(15): 1-4. DOI:10.7506/spkx1002-6630-201515001.
[9] LIANG J, YANG Q, ZHU M J, et al. AMP-activated protein kinase(AMPK)α2 subunit mediates glycolysis in postmortem skeletal muscle[J].Meat Science, 2013, 95(3): 536-541. DOI:10.1016/j.meatsci.2013.05.025.
[10] 苏琳. 巴美肉羊肌纤维特性、糖酵解潜力对羊肉品质的影响和MyHC表达量分析[D]. 呼和浩特: 内蒙古农业大学, 2015: 26-27.
[11] BROCKS L, KLONT R E, BUIST W, et al. The eあects of selection of pigs on growth rate vs. leanness on histochemical characteristics of different muscles[J]. Journal of Animal Science, 2000, 78(5): 1247-1254. DOI:10.2527/2000.7851247x.
[12] 马晓冰. 饲养方式对宰后苏尼特羊肉AMPK、糖酵解及肉品质的影响[D]. 呼和浩特: 内蒙古农业大学, 2016: 14-15.
[13] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod[J].Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262.
[14] 杨烨, 文杰, 陈继兰, 等. 饲养方式对河田鸡脂肪代谢的影响[J]. 畜牧兽医学报, 2008, 39(8): 1050-1055.
[15] 徐小春, 闫宏, 石绘陆, 等. 饲养方式对中卫山羊羯羊产肉性能与肌肉理化特性的影响[J]. 畜牧与兽医, 2011, 43(10): 47-49.
[16] 王兵. 力竭运动对大鼠心肌AMPK活性的影响[J]. 西安工业大学学报, 2013, 33(1): 68-71. DOI:10.16185/j.jxatu.edu.cn.2013.01.010.
[17] 李爽, 李燕舞, 王蕾, 等. 长期运动训练对机体血清中AMPK水平的影响[J]. 现代生物医学进展, 2012, 12(24): 4698-4700.DOI:10.13241/j.cnki.pmb.2012.24.055.
[18] CORTON J M, GILLESPIE J G, HARDIE D G. Role of the AMP-activated protein kinase in the cellular stress response[J]. Current Biology, 1994, 4(4): 315-324. DOI:10.1016/S0960-9822(00)00070-1.
[19] SHEN Q W, MEANS W J, THOMPSON S A, et al. Pre-slaughter transport, AMP-activated protein kinase, glycolysis, and quality of pork loin[J]. Meat Science, 2006, 74(2): 388-395. DOI:10.1016/j.meatsci.2006.04.007.
[20] LONG Y C, ZIERATH J R. AMP-activated protein kinase signaling in metabolic regulation[J]. Journal of Clinical Investigation, 2006,116(7): 1776-1783. DOI:10.1172/JCI29044.1776.
[21] 卢亚洲, 马月辉, 赵倩君, 等. PRKAG3基因在绵羊中的单核苷酸多态性研究[C]//第十一次全国畜禽遗传标记研讨会, 青岛: 全国畜禽遗传标记研讨会, 2008: 879-883.
[22] BARNES B R, MARKLUND S, STEILER T L, et al. The 5’-AMP-activated protein kinase gamma3 isoform has a key role in carbohydrate and lipid metabolism in glycolytic skeletal muscle[J].Journal of Biological Chemistry, 2004, 279(37): 38441-38447.DOI:10.1074/jbc.M405533200.
[23] GRANLUND A, JENSENWAERN M, ESSÉNGUSTAVSSON B. The influence of the PRKAG3 mutation on glycogen, enzyme activities and fibre types in diあerent skeletal muscles of exercise trained pigs[J].Acta Veterinaria Scandinavica, 2011, 53(1): 20. DOI:10.1186/1751-0147-53-20.
[24] DAVAL M, FERRÉ P, FOUFELLE F. AMPK, an active player in the control of metabolism[J]. Journal de la Société de Biologie, 2006,200(1): 99-105.
[25] 陈大鹏. 耐力训练对AMPKα2基因敲除小鼠骨骼肌GLUT4表达的影响[D]. 北京: 北京体育大学, 2010: 25-26.
[26] MAHLAPUU M, JOHANSSON C, LINDGREN K, et al. Expression profiling of the gamma-subunit isoforms of AMP-activated protein kinase suggests a major role for gamma3 in white skeletal muscle[J].American Journal of Physiology Endocrinology & Metabolism, 2004,286(2): 194-200. DOI:10.1152/ajpendo.00147.2003.
[27] 宋晓彬. 活性对宰后羊肉糖酵解和肉品质的影响[D]. 呼和浩特: 内蒙古农业大学, 2014: 30-34.
[28] SHEN Qingwu W., GERRARD D E, DU Min. Compound C, an inhibitor of AMP-activated protein kinase, inhibits glycolysis in mouse longissimus dorsi postmortem[J]. Meat Science, 2008, 78(3): 323-330.DOI:10.1016/j.meatsci.2007.06.023.
[29] LI WF, LI JY, GAO X, et al. Association analysis of PRKAG3 gene variants with carcass and meat quality traits in beef cattle[J]. African Journal of Biotechnology, 2012, 11(8): 1855-1861. DOI:10.5897/AJB11.2454.
[30] 李泽, 马霞, 靳烨. 不同年龄和部位羊肉中AMPK活性与糖酵解的差异[J]. 食品与发酵工业, 2010, 36(1): 184-186. DOI:10.13995/j.cnki.11-1802/ts.2010.01.044.
[31] LI X, YANG X, SHAN B, et al. Meat quality is associated with muscle metabolic status but not contractile myofiber type composition in premature pigs[J]. Meat Science, 2009, 81(1): 218-223. DOI:10.1016/j.meatsci.2008.07.022.

