灵芝孢子细胞壁降解菌的筛选及鉴定
杨杭,卓虹伊,练心洁,刘凤,邹亮,郭晓恒,雨田,*
(1.大理大学药学与化学学院,云南大理671000;2.成都中医药大学药学院,四川成都611137;3.成都大学药学与生物工程学院,四川成都610106;4.成都大学医学院(护理学院),四川成都610106)
灵芝(Ganoderma lucidum)又称灵芝草、仙草、瑞草,是担子菌纲多孔菌科灵芝属真菌[1]。在2015年版《中国药典》第一部中收入作为灵芝药材来源的是赤芝(Ganoderma lucidum)或紫芝(Ganoderma sinense)的干燥子实体[2]。灵芝孢子为大型真菌植物灵芝在成熟时从菌盖中弹射出来的极其微小的孢子[3],其具有灵芝的全部遗传活性物质,其药用价值与药理活性日益受到重视。灵芝多糖和三萜为其主要成分[4-5],具有抗糖尿病的潜力[6]。其他药理作用主要为抗癌[7]、免疫调节[8]、抗氧化[9]、神经保护[10]、保肝[11]等作用。
灵芝孢子具有双层细胞壁,细胞壁主要为纤维素、几丁质、木质素等,导致其细胞壁坚韧,不易破坏,有效成分溶出困难。因此,灵芝孢子破壁对于提高灵芝有效成分提取率和生物利用度具有重要意义[12-14]。近年来,破除灵芝孢子细胞壁的方法有5种,分别为生物法、化学法、物理法、机械法和综合法[15]。其中生物法具有使用设备简单、破碎效果较好、易于操作等优点[15]。生物法中的溶菌破壁法是利用生物自身的微生物或通过接种酵母、霉菌、乳酸菌等发酵,利用发酵过程产生的酶系水解细胞壁,使营养物质能释放出来[16]。
产生纤维素酶、几丁质酶的微生物分布广,海洋、河流、土壤均为其理想分布场所。本研究从四川各地土壤中筛选微生物,对其进行鉴定,并以溶菌法作为破壁方法,同时测定灵芝孢子在发酵过程中多糖和三萜的含量变化,以期能较好的控制其发酵时间,提高灵芝多糖和三萜的提取率。
1 材料与方法
1.1 材料与仪器
几丁质(批号:2014051001)、刚果红(批号:2015060601)、羧甲基纤维素钠(CMC-Na,批号:20110219):成都市科龙化工试剂厂;3.5-二硝基水杨酸(3,5-Dinitrosalicylic acid,简称 DNS试剂,批号:SDKJ20170401):北京生东科技有限公司;细菌学蛋白胨(批号:3205082)、技术琼脂粉(批号:3205079)、溶菌肉汤(Luria-Bertani,LB)培养基(批号:3105220)、马铃薯葡萄糖琼脂培养基(potato dextrose agar,简称PDA培养基,批号:3105510):广州环凯微生物科技有限公司;磷酸二氢钾、磷酸氢二钾、硫酸镁、氯化钠、氯化钾、氯化钙:成都市科龙化工试剂厂;D(+)-无水葡萄糖(含量≥98% 批号:S08J6G1)、齐墩果酸(含量≥98% 批号:HA0820KA14)、N-乙酰氨基葡萄糖(含量≥98%批号:A07J7X17432):上海源叶生物科技有限公司。
UV-7504单光束紫外-可见分光光度计:上海欣茂仪器有限公司;CPA225D电子天平:北京赛多利斯仪器系统有限公司;DHG-9050B智能型电热恒温鼓风干燥箱:上海琅玕实验设备有限公司;HH-4数显恒温水浴锅:常州澳华仪器有限公司;KH5200DE数控超声波清洗器:昆山禾创超声仪器有限公司;HC-3081R高速冷冻离心机:安徽中科中佳科学仪器有限公司;DHP-500型电热恒温培养箱:北京市永光明医疗仪器厂;ZHWY-100H恒温培养振荡器:上海智诚分析仪器制造有限公司;JJ-CJ-2FD洁净工作台:苏州市金净净化设备科技有限公司;YM-50B立式压力蒸汽灭菌锅:上海三申医疗器械有限公司。
1.2 胶态几丁质制备[17]
将5 g的粉末状几丁质溶解在88 mL浓盐酸中,使溶液混合均匀后,在4℃下放24 h左右,一般边搅拌边过滤到200 mL蒸馏水中,用去离子水离心,反复多次洗至中性(pH=7.0)最后用蒸馏水定容至100 mL,将配置好的胶体几丁质高压灭菌后保存到4℃冰箱备用。
1.3 培养基
1.3.1 筛选培养基
真菌筛选培养基:KH2PO40.1%、MgSO4·7H2O 0.05%、蛋白胨0.5%、胶态几丁质1%~2%、琼脂粉1.5%~2%、pH 7.0左右,121℃灭菌20 min。
细菌筛选培养基:K2HPO4·3H2O 0.4%、KH2PO40.2%、MgSO4·7H2O 0.14%、NaCl 0.1%、KCl 0.1%、CaCl20.02%、酵母粉 0.1%、胶态几丁质1%~2%、琼脂粉1.5%~2%、pH 7.0左右,121℃灭菌20 min。
1.3.2 发酵培养基
真菌发酵培养基:KH2PO40.1%、Na2HPO40.2%、MgSO4·7H2O 0.05%、KCl 0.05%、胶态几丁质(或CMC-Na)1%~2%、琼脂粉1.5%~2%、pH 7.0左右,121℃灭菌20 min。
细菌发酵培养基:K2HPO4·3H2O 0.4%、KH2PO40.1%、MgSO4·7H2O 0.07%、NaCl 0.05%、KCl 0.05%、胶态几丁质(或CMC-Na)1%~2%、pH 7.0左右,121℃灭菌20 min。
1.3.3 种子培养基
PDA培养基:马铃薯 20%、蔗糖 2%、琼脂粉1.5%~2%,蒸馏水1 000 mL,121℃条件下灭菌20 min。
LB培养基:蛋白胨1%、酵母膏0.5%、NaCl 1%、琼脂2%,蒸馏水1 000 mL,pH 7.0,121℃灭菌20 min。
1.4 标准品的配置
葡萄糖标准品的配置:精密称取24.33 mg的D(+)-无水葡萄糖标准品,用蒸馏水定容至10 mL,摇匀,得储备液,4℃保存,备用;另精密吸取储备液2.5 mL,用蒸馏水定容至50 mL,摇匀,得标准品,4℃保存,备用。
齐墩果酸标准品的配置:精密称取9.84 mg的齐墩果酸标准品,用95%乙醇定容至5 mL,摇匀,得储备液,4℃保存,备用;另精密吸取储备液2.5 mL,用95%乙醇定容至25 mL,摇匀,得标准品,4℃保存,备用。
N-乙酰氨基葡萄糖标准品的配置:精密称取49.87 mg的N-乙酰氨基葡萄糖标准品,用蒸馏水定容至50 mL,摇匀,得标准品,4℃保存,备用。
1.5 样品采集
前往四川各地不同地区采集微生物土壤样品,并记录采样时间,地点和土壤状态等,见表1、图1。
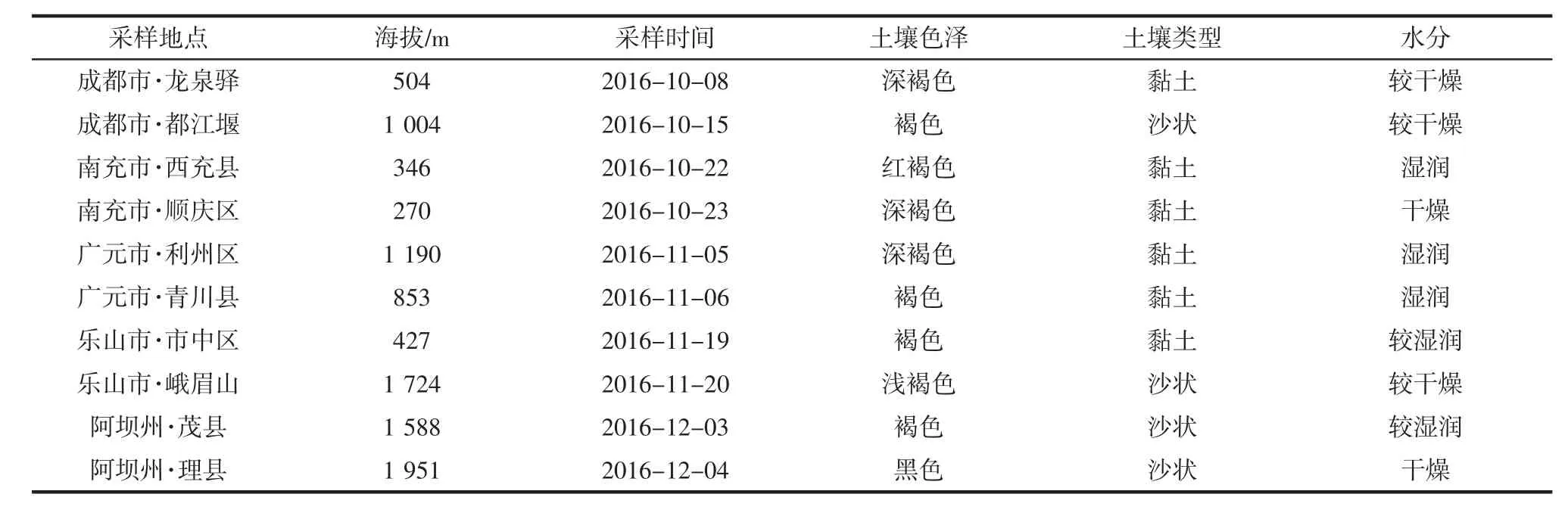
表1 采样记录表Table 1 Sampling record table

图1 采样地及样品(部分)Fig.1 Sampling sites and sample(part)
1.6 微生物的分离与筛选
取10 g1.5中采集的土壤加入90 mL带有小玻璃珠的无菌水中,充分振荡后,用无菌水进行梯度稀释。用移液枪分别吸取合适稀释梯度的稀释液0.5 mL,涂布于筛选培养基,真菌、细菌分别放置于28、37℃培养7 d,以能在胶态几丁质平板上生长良好的菌株为筛选标准,挑取单菌落进行平板划线分离纯化,用种子培养基保存。
1.7 几丁质降解率测定
将1.6中筛选得到的单菌落接种到富含胶态几丁质的筛选培养基上,真菌、细菌分别放置于28、37℃恒温培养箱中培养3 d,测量记录菌落直径H;然后用0.1%刚果红溶液浸泡30 min,小心倾倒刚果红溶液;再用1 mol/L的NaCl溶液浸泡30 min,小心倾倒NaCl溶液,可观察到透明圈大小,测量记录透明圈直径C,计算C/H(透明圈直径/菌落直径)。C/H的比值越大,表明菌株对几丁质的降解率越高;反之,越低。
1.8 纤维素酶和几丁质酶活性的测定
1.8.1 葡萄糖标准曲线的绘制
取20 mL具塞刻度试管8支,分别加入D(+)-无水葡萄糖标准品溶液 0、0.1、0.2、0.3、0.4、0.5、0.6 mL,各以蒸馏水补至2 mL,充分摇匀后,向各试管中加入1.5 mL DNS溶液,摇匀后沸水浴5 min,取出冷却后用蒸馏水定容至20 mL,充分混匀。以蒸馏水作为空白对照,在540 nm波长下测定吸光度。以葡萄糖浓度(C)为横坐标,以吸光度值(A)为纵坐标,绘制葡萄糖标准曲线。
1.8.2 N-乙酰氨基葡萄糖标准曲线的绘制
分别吸取 0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mL的N-乙酰氨基葡萄糖标准品溶液于9支比色管中,均用蒸馏水稀释至1 mL,加DNS显色剂1.5mL,在沸水浴中煮沸显色10 min,冷却,加蒸馏水补至10 mL,摇匀。以1 mL蒸馏水代替糖作空白管,在540 nm处测定吸光度。以N-乙酰氨基葡萄糖浓度(C)为横坐标,以吸光度值(A)为纵坐标,绘制N-乙酰氨基葡萄糖标准曲线。
1.8.3 酶活性的测定
用接种环从细菌斜面取菌体半环,用无菌水制成菌悬液,调节浓度为1×109CFU/mL;用接种环从真菌斜面取孢子半环,用无菌水制成抱子悬浮液,调节浓度为1×108个孢子/mL。吸取各菌悬液或孢子悬浮液1 mL接种于25 mL富含CMC-Na或胶态几丁质的发酵培养基中,以接入1 mL无菌水作为空白对照。各重复3次,细菌和真菌分别置于37、28℃振荡培养箱中培养,转速为200 r/min培养,分别于48 h取出发酵液,9 000 r/min离心10 min取上清液定容至25 mL,待测。
纤维素酶活性的测定:取4支20 mL比色管,分别加入1 mL上清液,其中1支作为对照直接放入100℃水浴灭活10 min,取出后加入3 mL的0.5%CMC-Na,在放入50℃水浴30 min;另外3支加入3 mL的0.5%CMC-Na,放入50℃水浴30 min,然后4支一起放入100℃水浴灭活10 min,冷却后12 000 r/min离心10 min,取上清液补至4 mL,加入3 mL DNS试剂,再沸水浴10 min,冷却后加蒸馏水定容至20 mL,混匀,于550 nm处测定吸光度值(OD550)。
每一个成长阶段的学生都会出现问题,需要教师的正确引导。每一个学生都是独一无二的个体,教育没有对错,但是教育有成败。适合学生的教育方式就是成功的教育方式。在日常班级管理中,就问题性质来分类教育学生。一方面,对于违反了原则性问题的学生,一定先严厉批评教育,当然要晓之以理、动之以情,再通过师生共同监督让其改正。另一方面,对于非原则性的问题,要给予学生改正的机会和时间。此外,生生之间的榜样示范作用,会比教师长篇大论地说教更有效。生生间的讨论交流,同龄人的规劝,往往能直接激发学生内心向善改错的动机。
几丁质酶活性的测定:取4支1.5 mL离心管,分别加入上清液2mL,其中1支作为对照直接放入100℃水浴灭活10 min,取出后加入1 mL质量分数为1%的胶态几丁质,在放入40℃水浴60 min;另外3支加入1 mL质量分数为1%的胶态几丁质,放入40℃水浴60 min,然后4支一起放入100℃水浴灭活10 min,冷却后12 000 r/min离心10 min,分别取上清液2 mL(空白对照为蒸馏水),加入已装有1.5 mL DNS的试管中,100℃水浴10 min,取出后立即冷却,补充蒸馏水至5 mL,震荡放置20 min后于540 nm处测定吸光度值(OD540)。
1.9 菌种形态学鉴定
用显微镜观察菌落在PDA(或LB)平板培养18 h~24 h后的菌落形态特征,24 h后进行革兰氏染色,培养96 h进行芽孢染色;菌株LSX-9进行利用碳源产酸试验、明胶液化试验、苯丙氨酸脱氨酶试验、硝酸盐还原试验等生理生化试验。
1.10 系统发育树的构建
利用16 s和18 s rDNA通用引物对1.7中筛选得到的菌株进行PCR扩增和测序。经测序,菌株LSX-9的16S rDNA的部分序列长度为1 450 bp,菌株LSZ-1的18S rDNA的部分序列长度为1 362 bp,将二者分别上传至 GenBank数据库中,LSX-9的登录号为MG283323,LSZ-1的 登录 号 为 MG547960。 利 用BLAST程序在GenBank上对结果进行相似性比对,使用 MEGA7.0的邻接(Neighbor-Joining,NJ)方法构建系统发育进化树。
1.11 溶出曲线的绘制
1.11.1 多糖标准曲线的绘制
取9支具塞试管,分别加入D(+)-无水葡萄糖储备液溶液 0、0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL,各以水补至2.0 mL,然后加入新配置的5%的苯酚溶液0.6 mL,浓硫酸4.0 mL,摇匀,置于20℃的水浴锅显色20 min,而后立即置于事先准备好的冰水浴中冷却10 min,以蒸馏水做空白,于491 nm处测定吸光度A。以 D(+)-无水葡萄糖浓度(C)为横坐标,吸光度(A)为纵坐标,绘制多糖标准曲线。
1.11.2 三萜标准曲线的绘制
取9支具塞试管,分别加入齐墩果酸标准品溶液0、0.05、0.10、0.20、0.30、0.40、0.50、0.60、0.70 mL,各以95%乙醇补至1.0 mL,水浴挥干,放冷至室温,加入新配置的5%香草醛-冰醋酸溶液(显色剂)0.25 mL,高氯酸0.6 mL,摇匀,置于70℃的水浴锅中显色15 min,而后立即置于事先准备好的冰水浴中冷却10 min,取出,精密加入5 mL冰乙酸,以95%乙醇做空白,于546 nm处测定吸光度A。以齐墩果酸浓度(C)为横坐标,吸光度(A)为纵坐标,绘制三萜标准曲线。
1.11.3 释放曲线的绘制
精密称取0.1 g灵芝孢子粉,灭菌,分别加入0.5 mL LSX-9、LSZ-1的菌悬液,空白加入等量无菌水,然后分别将加有LSX-9和LSZ-1菌悬液的样品置于37℃和28℃的摇床中,在48 h内每隔4 h取样,取样后分别加水或95%乙醇至1.5 mL,超声10 min,10 000 r/min离心,取上清液,分别将多糖(水提取)和三萜(95%乙醇提取)定容至10 mL和5 mL,待测。取多糖液0.25 mL,蒸馏水补至2 mL,用1.11.1项下方法测定多糖含量,绘制变化曲线;取三萜液0.25 mL。95%乙醇补至1 mL,用1.11.2项下方法测定三萜含量,绘制变化曲线。
1.12 数据处理
利 用 BLAST(http://www.ncbi.nlm.nih.gov/BLAST)分析工具,对菌株的16s和18s DNA序列与数据库中已有的序列进行相似度比较分析;利用MEGA 7.0软件进行DNA序列的校准排齐,并构建系统发育树;数据均使用Excel 2016进行统计,Origin 9.1作图。
2 结果与分析
2.1 几丁质降解率
按1.7中方法测定菌株对几丁质的降解率,其中以LSX-9和LSZ-1效果较好,其降解率如表2,刚果红染色前、后效果如图2。
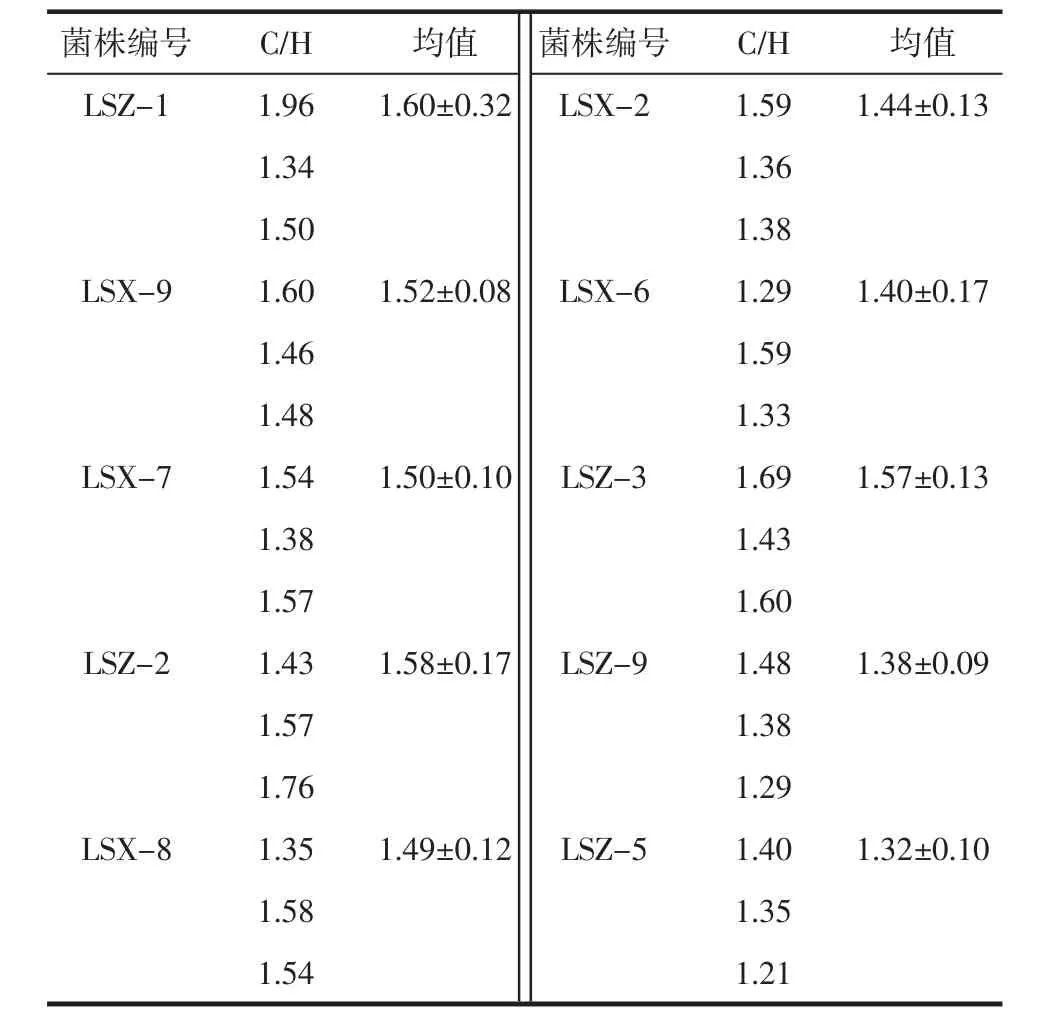
表2 菌株的几丁质降解率Table 2 Chitin degradation rate of strains

图2 菌落圈与透明圈Fig.2 Colony circle and transparent circle
2.2 纤维素酶与几丁质酶活性
2.2.1 葡萄糖与N-乙酰氨基葡萄糖标准曲线
按1.8.1、1.8.2中方法,做出纤维素和几丁质的还原性糖的标准曲线,如图3,D(+)-无水葡萄糖的方程为 y=1.856 9x-0.006 3,R2=0.999 6;N-乙酰氨基葡萄糖的方程为 y=1.088 3x-0.002 0,R2=0.998 5。
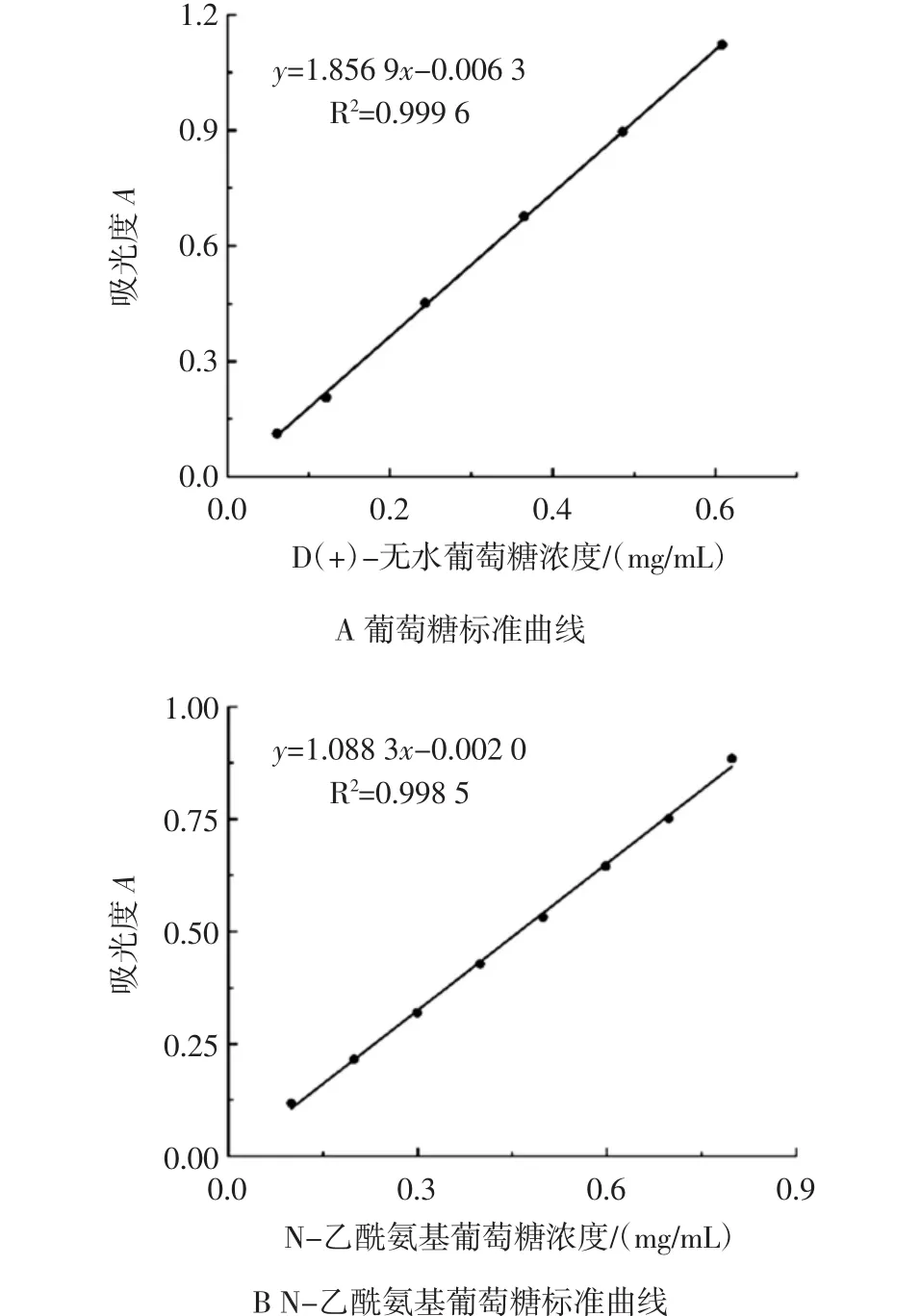
图3 葡萄糖与N-乙酰氨基葡萄糖标准曲线Fig.3 The standard curve of glucose and N-acetylglucosamine
2.2.2 酶活性测定
按1.8.3中方法,测定出菌株LSX-9和LSZ-1的纤维素酶与几丁质酶活性如表3。

表3 纤维素酶与几丁质酶活性Table 3 Cellulase and chitinase activity
2.3 菌株形态学鉴定
LSX-9在PDA培养基上培养3 d,菌落呈裂叶状,且有红色素形成;在LB液体培养基中好氧(或厌氧)培养2 d,表面有菌膜产生,菌体呈杆状,偶有细丝状;G+;芽孢中生或端生;细胞呈单个或链状排列。最适培养温度37℃,pH 7.2~7.4,好氧,180 r/min。LSX-9的生理生化试验结果如表4。

表4 LSX-9的生理生化试验Table 4 Physiological and biochemical tests of LSX-9
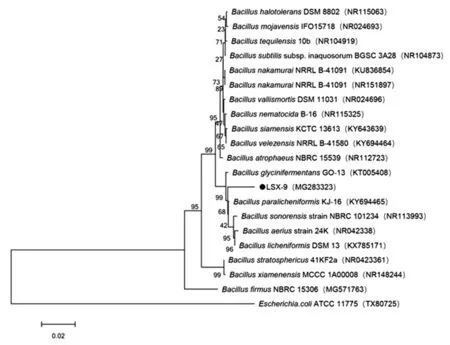
图4 菌株LSX-9的系统发育进化树Fig.4 Phylogenetic tree of strain LSX-9
LSZ-1在PDA培养基上培养5 d,菌落中心凸起或平坦,少量呈辐射状贴壁生长,有的菌丝为白色绒状或絮状,菌落反面黄褐色、淡黄色或带绿的淡黄色;产大量分生孢子,中间多边缘少,呈带灰的橄榄绿或灰褐色,显微镜下能明显观察到到分生孢子囊,呈球形或半球形,成熟时呈致密的圆柱状;在LB液体培养基中好氧培养2 d,菌体呈絮状存在。最适培养温度28 ℃,pH 7.2~7.4,好氧,180 r/min。
2.4 系统发育树的构建
用MEGA7.0软件,根据16s和18s rDNA序列相似性,将菌种LSX-9和LSZ-1与NCBI数据库中相应的菌一起构建系统发育树,见图4、图5。由系统发育树可 知 ,LSX-9 为 Bacillus paralicheniformis,LSZ-1 为Penicillium sp.。
2.5 溶出曲线
2.5.1 多糖与三萜标准曲线
按1.11.1、1.11.2中方法,做出多糖和三萜的标准曲线,如图6,多糖的方程为y=13.842 0x-0.011 5,R2=0.998 8;三萜的方程为 y=9.070 8x-0.006 5,R2=0.999 7。
2.5.2 多糖和三萜的释放曲线
灵芝孢子在萌发时会消耗自身的营养物质,同时,再接入菌悬液后,菌在前期繁殖时会消耗纤维素、几丁质等成分,促进多糖和三萜释放,然后一部分多糖和三萜用于孢子的萌发,一部分被菌吸收进行二次繁殖。多糖和三萜的释放曲线见图7。
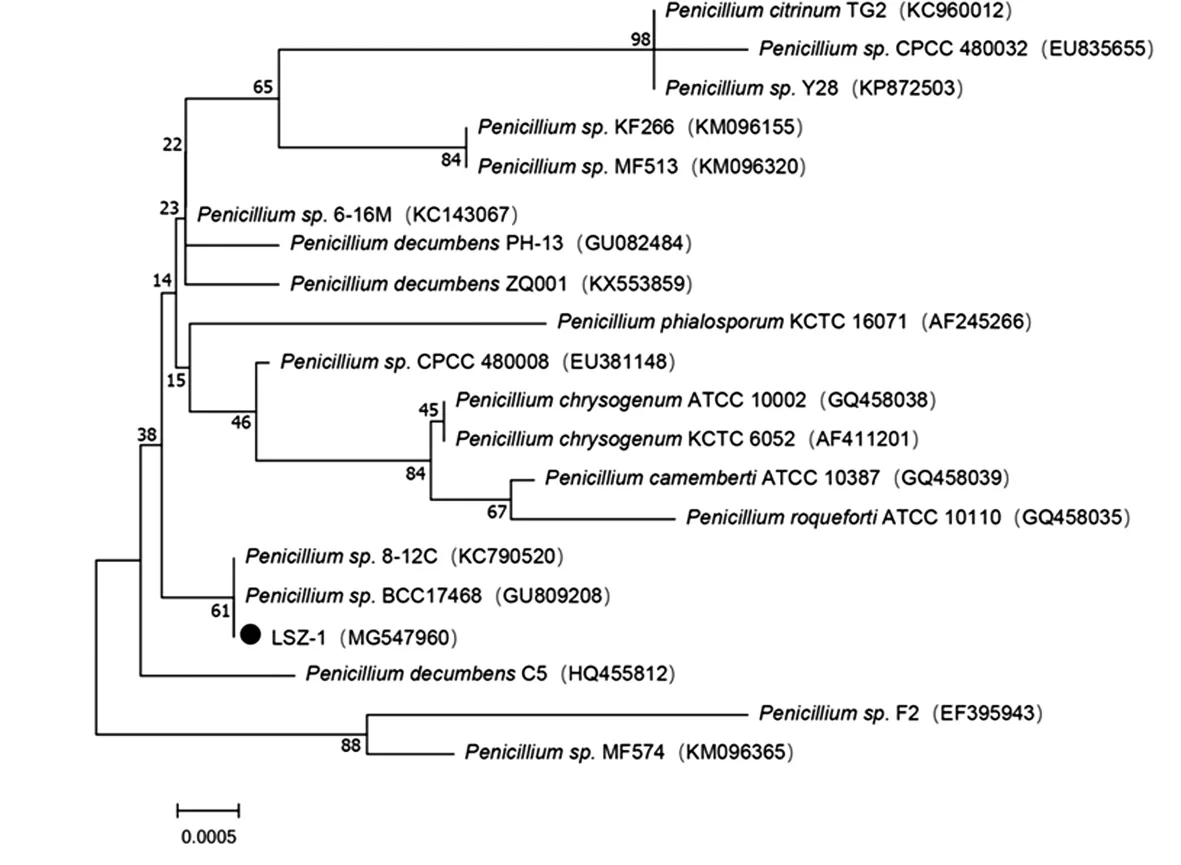
图5 菌株LSZ-1的系统发育进化树Fig.5 Phylogenetic tree of strain LSZ-1

图6 多糖与三萜标准曲线Fig.6 The standard curves of polysaccharides and triterpene
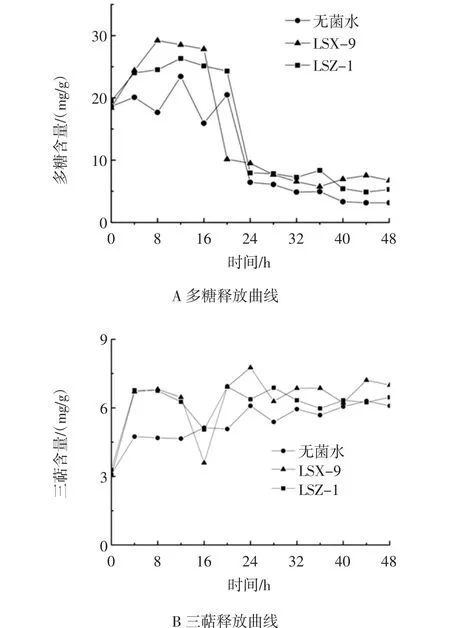
图7 多糖和三萜释放曲线Fig.7 The release curves of polysaccharides and triterpene
从图7可以看出,在接入菌悬液后,灵芝孢子多糖和三萜的释放时间有所提前,并且多糖和三萜的最大释放量均较空白组(接入无菌水)高。在接入LSX-9菌种后,多糖溶出较空白组提前4 h,同时含量较空白组的23.44 mg/g升高到29.22 mg/g,提高了24.66%。在接入LSZ-1菌种后,多糖溶出较空白组无提前,但是含量较空白组升高到26.33 mg/g,提高了12.33%。在接入LSX-9和LSZ-1菌种后,三萜溶出较空白组提前20 h,三萜含量较空白组的6.29 mg/g分别升高到7.76 mg/g和6.92 mg/g,分别提高了23.37%和10.02%。说明在接入菌种后,菌种合成、分泌的纤维素酶、几丁质酶能够降解灵芝孢子的细胞壁的主要成分。
3 结论
本研究通过大量筛选工作,从土壤环境分别分离得到一株具有几丁质酶、纤维素酶活性的细菌(LSX-9)和真菌(LSZ-1),并通过分子生物学鉴定其分别为Bacillus paralicheniformis和Penicillium sp.。对菌悬液与灵芝孢子的初步作用进行了研究,结果表明,LSX-9和LSZ-1能缩短多糖与三萜的释放时间,并能提高多糖与三萜的提取率,表明菌株对灵芝孢子细胞壁有一定的降解作用,对灵芝孢子生物破壁法的研究有一定的参考意义。Bacillus paralicheniformis是Bacillus licheniformis的特异菌株,具有很大的相似性[18],是芽孢杆菌中应用较广泛的有益菌种之一,具有刺激动物免疫器官的生长发育,增强细胞与体液免疫的功能[19],同时Bacillus licheniformis进入动物肠道后能够抑制大肠杆菌等有害菌的繁殖,并促进双歧杆菌等有益菌的增殖,提高动物免疫力,提高饲料消化率,促进动物生长,改善饲养环境[20];青霉属真菌已被证明可产生包括青霉素和灰黄霉素等在内的多种重要活性代谢产物以及纤维素酶、蛋白酶和脂肪酶等具有应用前景的酶类,因而被广泛应用于药物的研制、工业原材料的制备、新型酶制剂的筛选以及食品加工业等领域。近年来,有研究显示,青霉属真菌还具有降解多种环境有害物质(如芳烃类化合物等)的能力,在环境污染治理领域显示出良好的开发应用前景。表明Bacillus licheniformis和Penicillium sp.均不会对人体产生有害的影响。同时高等植物和真菌细胞壁结构组成、化学成分相似,暗示其可以在中药微量成分上具有较大应用前景。
参考文献:
[1]邓叔群.中国的真菌[M].北京:科学出版社,1963:445
[2]国家药典委员会.中华人民共和国药典:第一部[M].北京:中国医药科技出版社,2015:188
[3]陶婷婷,黄厚今.灵芝孢子粉的保健作用及展望[J].北方药学,2015,12(5):113
[4]张晓云,杨春清.灵芝的化学成分和药理作用[J].现代药物与临床,2006,21(4):152-155
[5]章灵华,肖培根.近十年灵芝研究的进展[J].西北药学杂志,1993(1):31-35
[6]Xiao C,Wu Q,Zhang J,et al.Antidiabetic activity of Ganoderma lucidum polysaccharides F31 down-regulated hepatic glucose regulatory enzymes in diabetic mice[J].J Ethnopharmacol,2017,196(2):47-57
[7]Shen J,Park H S,Xia Y M,et al.The polysaccharides from fermented Ganoderma lucidum,mycelia induced miRNAs regulation in suppressed HepG2 cells[J].Carbohydr Polym,2014,103(1):319-324
[8]Pan K,Jiang Q,Liu G,et al.Optimization extraction of Ganoderma lucidum polysaccharides and its immunity and antioxidant activities[J].Int J Biol Macromol,2013,55(2):301-306
[9]Heleno S A,Barros L,Martins A,et al.Fruiting body,spores and in vitro produced mycelium of Ganoderma lucidum from Northeast Portugal:A comparative study of the antioxidant potential of phenolic and polysaccharidic extracts[J].Food Res Int,2012,46(1):135-140
[10]Jin H,Jin F,Jin J X,et al.Protective effects of Ganoderma lucidum spore on cadmium hepatotoxicity in mice[J].Food Chem Toxicol,2013,52(2):171-175
[11]Ma H T,Hsieh J F,Chen S T.Anti-diabetic effects of Ganoderma lucidum[J].Phytochemistry,2015,114(4):109-113
[12]陈体强,李开本.灵芝,紫芝担孢子及其孢壁的超微结构[J].福建农业学报,1998(4):33-38
[13]陈体强,朱培根,蔡云,等.原木灵芝孢子研究——(Ⅳ)未破壁孢子与破壁孢子的比较[J].食用菌学报,1999,6(3):21-26
[14]彭亮,赵鹏,李彬,等.破壁灵芝孢子粉对小鼠免疫调节作用的实验研究[J].应用预防医学,2011,17(4):241-243
[15]张守勤,朱俊洁,王长征,等.灵芝孢子食用方法与破壁技术研究进展[J].农业机械学报,2004,35(2):160-162
[16]刘功良,唐汉良,谢锐均,等.蜂花粉破壁技术的研究进展[J].食品研究与开发,2014(12):102-104
[17]张灿.海洋产几丁质酶菌株的筛选、鉴定及其酶学性质研究[D].大连:大连工业大学,2012
[18]Dunlap C A,Kwon S W,Rooney A P,et al.Bacillus paralicheniformis sp.nov.,isolated from fermented soybean paste[J].INT J Syst Evol Micr,2015,65(10):3487-3492
[19]Le H D,Hong H A,Barbosa T M,et al.Characterization of bacillus probiotics available for human use[J].Applied&Environmental Microbiology,2004,70(4):2161-2171
[20]邢勇,李玉娟.地衣芽孢杆菌和木聚糖酶及其联合对AA~+肉鸡生长性能的影响[J].黑龙江畜牧兽医,2017(20):215-217

