亚临界水提取黑枸杞花青素工艺研究
邓丽娟,洪霞,钱滢文,*,王克辉,周鑫魁,刘琦,吴丽华
(1.甘肃省商业科技研究所,甘肃兰州730010;2.甘肃中商食品质量检验检测有限公司,甘肃兰州730010)
黑枸杞即黑果枸杞,属于茄科枸杞属。味甜多汁,营养丰富,被誉为荒漠中的“软黄金”和“黑珍珠”,极具研究和开发价值[1]。国内以青海黑枸杞品质最好。黑枸杞含有丰富的花色苷,使其呈现独特的黑色,花色苷又具有显著的抗氧化活性,近几年深受国人的追捧[2]。
亚临界水是指在适宜的温度和压力下,只要水保持为液态,这种液态水称为亚临界水。这种液态水对温度敏感,其极性会随温度变化而变化。亚临界水的物理、化学特性与常温常压下的水有较大差别,随着温度的升高,水的极性、表面张力和黏度都急剧下降,对中极性和非极性化合物的溶解能力会大大增加,其性质更接近于有机溶剂。亚临界水物理、化学特性的改变,主要与流体微观结构的氢键、离子水合、离子缔合、簇状结构的变化有关。水在常温常压下介电常数约为80,而升温升压至250℃、5 MPa时,水的介电常数降低到27,这个值和25℃、0.1 MPa下的乙醇相同,这表明亚临界水对中极性和非极性化合物具有一定的溶解能力[3-5]。亚临界水类似于有机溶剂,具有价廉、零污染的特点,在植物有效成分提取分离中得到了迅速发展。亚临界水提取是一种极具潜力开发成为工业化生产的绿色提取技术[4-8]。本研究通过单因素及正交试验优化黑枸杞亚临界水提取工艺,对黑枸杞中6种花青素含量进行了测定,建立了亚临界水提取高效液相色谱法测定黑枸杞花青素含量的方法。以期对黑枸杞中花青素的进一步开发提供一种绿色高效的新型技术。
1 材料与方法
1.1 材料与仪器
黑枸杞干果:原产青海,市售黑枸杞;50 mL亚临界高压反应釜:北京世纪森朗试验仪器有限公司;SHZ-Ⅲ型循环水真空泵:上海亚荣仪器厂;AG720EKF-NS微波炉:广东美的微波炉制造有限公司;Agilent1260高效液相色谱仪DAD检测器:美国安捷伦科技有限公司;XB220A电子天平:普利赛斯国际贸易(上海)有限公司;SB-5200DNT超声清洗机:宁波新芝生物科技股份有限公司;J-HH-4A精密数显恒温水浴锅:上海皓庄仪器有限公司。自组装亚临界水提取设备示意图见图1。
1.2 试剂
飞燕草色素94.5%、矢车菊色素96.8%、矮牵牛色素92.0%、天竺葵色素95.0%、芍药素97.0%、锦葵色素94.8%标准品:均购自美国ChromaDex公司;柠檬酸(优级纯):天津市大茂化学试剂厂;盐酸(优级纯):西陇科技股份有限公司;乙醇、乙腈、甲醇均为色谱纯:Fisher公司。
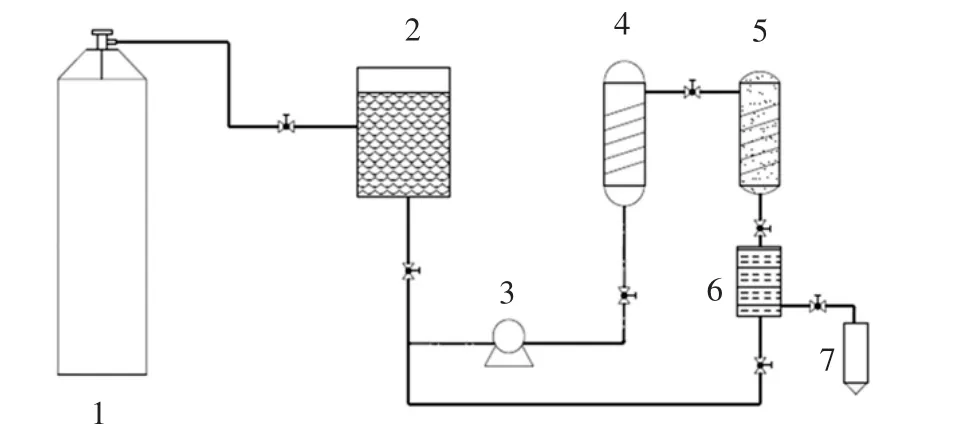
图1 自组装亚临界水提取设备示意图Fig.1 Schematic diagram of self-assembled subcritical water extraction equipment
1.3 方法
1.3.1 标准曲线的绘制
分别准确称取飞燕草色素、矢车菊色素、矮牵牛色素、天竺葵色素、芍药素和锦葵色素6种花青素标准品5.0 mg,用10%盐酸甲醇溶液溶解并定容至10 mL容量瓶,作为单标储备液。-18℃避光保存6个月。将单一标准贮备液混合用10%盐酸甲醇溶液逐级稀释成 0.5、1.0、5.0、25.0、50.0 mg/L 作为标准曲线使用液。以峰面积对溶液浓度进行线性回归,得回归方程。6种花青素标准曲线回归方程见表1。

表1 6种花青素标准回归方程Table 1 Six kinds of anthocyanin standard regression equation
6种花青素在0~1 μg之间线性良好。
1.3.2 色谱条件
色谱柱:Agilent C18柱(4.6 mm×250 mm×5 μm);流动相A为1.0%甲酸水溶液,B为乙腈为梯度洗脱0~5 min,88%A~90%A;10 min~15 min,80%A~85%A;15 min~20 min,70%A~75%A;20 min~30 min,88%A~90%A。柱温35℃;检测波长530 nm;进样量20 μL。
1.3.3 亚临界水提取单因素试验
将黑枸杞粉碎,过40目筛。称取制备好的黑枸杞1.00 g装入反应釜中,加超纯水,用柠檬酸调pH2.5,分别固定反应釜温度、提取时间、提取压力、料液比中的3个,以一个为变量来做单因素试验。以提取液中总花青素含量为考察指标,依次进行下列4个单因素试验:萃取温度(90、100、110、120、130、140 ℃)、萃取时间(10、14、18、22、26、30 min)、萃取压力(3、6、9、12、15、18 MPa)料液比 [1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30、1 ∶35(g/mL)]。考察各因素的不同水平对提取液中花青素含量的影响[9-11]。
1.3.4 最佳工艺条件的确定
在确定了单因素试验的基础上,选取4个因素各自较优的3个水平进行正交试验,采用L9(34)设计进行正交试验获取最佳工艺参数。因素水平表见表2。

表2 因素水平表Table 2 Factor and level table
1.3.5 回流法
称取制备好的黑枸杞粉1.00 g于50 mL具塞比色管中,加无水乙醇∶水∶盐酸按体积比2∶1∶1的提取液至刻度线,超声提取30 min,沸水浴中水解1 h。立即避光冷却,定容至50 mL。取上层清液过0.45 μm聚醚砜滤膜,待测[12-14]。
1.3.6 微波法
称取黑枸杞干粉1.00 g于烧杯中,加入60%乙醇140 mL,微波功率600 W,提取140 s。取上层清液过0.45 μm 聚醚砜滤膜,待测[15-16]。
1.3.7 结果计算
样品中花青素含量为6种花青素含量之和。其含量以质量分数ω计,含量单位为mg/kg,按下面的公式进行计算:
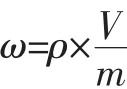
式中:ρ为待测液各花青素质量浓度,mg/L;V为定容体积,mL;m 试样质量,g。
2 结果与计算
2.1 单因素试验
2.1.1 提取温度的影响
提取温度对花青素含量的影响见图2。
由图2可以看出在90℃~120℃之间,随着温度的升高花青素含量增加,说明在这一温度范围内花青素在亚临界水中的溶解度随温度升高而增大。这是因为温度升高,水的极性降低,使花青素更易被提取出来;同时,升高温度可以降低水黏度,使水更容易被渗入黑枸杞中,然而当温度超过120℃后,提取率明显下降,提取液颜色逐渐加深褐变,这是由于花青素不耐高热,开始降解所致。Tomšik等[17]利用亚临界提取大蒜提取物时,提取温度也存在同样的趋势变化。因此,120℃为最佳提取温度。
2.1.2 提取时间的影响
提取时间对花青素含量的影响见图3。
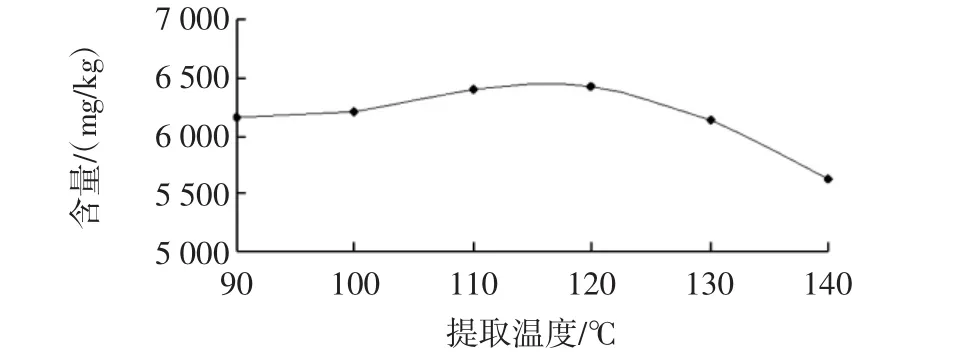
图2 提取温度对花青素含量的影响Fig.2 Extraction temperature on anthocyanin content
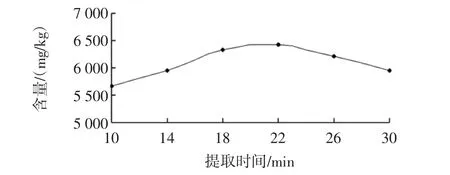
图3 提取时间对花青素含量的影响Fig.3 Extraction time on anthocyanin content
由图3可以看出,随提取时间的延长,花青素含量呈现先升后降的趋势。22 min内,随着提取时间的延长花青素含量显著增加,但超过22 min后明显下降,这是因为亚临界水提取黑枸杞中花青素的传质过程,是一个花青素在溶剂作用下通过分子扩散运动达到固-液相平衡的过程,到达平衡状态需要一定的时间,因此平衡前适当地延长提取时间有利于更多成分的溶出,可提高提取效率,时间过长会导致部分花青素发生降解,致使提取效率降低。Truong等[18]加压提取紫甘薯中花色苷时,发现长时间的高温高压会使花色苷大幅降解。18 min~22 min提取效果差异不大,为了节约时间,因此选择18 min为最佳提取时间。
2.1.3 提取压力的影响
提取压力对花青素含量的影响见图4。
由图4可知,压力对花青素含量的影响很小,从3 MPa~18 MPa之间花青素含量相差不到0.02%。亚临界水提取时,压力只是让水保持在液态状态,压力的变化对水极性的影响极小。该结果现象与文献[19-20]报道相吻合。高压力对仪器的要求就会更高,提取成本也会有所增加,所以选择9 MPa作为提取压力。
2.1.4 料液比的影响
料液比对花青素含量的影响见图5。
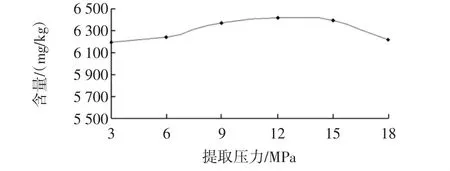
图4 提取压力对花青素含量的影响Fig.4 Extraction pressure on anthocyanin content
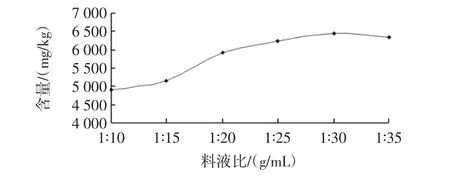
图5 料液比对花青素含量的影响Fig.5 The ratio of liquid to anthocyanin content
从图5可以看出,随料液比增大,花青素含量大幅增加,在料液比为1∶30(g/mL)时,花青素含量从4 897.3 mg/kg达到6 427.1mg/kg。这是由于溶剂量增多,更多溶剂渗透进黑枸杞,黑枸杞与溶剂的接触面积增大,对花青素的溶解增多,从而所提取出的花青素含量升高。但液料比过大会造成溶剂的浪费,提取时间也会相对延长,所以取料液比为1∶30(g/mL)比较合适。
2.2 最佳提取工艺的确定
利用上述4个因素以花青素含量为判断指标,设计L9(34)正交试验,寻求获得最佳的提取参数,并考察各因素对花青素含量影响的主次顺序。正交试验因素水平和提取工艺正交试验结果见表3。
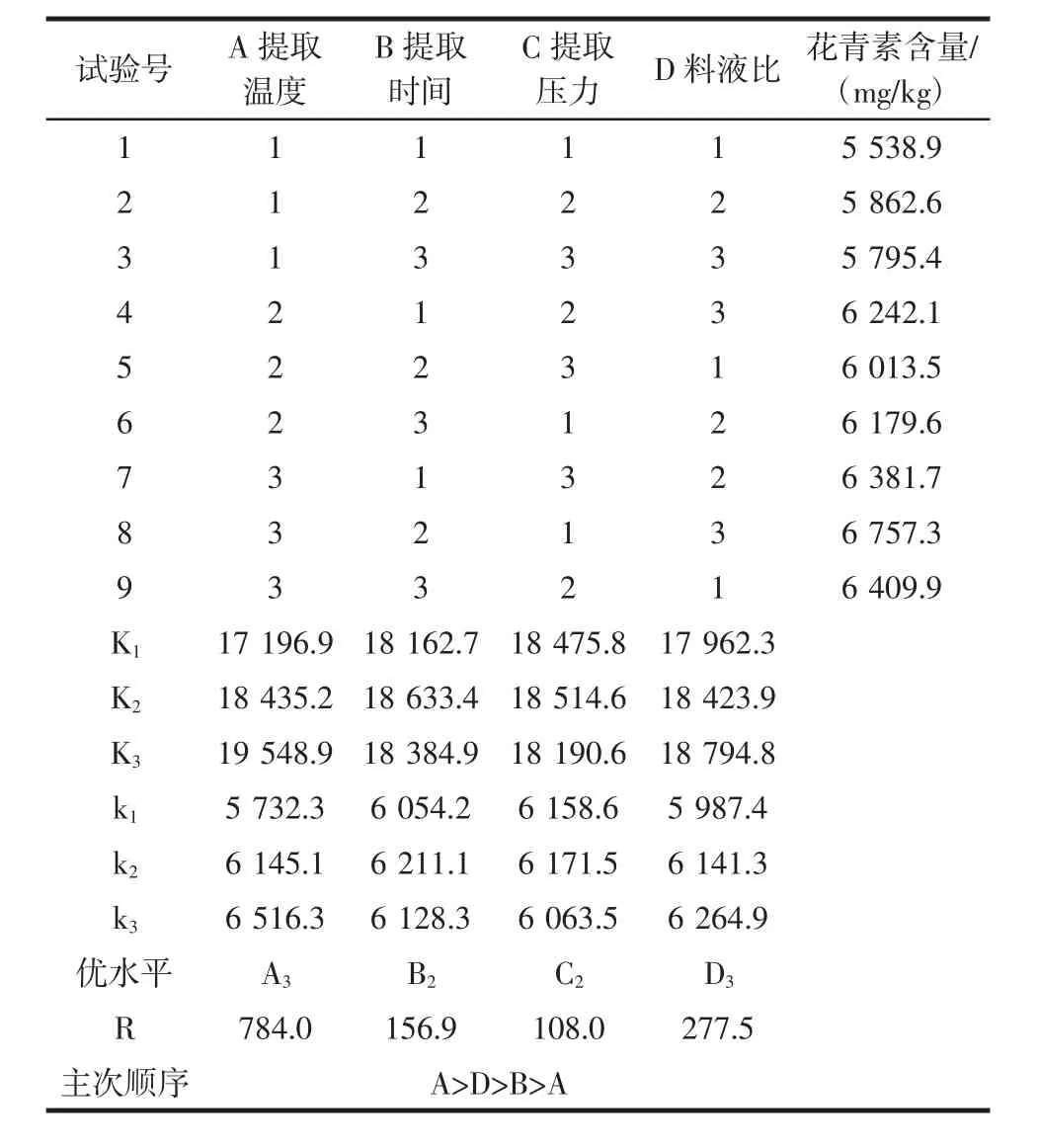
表3 L9(34)正交试验与极差分析Table 3 L9(34)orthogonal test and range analysis
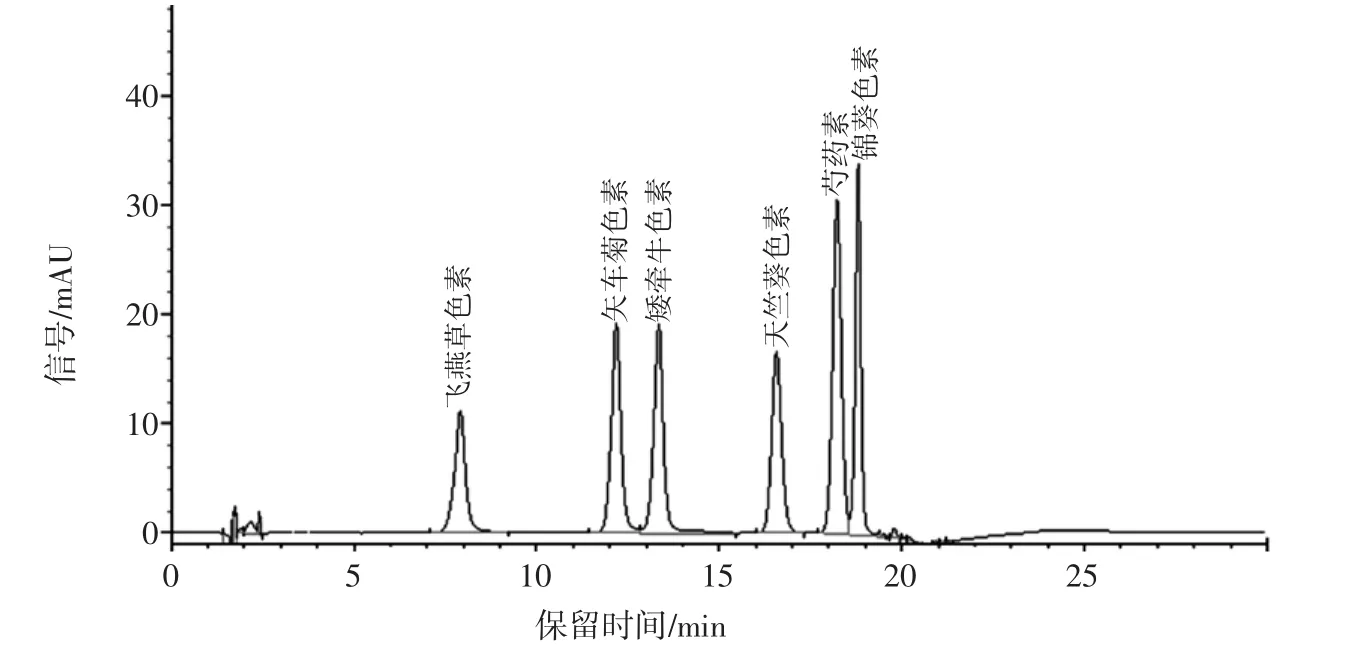
图6 6种花青素标准品色谱图Fig.6 6 kinds of anthocyanin standard chromatogram
由表3极差分析得出,各因素对提取效果的影响的主次顺序为提取温度(A)>料液比(D)>提取时间(B)>提取压力(C),最优因素水平组合为 A3B2C2D3,即提取温度为120℃,提取时间为18 min,提取压力为9 MPa,料液比为1∶30(g/mL)。经试验验证该条件下提取的黑枸杞花青素含量为6 862.4 mg/kg,高于正交表中任意一组含量,与理论分析结果一致。
2.3 花青素定量分析
图6、图7分别为6种花青素色谱图和亚临界法提取黑枸杞花青素色谱图。
通过对比图6和图7各自保留时间和光谱图,可以确定黑枸杞中提取液中含有4种花青素,分别为飞燕草色素、矮牵牛色素、芍药素和锦葵色素。其中矮牵牛色素含量最高占总花青素含量的79.5%。
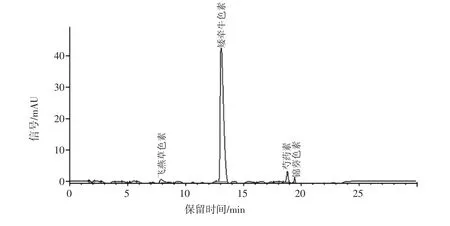
图7 亚临界法提取黑枸杞花青素色谱图Fig.7 Subcritical extraction of black wolfberry anthocyanin chromatogram
2.4 不同提取方法比较
不同提取方式对花青素的提取效果见表4。
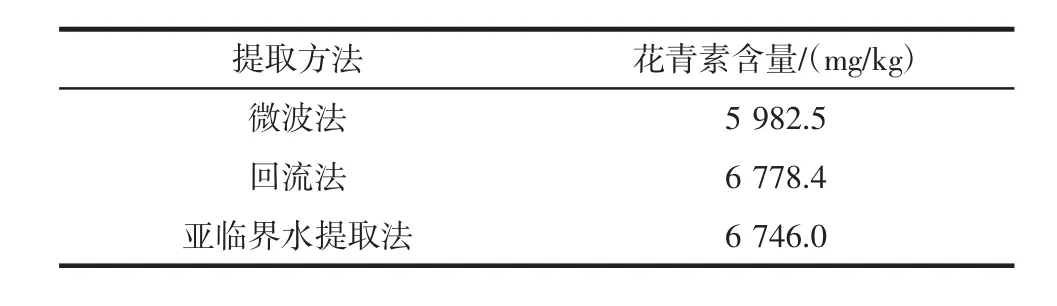
表4 不同提取方式花青素含量(n=3)Table 4 Different extraction methods anthocyanin content(n=3)
从表4可以看出,亚临水提取花青素效果完全不逊色于现已成熟的传统微波法和回流法,亚临界水提取花青素原料无需干燥,设备简单易组装,无需太高压力,十几分钟内就能完全有效的提取黑枸杞花青素,无有机溶剂添加,安全无污染,显示出决定性的优势。
3 结论
通过单因素试验和正交试验分析获得亚临界水提取黑枸杞花青素的最佳工艺参数为提取温度为120℃,提取时间为18 min,提取压力为9 MPa,料液比为1∶30(g/mL)。通过液相色谱分析得出黑枸杞中花青素有4种,分别为飞燕草色素、矮牵牛色素、芍药素和锦葵色素,其中矮牵牛色素含量最高。总花青素含量为6 862.4 mg/kg。
通过试验比较了微波法、回流法和亚临界水提取法,发现亚临界水对黑枸杞花青素的提取效果与传统回流法相当。且此法对花青素原料要求较低,设备简单易组装,提取时间短,效果好,无污染,为黑枸杞中花青素的进一步开发提供一种绿色高效的新型技术。
参考文献:
[1]潘自皓,顾子扬,周帅,等.黑枸杞花色苷提取工艺的优化[J].食品工业科技,2016,37(16):302-307
[2]张玲艳,王宏权.黑枸杞花青素的提取及其抗氧化活性研究[J].食品工业,2014,35(12):88-90
[3]郑光耀,薄采颖,张景利.亚临界水萃取技术在植物提取物邻域的应用研究进展[J].林产化学与工业,2010,30(5):108-112
[4]吴昊.紫甘薯色素的亚临界水萃取剂性质研究[D].哈尔滨:东北农业大学,2013
[5]李超,王卫东,虞海燕,等.超声强化亚临界水提取脱脂葡萄籽中原花青素的工艺及其抗氧化研究[J].中国中医药杂志,2010,35(8):967-971
[6]张海晖,李金凤,段玉清,等.板栗壳原花青素提取及其稳定性研究[J].食品科学,2011,32(8):8-9
[7]Duba K S,Casazza A A,Mohamed H B,et al.Extraction of polyphenols from grape skins and defatted grape seeds using subcritical water:Experiments and modeling[J].Food and Bioproducts Processing,2015,94(4):29-38
[8]林耀盛,刘学铭,杨荣玲,等.桑椹片中多分及花青素含量的测定[J].现代食品科技,2013,29(4):890-892
[9]毛建霏,周虹,雷绍荣,等.高效液相色谱法测定紫甘薯花青素含量[J].西南农业学报,2012,25(1):123-126
[10]徐怀德,闫宁环,陈伟,等.黑莓原花青素超声波辅助提取优化及抗氧化性研究[J].农业工程学报,2008,24(2):264-268
[11]张镜,何洪洛.正交试验优化大叶榕果实原花青素提取工艺[J].食品科学,2015,36(2):41-45
[12]胡莉,雷绍荣,郭灵安,等.NY/T 2640-2014植物源性食品中花青素的测定[S].北京:中国标准出版社,2014
[13]肖丽霞,何志贵,朱勇,等.葡萄籽中原花青素提取工艺[J].食品科学,2011,32(20):89-94
[14]陈健,孙爱东.响应面分析法优化超声波提取槟榔原花青素工艺[J].食品科学,2011,32(4):82-86
[15]黄琼,陈婵,彭宏,等.微波法萃取紫色甘薯皮原花青素工艺的研究[J].食品科技,2010,35(4):199-203
[16]杨建荣,孙承锋.微波辅助萃取苹果渣中原花青素的工艺研究[J].食品与机械,2008,24(3):70-73
[17]Tomšik A,Pavlic B,Vladic J,et al.Subcritical water extraction of wild garlic (Allium ursinum L.)and process optimization by response surface methodology[J].The Journal of Supercritical Fluids,2017,128(10):79-88
[18]Truong V D,Hu P Z,Thompson R L,et al.Pressurized liquid extraction and quantification of anthocyanins in purple-fleshed sweet potato genotypes[J].Journal of Food Composition and Analysis,2012,26(1):96-103
[19]Dinh T V,Saravana P S,Woo H C,et al.Ionic liquid-assisted subcritical water enhances the extraction of phenolics from brown seaweed and its antioxidant activity[J].Separation and Purification Technology,2017,6(6):123-126
[20]Srinivas K,King J W,Luke R,et al.Solubility and solution thermodynamic properties of quercetin and quercetin dihydrate in subcritical water[J].Journal of Food Engineering,2010,100(2):208-218

