超声波辅助提取山药多糖及体外抗氧化性研究
王晓敏,林霖雨,李康丽,田川尧,蔡锋隆,杨华,洪中山
(天津农学院动物科学与动物医学学院,天津300384)
淮山药(Dioscorea opposita thumb)是薯蓣科薯蓣属植物薯蓣,别名又称山药、土薯、山薯、山蓣等,是一种常见的中药[1]。除了药用价值外,山药还是一种常见的食材,即药食同源[2]。山药的营养成分包括淀粉、蛋白质和游离氨基酸等;其生物活性成分含多糖(黏液质和糖蛋白)、尿囊素、胆碱多酚氧化酶等。其中,山药多糖被认为是山药的主要活性物质,其在抗氧化、抗衰老、促进肠胃功能和提高免疫力等方面均具有生理活性[3]。
根据山药多糖溶于水,不溶于乙醇的性质,传统山药多糖的提取方法为水提醇沉法。为了提高山药多糖的提取率,可在水提醇沉的基础上采用超声波辅助,这种方法可以借助超声波产生的空化效应、机械效应、热效应和其他次级效应,在不改变多糖结构的基础上,提高提取率[4]。本文采用超声波辅助提取法提取山药多糖,通过正交试验确定超声波辅助提取法提取山药多糖的最佳条件并探讨其体外抗氧化活性,为山药多糖的利用和天然安全食品抗氧化剂的开发提供参考。
1 材料与方法
1.1 材料与试剂
淮山药:天津市红旗农贸市场;山药多糖(按本试验最佳提取条件提取所得,经盐酸法脱蛋白后纯度达73.23%);DPPH自由基(1,1-二苯基-2-苦肼基自由基):梯希爱(上海)化成工业发展有限公司;羟自由基清除能力测定试剂盒、HPLC>98%维生素C、三羟甲基氨基甲烷(Tris)、邻苯三酚:北京索莱宝生物技术有限公司;试验用水为离子交换水。
1.2 仪器与设备
JY92-Ⅱ超声波细胞粉碎机:宁波新芝生物科技股份有限公司;GZX-9240ME数显鼓风干燥箱:上海博迅实业有限公司医疗设备厂;FZ102微型植物粉碎机:天津市泰斯特仪器有限公司;RE-52旋转蒸发仪:上海雅荣生化设备仪器厂;UV-800紫外可见分光光度计:上海元析仪器有限公司。
1.3 方法
1.3.1 山药多糖的制备
淮山药自然阴干至没有黏液状态后转至60℃恒温干燥箱烘干至恒重、粉碎机粉碎、过60目筛。称取一定量预处理的山药粉末放置在烧杯中,加入蒸馏水,在某一超声时间、超声功率、料液比和水浴浸提时间条件下提取山药多糖。提取液于3 000 r/min离心机中离心15 min,滤渣重复上述操作,进行二次提取;合并两次上清液于旋转蒸发仪中,在70℃条件下旋转蒸发至原体积的1/3,再加入3到4倍体积的95%乙醇,室温下,静置过夜。醇沉后的液体3 000 r/min离心15 min后取上清液。将所得上清液再放置于旋转蒸发仪中,60℃条件下旋转蒸发至粘稠状态,将所得粘稠液置于60℃恒温干燥箱中烘干至恒重,经研钵研磨即可得山药粗多糖。
1.3.2 山药多糖含量的测定
采用苯酚-浓硫酸法测定山药多糖含量[5]。测定时的最大吸收波长为483 nm(在紫外波长200 nm~700 nm下扫描得到)。由葡萄糖标准曲线回归方程计算样品溶液的山药多糖浓度,依据公式(1)计算样品溶液山药多糖百分含量[5]。
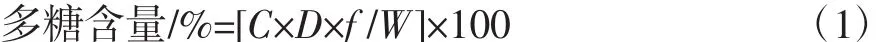
式中:C为样品溶液对应的葡糖糖浓度,mg/mL;D为样品溶液稀释倍数;f为换算因子,0.9;W为样品质量,g。
1.3.3 单因素试验
准确称取2 g山药多糖粉末,按照一定料液比加入去离子水于100 mL烧杯中。将此烧杯放入装有冰水混合物的大烧杯中,再将其放入超声波细胞破碎机中,在预设的超声波功率下提取一段时间后,再转入60℃水浴锅中浸提一段时间,提取液于3 000 r/min离心机离心15 min,滤渣重复上述操作,合并两次滤液,取1 mL滤液定溶于10 mL容量瓶中,采用苯酚-浓硫酸法测定山药多糖含量,确定最佳超声时间、超声功率、料液比和水浴浸提时间。
1.3.4 正交试验
在单因素试验基础上,采用L9(34)正交表进行正交试验设计。
1.3.5 山药多糖体外抗氧化性研究
1.3.5.1 DPPH自由基清除率的测定
DPPH自由基存在多个吸电子的-NO2和苯环的大π键,因此其含有稳定的氮自由基,呈暗紫色,当抗氧化剂(山药多糖)消除DPPH自由基时,其最大吸收波长517 nm处的吸光度值随之减小,因此在某一浓度下对应的吸光度值越小,其抗氧化能力越强[6]。取2 mL不同浓度的山药多糖溶液和0.000 2 mol/L DPPH自由基溶液(溶剂为95%乙醇),混匀后在室温条件下避光反应20 min,以相同体积的乙醇和蒸馏水调零,在517 nm处测吸光度。依据公式(2)计算不同浓度山药多糖的DPPH自由基清除率。
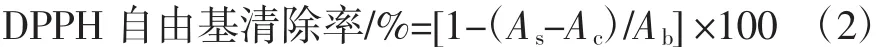
式中:As为试验组吸光度值,2 mL样品溶液+2 mL DPPH自由基溶液;Ac为对照组吸光度值,2 mL样品溶液+2 mL 95%乙醇;Ab为空白组吸光度值,2 mL蒸馏水+2 mL DPPH溶液。
1.3.5.2 羟自由基清除率的测定
Fenton反应可产生羟自由基,并将邻二氮菲-Fe2+水溶液中的Fe2+氧化为Fe3+,其呈色与羟自由基的多少呈正比关系,即536 nm处吸光度越小,样品对羟自由基的清除能力越强[7]。取250 μL不同浓度的山药多糖溶液,按试剂盒说明书操作,在536 nm处测定其吸光度值。试验设空白组(Ab)、对照组(Ac)和试验组(As)。依据公式(3)计算不同浓度山药多糖的羟自由基清除率。
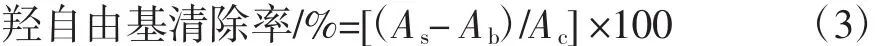
1.3.5.3 超氧阴离子自由基清除率的测定
参照刘璐等人的文献,用邻苯三酚自氧化法测定山药多糖对超氧阴离子自由基的清除率[8]。以蒸馏水为空白Ab,于325 nm处测定混合物吸光度值As,依据公式(4)计算不同浓度山药多糖的超氧阴离子自由基清除率。
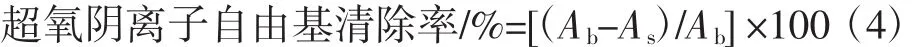
2 结果与分析
2.1 葡萄糖标准曲线的绘制
以葡糖糖浓度(x)为横坐标,吸光度值(Y)为纵坐标,进行线性回归,得到回归方程Y=0.010 4x+0.006(R2=0.995 8),说明葡萄糖在 30 μg/mL~210 μg/mL 范围内线性关系良好。标准曲线见图1。
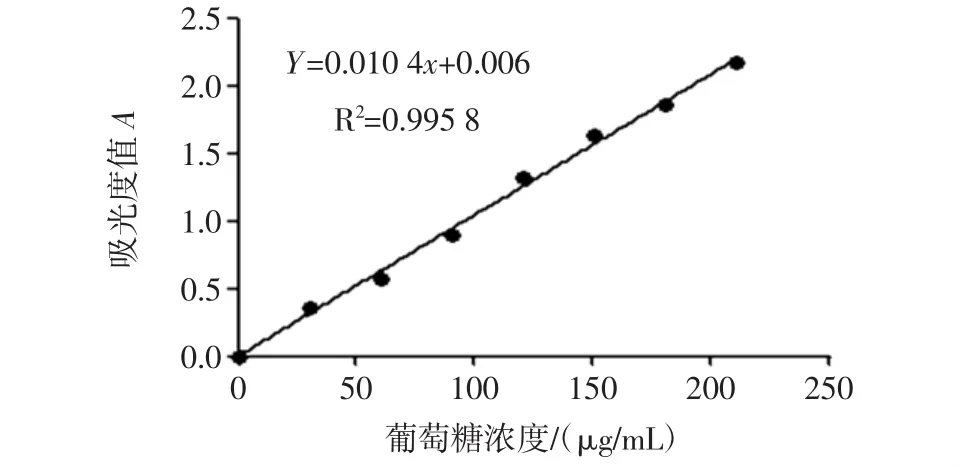
图1 葡糖糖标准曲线Fig.1 Standard curve of glucose
2.2 单因素试验
2.2.1 超声时间对多糖提取率的影响
固定超声功率600 W,水浴浸提时间30 min,料液比 1 ∶20(g/mL),考察山药多糖分别在 10、20、30、40、50、60 min超声时间下的多糖提取率,结果见图2。
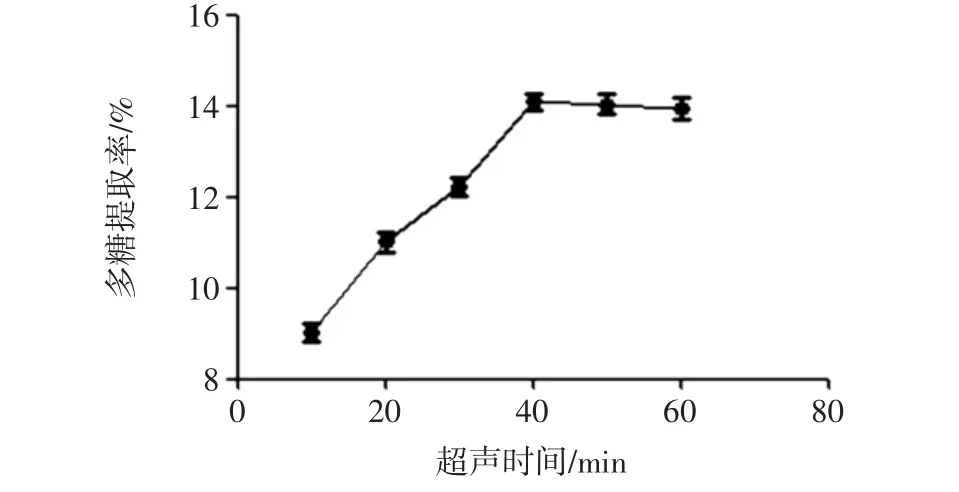
图2 超声时间对多糖提取率的影响Fig.2 Effect of ultrasound time on the polysaccharide yield
超声时间10 min~40 min内,多糖提取率逐渐增大;超声时间40 min时多糖提取率达到最大值;之后,随时间的延长,多糖提取率变化趋于平稳。因此,最佳超声时间为40 min。
2.2.2 超声功率对多糖提取率的影响
固定超声时间40 min,水浴浸提时间30 min,料液比 1 ∶20(g/mL),考察山药多糖分别在 200、400、600、800、1 000 W功率下的多糖提取率,结果见图3。
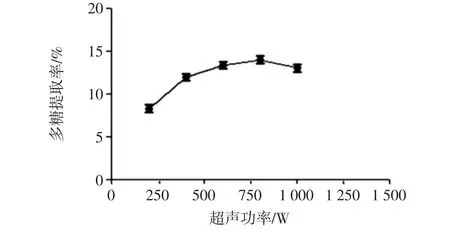
图3 超声功率对多糖提取率的影响Fig.3 Effect of ultrasound power on the polysaccharide yield
在200 W~800 W范围内,多糖提取率逐渐增大,到800 W时达到最大值;此后多糖提取率下降。因此,最佳超声功率为800 W。
2.2.3 料液比对多糖提取率的影响
固定超声功率800 W,超声时间40 min,水浴浸提时间 30 min,考察山药多糖分别在 1 ∶10、1 ∶15、1 ∶20、1 ∶25、1 ∶30(g/mL)料液比下的多糖提取率,结果见图4。
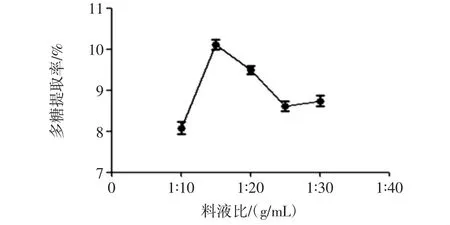
图4 料液比对多糖提取率的影响Fig.4 Effect of solid to water ratio on the polysaccharide yield
料液比在 1 ∶10(g/mL)~1 ∶15(g/mL)时,多糖提取率大幅度增加;1 ∶15(g/mL)~1 ∶25(g/mL)时,多糖提取率下降,随后变化较为平缓。因此,选择料液比1∶15(g/mL)最为合适。
2.2.4 浸提时间对多糖提取率的影响
固定超声功率800 W,超声时间40 min,料液比1 ∶15(g/mL),考察山药多糖在 10、20、30、40、50 min 水浴浸提时间下的多糖提取率,结果见图5。10 min~20 min,多糖提取率缓慢上升;20 min~30 min,多糖提取率大幅上升;此后,随时间增加,多糖提取率开始下降。因此,最佳水浴浸提时间为30 min。
2.3 正交试验
依据单因素试验结果,采用L9(34)正交表对超声波辅助法提取山药多糖的最佳条件进行优化。因素水平编码表见表1。正交试验结果见表2。
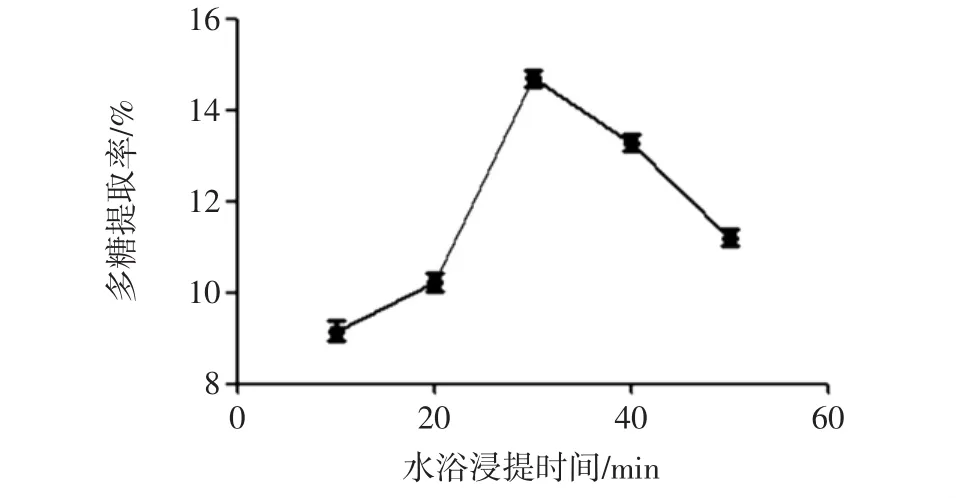
图5 水浴浸提时间对多糖提取率的影响Fig.5 Effect of water bath extracting time on the polysaccharide yield
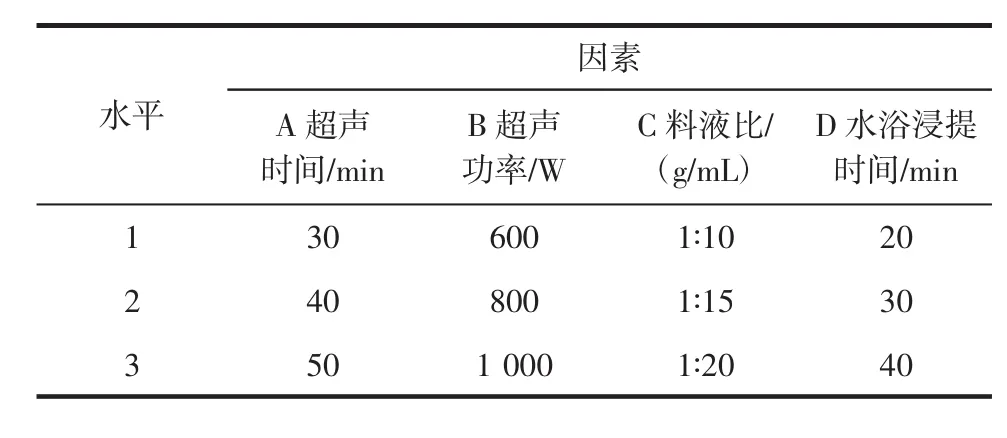
表1 因素水平设计L9(34)Table 1 Factors and levels of orthogonal experiment
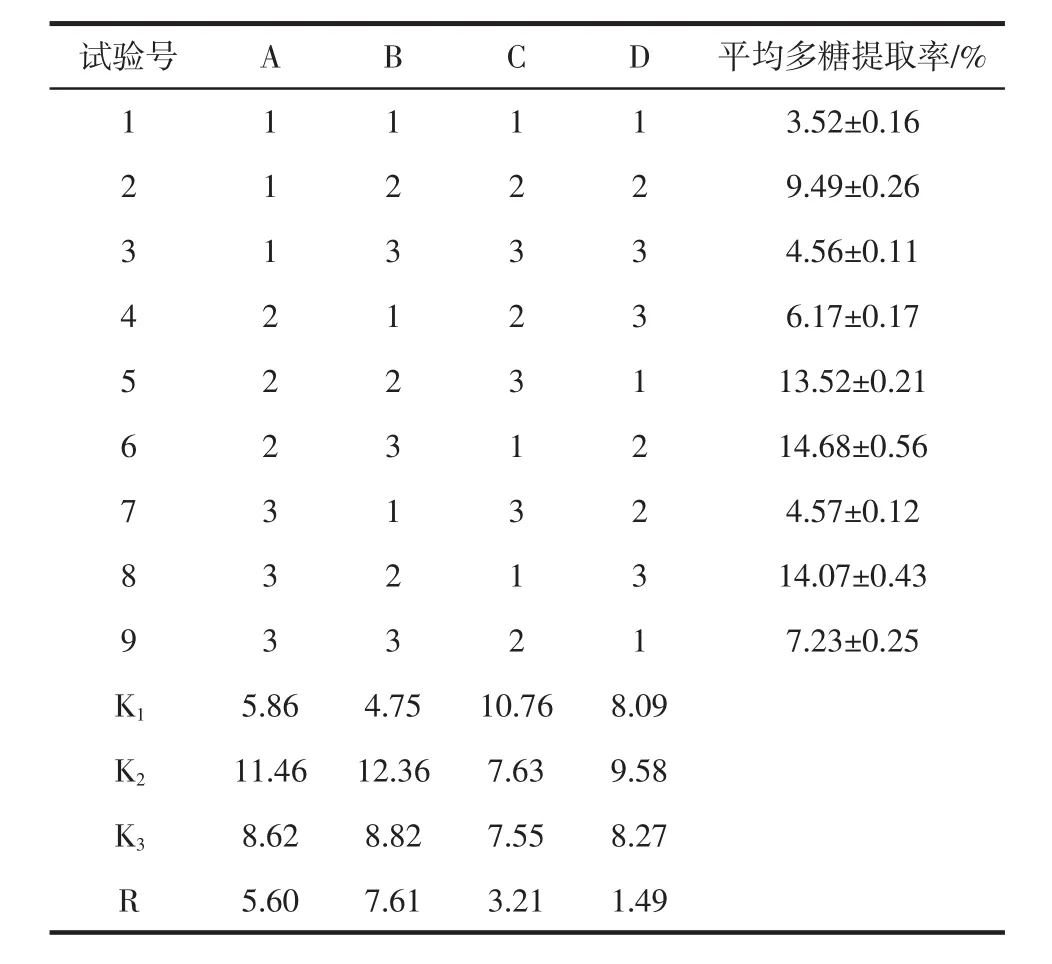
表2 正交试验结果与分析Table 2 Results and analysis of orthogonal experiment
根据正交试验结果和极差分析可以看出:各因素对山药多糖提取率的影响主次顺序为:B>A>C>D,即:超声功率>超声时间>物料比>水浴浸提时间。根据K值的大小可知最佳提取工艺条件为:A2B2C1D2,即:超声时间40 min,超声功率800 W,料液比1∶10(g/mL),60℃水浴浸提时间30 min。验证该条件下的山药多糖提取率,结果分别为15.16%、15.31%、15.22%,平均多糖提取率达15.23%。
2.4 山药多糖体外抗氧化性的研究
2.4.1 DPPH自由基清除率
不同浓度山药多糖清除DPPH自由基能力测定结果如图6所示,显著性分析见表3。
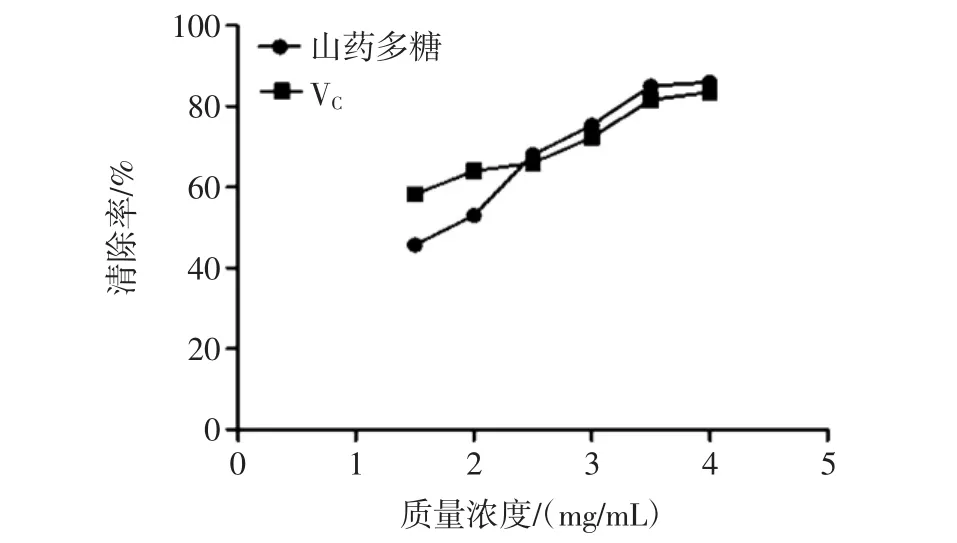
图6 DPPH自由基的清除率Fig.6 The scavenging rate to DPPH free radical
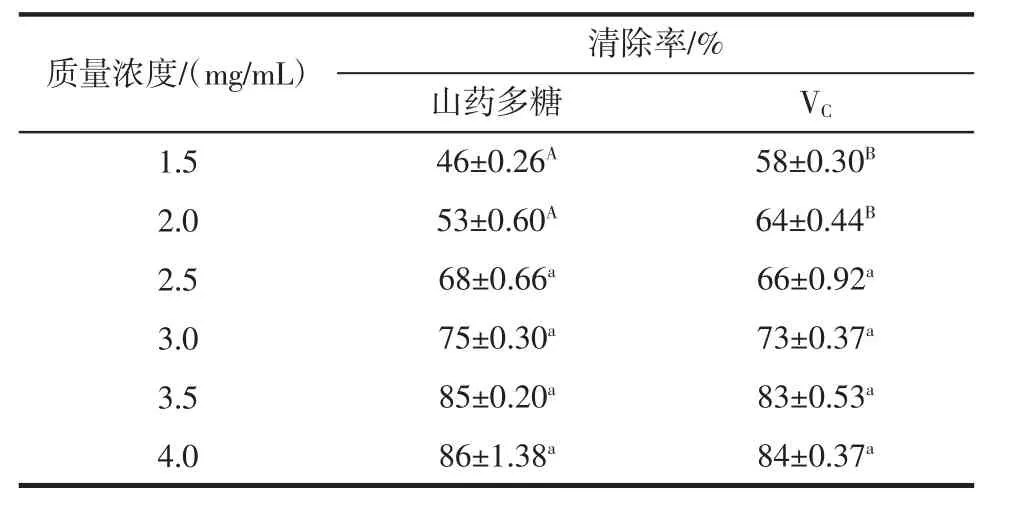
表3 显著性分析(n=6)Table 3 Analysis of significant(n=6)
在4.0 mg/mL浓度范围内,山药多糖和对照组VC清除DPPH自由基能力均逐渐增强。当多糖浓度在1.5 mg/mL~2.5 mg/mL时,对照组VC清除DPPH自由基能力强于山药多糖,差异极显著(P<0.01);当多糖浓度在2.5 mg/mL~4.0 mg/mL时山药多糖清除DPPH自由基能力接近或强于对照组VC,差异不显著(P>0.05),说明只有在山药多糖的含量达到一定浓度时才有较强的清除DPPH自由基的能力。
2.4.2 羟自由基清除率
不同浓度山药多糖清除羟自由基能力测定结果如图7所示,显著性分析见表4。
在4.0 mg/mL浓度范围内,山药多糖和VC清除羟自由基能力均逐渐增加。当多糖浓度在1.5 mg/mL~2.5 mg/mL时山药多糖清除羟自由基能力与对照组VC几乎相等,差异不显著(P>0.05);当多糖浓度在3.0 mg/mL~4.0 mg/mL时山药多糖清除羟自由基能力高于对照组 VC,差异显著(P<0.05)。
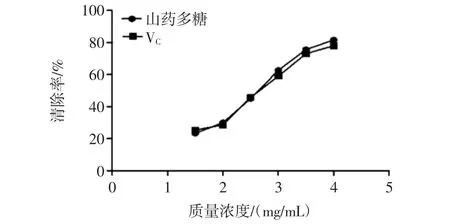
图7 羟基自由基的清除率Fig.7 The scavenging rate to hydroxyl free radical
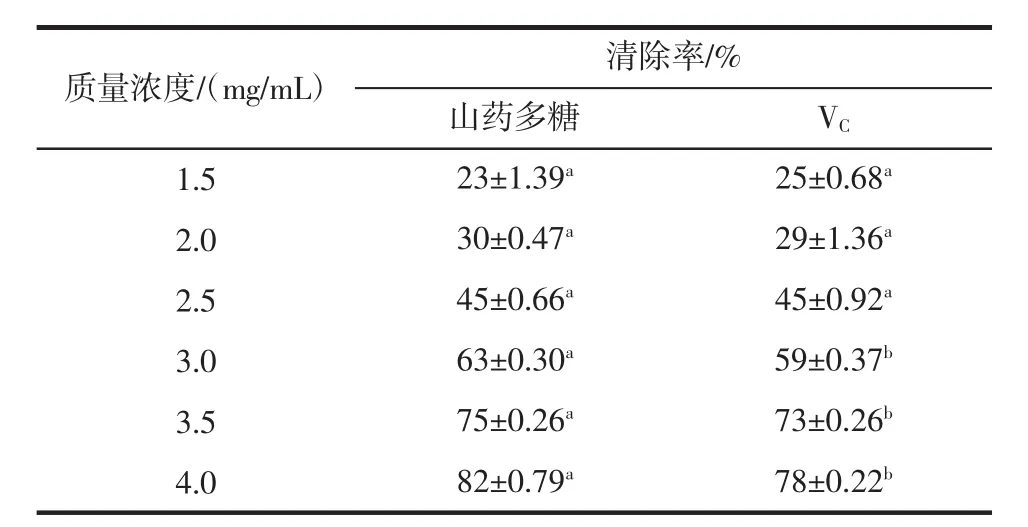
表4 显著性分析(n=6)Table 4 Analysis of significant(n=6)
2.4.3 超氧阴离子自由基清除率
不同浓度山药多糖清除超氧阴离子自由基能力测定结果如图8所示,显著性分析见表5。
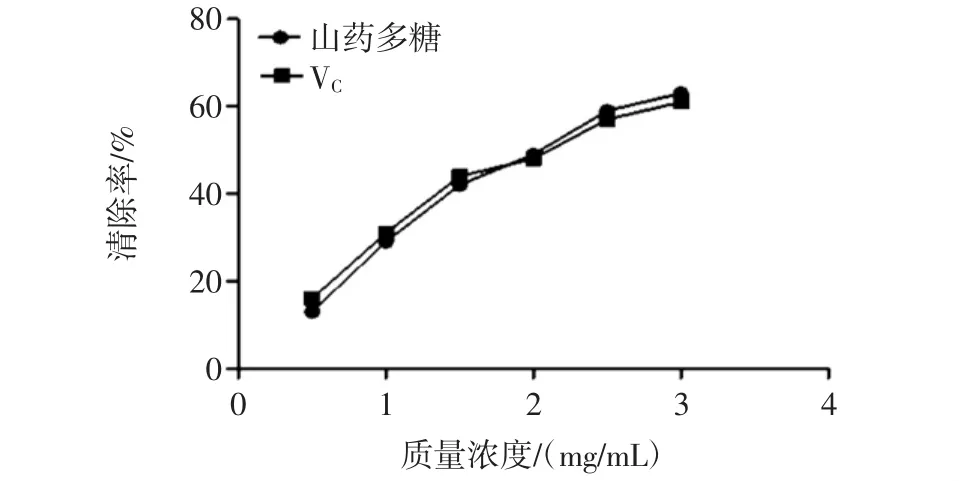
图8 超氧阴离子自由基清除率Fig.8 The scavenging rate to superoxide anion free radical
在3.0 mg/mL浓度范围内,山药多糖和VC清除超氧阴离子自由基能力均逐渐增加,且清除能力相接近。但当浓度超过1.5 mg/mL时,山药多糖的清除能力高于对照组 VC,差异显著(P<0.05)。
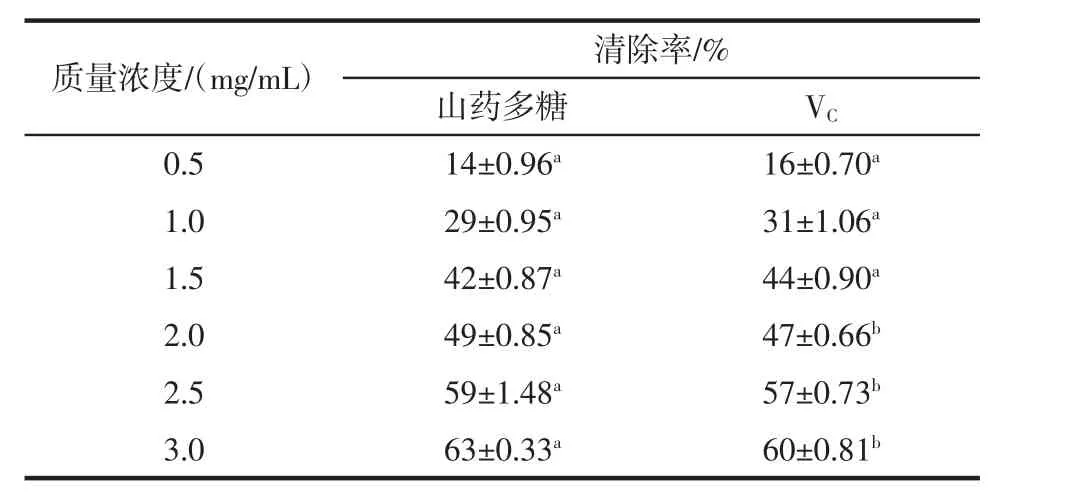
表5 显著性分析(n=6)Table 5 Analysis of significant(n=6)
3 结论
本文用超声波辅助法提取淮山药多糖,在超声时间 40 min,超声功率 800 W,料液比 1∶10(g/mL),60℃水浴浸提时间30 min,提取2次时,山药多糖的提取率为15.23%;所提多糖有较好的体外抗氧化活性,且与质量浓度呈一定计量效应关系,当山药多糖的浓度分别达到4.0、4.0、3.0 mg/mL时,山药多糖对DPPH、羟基、超氧阴离子自由基的清除能力分别达到86%、82%和63%。
参考文献:
[1]周滢,苏咏梅,曾志华,等.山药与《神农本草经》中“上品”中药配伍的临床运用探析[J].世界科学技术-中医药现代化,2013,15(9):2060-2062
[2]颜腾龙.八种药食同源中药降血脂和抗氧化作用研究[D].长沙:湖南农业大学,2014
[3]李敏.山药活性成分提取技术及药理功能的研究进展[J].南方农业学报,2013,44(7):1184-1190
[4]刘航,国旭丹,马雨洁,等.超声波辅助提取苦荞麦多糖工艺优化及其体外抗氧化研究[J].食品科学,2013,34(14):45-50
[5]刘玲,陶松,应萍,等.苯酚硫酸法测补肾口服液中多糖含量及其不确定度评价[J].江西中医学院学报,2013,25(3):38-41
[6]邹碧群,何瑞杰,莫绪.2-[[3-羟苯基]亚氨基]苯酚的DPPH自由基清除活性研究[J].桂林师范高等专科学校学报,2013,27(3):133-136
[7]张凡,李兴武,钟政荣.邻苯三酚自氧化法测定血浆超氧化物歧化酶的方法学评价及临床应用探讨[J].淮海医药,2015,33(3):227-229
[8]刘璐,乔宇,汪兰,等.山药多糖的抗氧化作用研究[J].食品科技,2014,39(12):212-216

