复合保鲜剂对腐生葡萄球菌的抑菌活性及其作用机理
朱亚珠 林森森
(浙江国际海运职业技术学院,浙江 舟山 316021 )
中国毛虾虾皮是一种营养丰富的传统水产制品,因其味道鲜美,蛋白质含量高,且富含人体所需多种维生素与矿物质而深受消费者喜爱。然而在生产流通过程中虾皮易受微生物、氧化等的影响,容易出现变色、异味甚至腐败变质的情况[1]。采用合适的保鲜处理方式,以抑制虾皮在贮藏期间微生物的生长,延缓其品质的劣变,已成为当前急需解决的问题。保鲜剂是添加到食品中实现抑制微生物生长、抗氧化等目的的食品添加剂。
前期研究[2]表明,腐生葡萄球菌是虾皮贮藏过程中的主要优势腐败菌之一,为葡萄球菌属非致病性革兰氏阳性菌。腐生葡萄球菌能分泌蛋白酶和脂酶,在肉制品贮藏过程中可导致脂质分解和蛋白质降解,从而产生小分子醛、酮、醇、胺和有机酸等腐败代谢产物影响产品品质[3]。王芳等[4]研究了肉桂精油对腐生葡萄球菌的抑菌作用,得到了较好的效果。汪玲玲等[5-7]比较了几种食用防腐剂对金黄色葡萄球菌的抑菌作用,结果表明抑菌(杀菌)效果较好的均为一些生物防腐剂如乳酸链球菌素、茶多酚、壳聚糖和溶菌酶等。山梨酸钾能有效防止葡萄球菌的生长和繁殖[8],选择山梨酸钾、苯甲酸钠、蔗糖酯等复合食品添加剂,检测其对金黄色葡萄球菌生物被膜的影响,发现在一定质量浓度范围内,对金黄色葡萄球菌生物被膜的形成均具有一定的抑制作用[9]。施建兵等[10]34-43采用复合保鲜剂(茶多酚、溶菌酶和壳聚糖)对鲳鱼块中腐生葡萄球菌的抑菌效果进行研究,结果表明该复合保鲜剂能够显著抑制腐生葡萄球菌的生长,并显著延缓鱼块品质的变化。生物防腐剂由于价格高、用量大等因素限制了实际应用。而山梨酸钾、双乙酸钠和异抗坏血酸钠是安全性较高且价格相对低的防腐剂,在食品保鲜中已广泛应用。目前,复合保鲜剂主要应用在果蔬和水产品中,水产品中的应用主要集中在对新鲜的鱼类和对虾的保鲜[11],但在虾皮中的应用鲜有报道,而采用山梨酸钾、双乙酸钠和异抗坏血酸钠组成的复合保鲜剂对腐生葡萄球菌的抑制作用未见报道。因此,研究复合保鲜剂对虾皮中腐生葡萄球菌的抑菌机制具有重要意义。本课题组前期有关虾皮保鲜剂筛选及保鲜效果研究表明[12],山梨酸钾和双乙酸钠具有较好的抑菌效果,而异抗坏血酸钠具有较好的护色和抗氧化作用,通过不同特性的抗菌保鲜剂复合使用,对虾皮的贮藏与流通过程可起到较好的保鲜效果。
本试验在前期研究基础上,以腐生葡萄球菌为对象,将山梨酸钾、双乙酸钠与异抗坏血酸钠复配成复合保鲜剂,由酶标法确定复合保鲜剂对腐生葡萄球菌的最低抑菌浓度(MIC)和最低杀菌浓度(MBC),并结合抑菌活力、细菌生长曲线、细胞膜完整性、碱性磷酸酶(AKP)含量与细菌超微结构观察,进一步探讨复合保鲜剂的抑菌机制,综合评价复合保鲜剂在不同处理时间对腐生葡萄球菌的影响,阐明复合保鲜剂对腐生葡萄球菌的抑菌机理。
1 材料与方法
1.1 材料与仪器
1.1.1 试验材料
试验菌株分离自中国毛虾虾皮,经16S rDNA鉴定为腐生葡萄球菌(ATCC 15305)。
1.1.2 试剂与培养基
山梨酸钾、双乙酸钠:食品级,宁波王龙集团有限公司;
异抗坏血酸钠:食品级,江西省德兴市百勤异VC钠有限公司;
碱性磷酸酶(AKP)测试盒:南京建成生物工程研究所;
平板计数培养基(PCA培养基):国药集团化学试剂有限公司;
营养肉汤培养基:杭州微生物试剂有限公司;
戊二醛、乙醇、叔丁醇、磷酸盐:分析纯,国药集团化学试剂有限公司。
1.1.3 仪器与设备
立式压力蒸汽灭菌器:LDZX-75KBS型,上海申安医疗器械厂;
超净工作台:ZHJH-C1118B型,上海智成分析仪器制造有限公司;
扫描电子显微镜:S-3400N型,日立有限公司;
扫描型紫外可见分光光度计:UV-3200型,上海美谱达仪器有限公司;
落地高速冷冻离心机:D-37520型,美国Thermo Fisher Scientific公司;
电导率仪:DDS-11C型,上海仪电科学仪器股份有限公司;
酶标仪:Plate Reader M200 型,瑞士Tecan集团有限公司。
1.2 试验方法
1.2.1 复合保鲜液制备 复合保鲜剂由山梨酸钾、双乙酸钠和异抗坏血酸钠按一定比例和方法配制,配制比例参考前期使用的方法[12],配比浓度为山梨酸钾1.0 g/L、双乙酸钠0.5 g/L 与异抗坏血酸钠2.0 g/L。
1.2.2 菌株活化 将试验菌腐生葡萄球菌菌株在营养肉汤中活化后,接种于100 mL营养肉汤培养基中,于摇床(37 ℃、160 r/min)培养24 h后离心(4 000 r/min,15 min),用无菌去离子水洗涤3次,并将其稀释成106CFU/mL的菌悬液备用。
1.2.3 最低抑菌浓度(MIC)与最低杀菌浓度(MBC)的测定
根据韦何雯[13]的96孔板酶标比浊法,修改如下:用无菌蒸馏水配制好复合保鲜剂(3 500 μg/mL),备用。在96孔酶标板上,用无菌营养肉汤将复合保鲜剂依次稀释成浓度为3 500,1 750,875,438,219,109,55,0 μg/mL的抗菌液100 μL。在8个孔中分别加入事先稀释好的腐生葡萄球菌菌悬液(104CFU/mL)100 μL,此时,各孔中的有效保鲜剂浓度依次为1 750,875,438,219,109,55,27,0 μg/mL。平行操作3次。用酶标仪测定各孔的初始OD600值,再将酶标板置于37 ℃恒温培养24 h,取出后再次测定各孔的OD600值,并计算前后△OD600的绝对值,取3次操作的平均值。
(1) 最低抑制浓度(MIC)的确定:△OD600≤0.05的保鲜剂最低浓度,并结合肉眼观察澄清者。
(2) 最低杀菌浓度(MBC)的确定:从细胞板中,将含有大于MIC复合保鲜剂的菌悬液各吸取0.1 mL涂布于营养琼脂培养基平板上,置于37 ℃恒温箱中继续培养24 h,活菌数与初始值相比减少99.9%的最低抑菌剂浓度即为保鲜剂的最低杀菌浓度,每个浓度梯度做2个平行,试验重复3次。
1.2.4 抑菌活力的测定 根据蓝蔚青等[6]的方法,修改如下:按1.2.3中的方法配制复合保鲜剂浓度为MIC和MBC的菌悬液,并用无菌去离子水代替保鲜剂作对照组,于37 ℃、160 r/min摇床培养,分别于培养0,1,2,3,4,5,6,7 h时用酶标仪测定630 nm处的吸光度值,并绘制曲线。抑菌活力按式(1)计算[14]:
(1)
式中:
U——抑菌活力;
A0——对照组的吸光度;
A——处理组的吸光度。
1.2.5 复合保鲜剂对腐生葡萄球菌生长的影响 参考翁佩芳等[15]的方法,按1.2.3中的方法配制复合保鲜剂浓度为MIC和MBC的菌悬液,并用无菌去离子水代替保鲜剂作对照组。用酶标仪测定各孔的初始OD600值;然后将酶标板置于37 ℃恒温培养箱中培养24 h,每隔2 h测定并记录菌悬液的OD600值。相同过程重复3次,求平均值。以培养时间为横坐标,OD600值为纵坐标,绘制腐生葡萄球菌的生长曲线。
1.2.6 复合保鲜剂对菌体细胞壁、细胞膜通透性的影响
(1) 对细胞壁通透性影响:配制复合保鲜剂浓度分别为MIC和MBC的菌悬液,并用无菌去离子水代替保鲜剂作对照组。于37 ℃、160 r/min摇床培养,分别于培养0,1,2,3,4,5,6,7 h时取样,离心(4 000 r/min,10 min)后取上清液,用碱性磷酸酶(AKP)测试盒测定其含量。
(2) 对细胞膜通透性影响:取1.2.6(1)离心后的上清液,测定其在260 nm处的吸光度值。
(3) 对细胞质渗漏影响:取1.2.6(1)离心后的上清液,用电导仪测定其电导率。每个样品重复3次,取平均值。
1.2.7 菌体细胞超微结构观察 根据蓝蔚青等[6]的方法,修改如下:取适量菌悬液(对数期)离心(4 000 r/min,15 min),用无菌去离子水洗涤菌体沉淀3次,并稀释成菌落总数为105CFU/mL的菌悬液。试验组加入复合保鲜剂使其终浓度为MBC,对照组加入等量的无菌生理盐水,2组菌液于37 ℃、160 r/min 摇床培养10 h。分别取10 mL菌液,离心(4 000 r/min,15 min),菌体沉淀用PBS缓冲液洗涤3次后,用2.5%的戊二醛固定12 h,再分别用30%,50%,70%,90%的乙醇梯度脱水,随后叔丁醇干燥,冷冻干燥后固定、喷金,最后在扫描电镜下观察菌体的形态结构。
2 结果与分析
2.1 复合保鲜剂最低抑菌浓度(MIC)与最低杀菌浓度(MBC)的确定
MIC与MBC的测定结果见表1。由表1可知,复合保鲜剂浓度≥109 μg/mL时,其△OD600值均<0.05,且在109,55 μg/mL浓度下的△OD600值差距明显,且随着浓度的增加,△OD600值下降较为显著。这表明复合保鲜剂浓度≥109 μg/mL 时,对腐生葡萄球菌有较好的抑制效果,且其抑菌作用随着保鲜剂浓度的下降而逐渐减弱。故复合保鲜剂对菌体的最低抑菌浓度为109 μg/mL。选择复合保鲜剂浓度>109 μg/mL的几个梯度处理菌体进行琼脂平板培养,结果显示最低杀菌浓度(MBC)为219 μg/mL。资料显示,较多保鲜剂和复合保鲜剂对葡萄球菌的最低抑菌浓度和最低杀菌浓度为千分比浓度,如蓝莓提取物对金黄色葡萄球菌的MIB和MBC分别为300,450 mg/mL[16];壳聚糖、溶菌酶与茶多酚配制而成的复合保鲜剂对金黄色葡萄球菌的MIB和MBC分别为0.8,1.6 mg/mL[6]。本研究中采用的复合保鲜剂对腐生葡萄球菌的MIB和MBC则为百万分比浓度,抑菌效果较为突出。

表1 复合保鲜剂浓度对腐生葡萄球菌的抑菌效果
2.2 复合保鲜剂的抑菌活力
为进一步表征在MIC和MBC浓度下复合保鲜剂的抑菌活力,研究了复合保鲜剂的抑菌活性与时间的关系,结果见图1。分别用MIC与MBC浓度的复合保鲜剂处理腐生葡萄球菌后,都分别在1,3 h时出现活性最高峰,随后抑菌活力逐渐减弱。此外,MBC处理后的抑菌活性明显高于MIC处理组,故复合保鲜剂质量浓度与抑菌效果呈正相关。

图1 复合保鲜剂对腐生葡萄球菌的抑菌动力学
Figure 1 Antibacterial kinetics of complex preservatives againstStaphylococcussaprophyticus
2.3 复合保鲜剂对腐生葡萄球菌生长的影响
细菌培养液一般在600 nm左右具有最大的吸光值,故可以根据菌悬液的OD600值来判断细菌的菌体数量。由图2可知,对照组的腐生葡萄球菌生长正常,2~12 h阶段为细菌的生长对数期,该阶段菌体数量增长迅速,12 h后增长较缓慢,进入稳定期。与对照组相比,2~12 h时,MIC组与MBC组的生长速度显著降低,进入稳定期(12 h)后,MIC组与MBC组的菌体量也显著小于对照组。结果表明,经MIC和MBC浓度的复合保鲜剂处理后,腐生葡萄球菌的生长受到明显抑制,且MBC浓度的抑制作用明显高于MIC浓度的。

图2 复合保鲜剂对腐生葡萄球菌生长的影响
Figure 2 Effects of complexpreservatives on the growth ofStaphylococcussaprophyticus
2.4 复合保鲜剂对细菌细胞壁的影响
碱性磷酸酶(AKP)是一种广泛存在于动植物及微生物体内的磷酸单酯水解酶,在生物体内的物质代谢中具有重要作用,它参与了磷酸基团的转移和代谢,能调节Ca2+的代谢,并且与多种大分子位置的代谢有关[17]。AKP一般存在于细胞壁和细胞膜间,一般情况下无法在活体细胞外检测到其活性,当细胞壁或细胞膜(尤其是细胞壁)遭到破坏后,细胞的通透性增加,AKP则会泄漏至胞外。因此,可通过检测菌体胞外的AKP含量来了解细胞壁通透性的变化[18]。
从图3可知,在0~6 h时,3个试验组的AKP量都缓慢增长,6 h后增长迅速。1 h后MIC组和MBC组的AKP量明显高于对照组,其中,MBC组的AKP量增加更为明显。表明复合保鲜剂处理使腐生葡萄球菌细胞壁通透性增加,影响其生长与代谢。此外,细胞壁通透性增加还可能造成菌体电解质外泄增多,破坏细胞内环境和细胞膜的稳定性,从而进一步抑制菌体的生长[10]49-50。
Figure 3 Effects of complex preservatives on cell wall ofStaphylococcussaprophyticus
2.5 复合保鲜剂对细菌细胞膜稳定性的影响
细胞膜是细菌的第2道屏障,当细胞膜遭到破坏后,膜内小分子物质及核酸等大分子物质随之泄漏出来。故通过检测菌液260 nm处的吸光值来测定菌液中胞外核酸的含量,从而了解细胞膜的破坏程度。由图4可知,随着作用时间的延长,MIC组与MBC组的吸光值明显高于对照组,且在2~8 h时其吸光值快速上升,分别从0.205,0.313增加到0.935,1.285;处理8 h后,试验组的吸光值显著高于对照组(0.35)(P<0.05);对照组的吸光值随时间的延长其增速较为缓慢。由此可见,复合保鲜剂对细菌细胞膜有一定的破坏作用,且破坏强度与保鲜剂浓度呈正相关。
当复合保鲜剂破坏细胞膜后,菌体的保护屏障被打破,菌体内部电解质外泄至培养液中,从而使培养液的电导率值上升[19]。因此,可通过菌液电导率值的变化来了解细菌细胞膜的通透性变化[20]。由图5可知,在0~8 h时,MIC组和MBC组菌悬液的电导率明显高于对照组,且随着时间的延长,MIC组和MBC组的电导率值显著增大,而对照组增速较为缓慢。
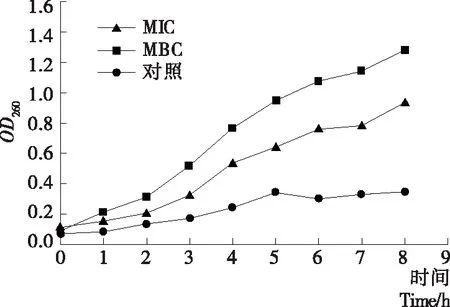
图4 复合保鲜剂对腐生葡萄球菌膜完整性的影响
Figure 4 Effects of complex preservatives on adventitia permeability ofStaphylococcussaprophyticus

图5 复合保鲜剂对腐生葡萄球菌细胞质渗漏的影响
Figure 5 Effects of complex preservatives on cytoplasmic leakage ofStaphylococcussaprophyticus
MBC组菌悬液的电导率明显高于对照组,且随着时间的延长,MIC组和MBC组的电导率值显著增大,而对照组增速较为缓慢。
0 h时,MBC组、MIC组和对照组的电导率分别为16.465,16.342,16.462 μs/cm,说明试验组培养液中含有的复合保鲜剂和对照组中含有的去离子水的电导率基本一致,故排除了由于培养液成分不同造成的影响。在0~1 h时,对照组的电导率增加较明显,在其后时间中电导率增加较缓慢,维持在相对稳定的状态,与蓝蔚青等[19]研究结果一致,对照组菌悬液的相对电导率在0~2 h时增加较快,可能与对照试验采用的无菌去离子水有关,菌体在该环境生长,本身就会发生部分裂解而导致电导率上升;也有可能是细菌在正常的生长代谢期间,选择性透过H+、K+、Na+、Ca2+等离子[20],培养液积累了这些小分子物质使得电导率明显增加。试验组在0~1 h时,电导率显著增加,MBC组和MIC组的电导率增速分别为1.885,1.305 μS/(cm·h);在1~8 h时,电导率虽增加显著,但增速放缓,分别为0.15,0.17 μS/(cm·h),可能是复合保鲜剂对细胞膜的破坏作用在培养前期已发挥较大作用,导致大量菌体细胞膜破裂。260 nm吸光值与电导率测定结果较一致,根据以上结果推测,复合保鲜剂使菌体细胞膜受到破坏或渗透性增加,导致胞内电解质大量泄露至培养液中,影响其正常代谢,最终导致死亡。
2.6 复合保鲜剂对细菌细胞形态的影响
对照组和MBC组中腐生葡萄球的电镜扫描结果见图6。从图6中可看出,对照组的菌体细胞较完整、胞体呈立体球状且饱满,细胞表面完整、光滑;经MBC浓度处理12 h后,菌体表面出现不平整,部分细胞表面出现凹陷、干瘪,一部分菌体出现成团的破裂,使内容物逐渐渗出至胞外。由此可见,复合保鲜剂对菌体有损伤作用,使菌体细胞表面破损。

图6 处理12 h的腐生葡萄球菌的扫描电镜图
Figure 6 Scanning electron microscopy ofStaphylococcussaprophyticustreated for 12 h
3 结论
以配比浓度为山梨酸钾1.0 g/L、双乙酸钠0.5 g/L与异抗坏血酸钠2.0 g/L的混合液为复合保鲜剂,作用于腐生葡萄球菌具有较好的抑菌效果。研究表明,复合保鲜剂的MIC为109 μg/mL,MBC为219 μg/mL。复合保鲜剂对腐生葡萄球菌有较好的抑菌活力,并且能明显抑制菌体繁殖。胞外碱性磷酸酶含量、核酸含量和电导率的测定结果较一致,表明复合保鲜剂对腐生葡萄球菌的细胞壁和细胞膜均有影响,破坏了细胞的完整性。经复合保鲜剂处理的腐生葡萄球菌菌体细胞发生了表面凹陷、干瘪和破裂现象。腐生葡萄球菌是虾皮贮藏过程中的主要优势腐败菌,本研究为虾皮贮藏和流通中的保鲜应用提供了一定参考。
[1] 沈月新. 水产食品学[M]. 北京: 中国农业出版社, 2001: 23-24.
[2] 朱亚珠, 翁佩芳, 刘娜, 等. 中国毛虾贮藏过程细菌群落多样性分析[J]. 核农学报, 2017, 31(9): 1 759-1 766.
[3] ZAREI M, MAKTABI S, GHORBANPOUR M. Prevalence of Listeria monocytogenes, Vibrio parahaemolyticus, Staphylococ-cus aureus, and Salmonella spp. in seafood products using multiplex polymerase chain reaction[J]. Foodborne Pathogens & Disease, 2011, 9(2): 108-112.
[4] 王芳, 曹锦轩, 潘道东, 等. 肉桂精油对成团泛菌和腐生葡萄球菌的抑菌活性及其机理[J]. 食品工业科技, 2016, 37(19): 75-80.
[5] 汪玲玲, 郝淑贤, 吕彦均. 食用防腐剂对金黄色葡萄球菌生长参数的影响[J]. 食品科学, 2013, 34(15): 62-65.
[6] 蓝蔚青, 谢晶, 毛峰, 等. 复合生物保鲜剂对金黄色葡萄球菌的抑菌作用研究[J]. 食品与生物技术学报, 2014, 33(8): 814-820.
[7] 王琼, 唐俊妮, 汤承, 等. 6种食品防腐剂对金黄色葡萄球菌抑菌效果及肠毒素基因表达的影响[J]. 食品科学, 2016, 37(21): 151-156.
[8] 任剑豪, 吴卫国. 山梨酸及其钾盐防腐效果的研究进展[J]. 南方农业, 2017, 11(17): 77-78.
[9] 谢丽斯, 张文艳, 许佳晶, 等. 食品添加剂对食源性金黄色葡萄球菌生物被膜的影响[J]. 食品科学, 2012, 33(17): 154-157.
[10] 施建兵, 谢晶. 复合保鲜方法对鲳鱼保鲜效果及抑菌机理的研究[D]. 上海: 上海海洋大学, 2014.
[11] 刘淑敏, 邵兴锋. 复合生物保鲜剂在水产品保鲜中的应用[J]. 生物技术进展, 2013, 3(6): 408-411, 438.
[12] 李馥君, 翁佩芳, 朱亚珠, 等. 中国毛虾(Acetes chinensis)虾皮复合保鲜剂筛选及保鲜效果的研究[J]. 食品工业科技, 2017, 38(6): 333-338.
[13] 韦何雯. 月桂酸单甘油酯在低温肉制品中的应用研究[D]. 杭州: 浙江大学, 2008: 42-54.
[14] HARA S, YAMAKAWA M. Moricin, a novel type of antibacterial peptide isolated from the silkworm, bombyx mori[J]. Journal of Biological Chemistry, 1995, 270(50): 29 923-29 927.
[15] 翁佩芳, 江华珍, 冯凤琴, 等. 酶标比浊法评价月桂酸单甘油酯对肉葡萄球菌的抑菌活性[J]. 中国食品学报, 2012, 12(5): 188-194.
[16] 沈潇, 孙晓红, 赵勇谢, 等. 蓝莓提取物对及黄色葡萄球菌的抑制作用研究[J]. 天然产物研究与开发, 2012, 24(11): 1 622-1 625.
[17] 刘晓雯, 刘克武, 杨守忠, 等. 大凉疣螈碱性磷酸酶的分离纯化及部分性质[J]. 中国生物化学与分子生物学报, 2001, 17(1): 135-138.
[18] CHEN C Z, COOPER S L. Interactions between dendrimer biocides and bacterial membranes[J]. Biomaterials, 2002, 23(16): 3 359-3 368.
[19] 蓝蔚青, 谢晶, 侯伟峰, 等. 复合生物保鲜剂对腐败希瓦氏菌的抑菌机理[J]. 江苏农业学报, 2012, 28(1): 186-192.
[20] DIAO Wen-rui, HU Qing-ping, ZHANG Hong, et al. Chemical composition, antibacterial activity and mechanism of action of essential oil from seeds of fennel (Foeniculum vulgare Mill)[J]. Food Control, 2014, 35(1): 109-116.

