包装材料及气调贮藏对薄荷保鲜效果的影响
陈 思陈湘宁,2许 丽刘慧君,2徐 娜周 婧
(1. 北京农学院食品科学与工程学院,北京 102206;2. 农产品有害微生物及农残安全检测与控制北京市重点实验室,北京 102206; 3. 北京市农业技术推广站,北京 100029)
薄荷又称留兰香、银丹草,为唇形科薄荷属植物,具有很高的经济价值[1]。目前薄荷作为药食兼用的芳香蔬菜,在中国主要应用于医药卫生、香料和食品工业等领域[2]。薄荷具有多种药性,例如:缓解腹痛(如痉挛等问题)、利尿、止咳化痰、健脾开胃等;小剂量薄荷还有助于睡眠[3]。
气调包装保鲜(Modified atmosphere packaging, MAP)通过调节贮存环境中O2和CO2浓度等条件,有效降低果蔬呼吸强度,延缓营养分解进程;同时MAP可以很好地保持蔬菜的失水率和控制VC流失[4-5],并且在4 ℃贮藏环境下,气调包装还可以控制蔬菜受沙门氏菌感染[6],延长蔬菜货架期。目前中国对于薄荷的研究主要集中在其挥发油的抑菌作用及化学成分方面,国外针对新鲜薄荷的保鲜研究则主要集中于使用保鲜剂延长其货架期,而关于气调环境和包装材料对新鲜薄荷叶保鲜效果的研究相对较少。例如:0.5 mmol/L 水杨酸或1% CaCl2处理后的薄荷失重率降低最为缓慢,0.5 μmoL/L 1-MCP条件下,薄荷的褐变程度明显比未经处理的低,从而使货架期延长[7-8]。与1-MCP相比,气调包装成本较低,无化学污染,Zhang等[9]的研究表明,气调包装对于新鲜薄荷来说是最好的贮存方式,可以更好地保持叶绿素含量,从而保护薄荷颜色。但该研究仅涉及到气调环境对薄荷保鲜效果的影响,未涉及包装材料对薄荷保鲜效果的影响。
本研究不同于以往只研究单因素对薄荷保鲜的影响,而采用不同气体比例、包装材料以及容积比三因素进行正交试验,研究其对新鲜薄荷保鲜效果的影响。每天测定贮藏期内各项指标(失重率、叶绿素含量、亚硝酸盐含量、相对电导率、POD酶活性),对这些数据进行处理和分析,筛选出薄荷贮藏保鲜最适处理方式。
1 材料与方法
1.1 材料与仪器
薄荷:北京裕农优质农产品有限公司;
LDPE(低密度聚乙烯膜)、HDPE(高密度聚乙烯膜)、EVOH/PE(乙烯-乙烯醇共聚物/聚乙烯复合膜):市售;
无水乙醇、无水碳酸钠、丙酮、三氯化铁、抗坏血酸、氢氧化钠、正己烷、氯化钠:分析纯,北京化工厂;
磷酸氢二钠、磷酸二氢钠:分析纯,北京市红星化工厂;
多功能保鲜封口机:DGN-06型,宁波象山绿缘轻工机械制造厂;
紫外可见分光光度计:TU-1810型,北京普析通用仪器有限公司;
离心机:L530型,湖南赫西仪器装备有限公司;
电子天平:AL204型,梅特勒-托利多仪器有限公司;
电导率测定仪:DDS-307A型,雷磁仪器有限公司。
1.2 试验方法
1.2.1 薄荷预处理 选用对生叶片,表皮无明显缺损、烂叶或机械损伤、个体完整的新鲜薄荷;将薄荷置于0 ℃清洗剂(次氯酸钠80 mg/kg,0.5% 柠檬酸)中浸泡3 min,常温下使用蔬菜甩干机脱水(600 r/min)10 s后,立即取出,按表1称量对应重量的薄荷,放入对应的袋子内,待充入对应比例气体后进行封口。

表1 正交试验设计方案
1.2.2 失重率的测定 采用称量法[10]。将第0天薄荷的重量记录初始数据,之后每天称量薄荷的质量,每个样品做3组平行试验。
1.2.3 感官评价标准 参照文献[11]的方法进行。
1.2.4 叶绿素含量的测定 参照文献[12]。
1.2.5 亚硝酸盐含量的测定 按GB 5009.33—2016执行。
1.2.6 相对电导率的测定 参照文献[13]。
1.2.7 过氧化物酶的测定 参照文献[14]。
1.2.8 数据处理 采用 Excel 软件以及SPSS 19.0数据处理系统进行数据差异性检验。
2 结果与分析
2.1 失重率
果蔬在贮藏期内由于呼吸和蒸腾作用导致水分含量逐渐流失,失重率越大品质下降越快[15]。从图1中可以看出,薄荷的失重率在整个贮藏期间呈现上升趋势,N1上升趋势与其他8组相比较为平稳。在第10天时,各组的失重率依次为7.76%,10.14%,9.07%,9.41%,10.58%,10.31%,8.06%,10.60%,8.91%。其中N1薄荷在第14天时,失重率仅为8.57%。结果表明,在N2,N5,N8保存条件下薄荷失水率最高,18号袋可能由于膜的阻隔性较高,导致薄荷进行无氧呼吸,从而出现萎蔫现象。

图1 不同处理条件对薄荷失重率的影响
2.2 感官评价
由图2可知,贮藏期内各处理组的薄荷感官评价均呈现下降趋势,其中N2和N4下降速度最快,在第10天时感官评分仅为2分,低于可接受范围,失去商品价值。并且N9在第12天时感官评分只有2分,低于其他组的。N1下降速度较为缓慢,第8天时评分为7分,延长至12 d后失去感官品质。由此得出,当薄荷容积比较大(25 g)时,从感官指标上看明显受到影响,与N1感官评分具有明显差异(P<0.05)。结果表明,15 g薄荷在O2∶CO2∶N2体积比为6∶9∶85环境下用1号膜进行封装,此组仅从感官上看保鲜效果最好,有效地抑制了薄荷颜色和质地整体上的劣变。
2.3 叶绿素含量
叶绿素是一种不稳定的物质,在储存和加工过程中容易褪色。采后变色可能是由于非最佳的贮存温度、机械损伤、酶促疾病、激素不平衡和乙烯的存在造成的[16]。较高的呼吸速率和代谢活性也可能导致叶绿素降解[17]。如图3所示,各处理组的叶绿素含量在贮藏期内均呈现下降趋势,N5和N6叶绿素含量下降较为迅速,在第10天时已降至较低,分别为0.142,0.139 mg/10 g,且在第10天时叶绿素含量由高到低为:N1>N4>N8>N9>N3>N7>N2>N5>N6,其中N1叶绿素含量显著高于其他组(P<0.05)。结果表明,第10天时,N1和N4可以更好地抑制叶绿素的流失,可能是N1和N4氧气含量较低,进一步抑制了叶绿素含量的流失,与Florence等[18]研究低氧环境对莴苣的保鲜效果一致。
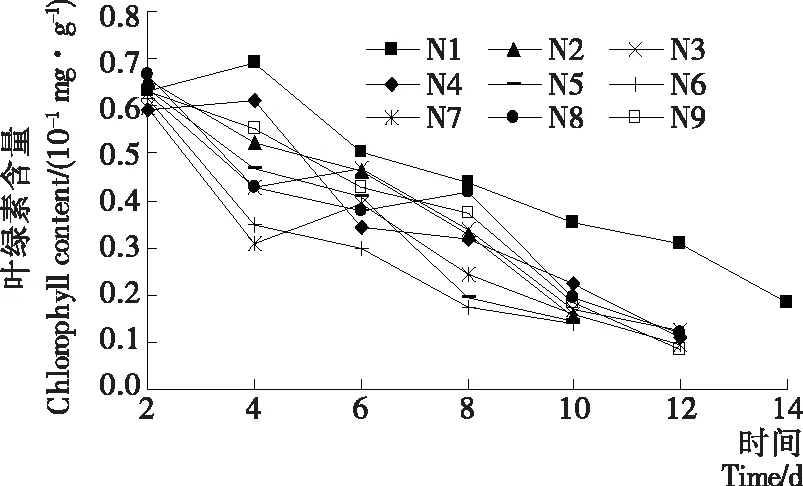
图3 处理条件对薄荷叶绿素的影响
2.4 亚硝酸盐含量
亚硝酸盐是蔬菜测定指标中重要的指标之一,摄入过多的硝酸盐和亚硝酸盐时,会增加人体患癌的概率[19]。因此,硝酸盐和亚硝酸盐含量的减少及控制是蔬菜安全主要问题之一。图4表明,各处理组的亚硝酸盐含量在贮藏期内均呈上升趋势,并且相差不大。N1薄荷维持了较高的叶绿素含量和感官品质,延缓了薄荷在贮藏期内亚硝酸盐含量峰值的出现。其中N9的亚硝酸盐含量上升较为迅速,在第12天时已达1.439 mg/kg,N1亚硝酸盐含量上升速度较为缓慢,在第12天时仅为0.893 mg/kg,明显低于其他组(P<0.05)。在第14天时N1亚硝酸盐含量也仅有0.984 mg/kg。因此采用N1的处理方式。
2.5 相对电导率
相对电导率与植物组织细胞膜完整性与衰老程度密切相关,当细胞膜受损时,细胞膜的选择透过性功能减弱,细胞内物质可自由通过,导致相对电导率增大[20]。由图5可知,经过处理后的薄荷相对电导率基本呈上升趋势,其中N3、N7和N9在第12天时上升幅度明显增大,N1组上升较为平缓,并与其他组差异显著(P<0.05)。结果表明,由于7号包装袋的阻隔性差,袋内气体比例与空气相差不多,保鲜效果不明显,因此薄荷的相对电导率相比其他组上升幅度较大,且数值最高(N3和N9);N1处理条件下相对电导率上升最为平稳。

图4 处理条件对薄荷亚硝酸盐含量的影响

图5 处理条件对薄荷相对电导率的影响
2.6 POD酶活性
POD酶(过氧化物酶)是参与植物褐变过程中非常重要的一种酶,在植物衰老过程中,由于H2O2积累的反应,导致POD酶活性升高[21]。如图6所示,在贮藏期间,薄荷中POD酶活性整体呈上升趋势,第12天时薄荷酶活性顺序为:N1>N4>N3>N7>N9>N8,其中N1为154.31 U/g,N8仅为96.24 U/g。结果表明,在低氧条件下使用1号包装袋进行封装可以更好地维持活性氧代谢平衡,保护膜结构,从而延长薄荷货架期。

图6 处理条件对薄荷POD酶活性的影响
3 结果
本试验研究了不同气体比例,不同包装材料以及不同容积比三者正交对薄荷保鲜效果的影响,结果表明:N1能有效保持薄荷良好的感官品质,保持薄荷气味清新,并有效地避免贮藏期内薄荷的失水、蔫萎等现象,将有效期延长至14 d;N3、N4、N7、N8和N9的薄荷在12 d天时腐坏严重;而N2、N5和N6在第10天时已经失去商品价值。18号袋(EVOH/PE)由于阻隔性高,导致薄荷无氧呼吸,从而失水率较高,加速萎蔫;7号袋(LDPH)由于透气透氧较高,阻隔性较差导致薄荷的细胞损坏程度变大,从而相对电导率上升速度更快。然而较大容积比仅对薄荷的感官评分有影响,对其他指标并无太大影响。由此可见,当薄荷处于较低的氧气含量,透气透水性适中(HDPE)的包装膜和较少的容积比时,薄荷的叶绿素含量最高,失重率最低,延缓薄荷中亚硝酸盐的累积和相对电导率的上升,并且保持了较高的POD酶活性。
由于薄荷经济效益高,且不易保存,因此采用气调保鲜效果好,成本低,降低经济损失;搭配包装袋进行保鲜在运输过程中更便于贮藏,达到更安全、高效、应用性广的效果;因此气调包装对蔬菜的保鲜需要更深入的研究,从而推动蔬菜保鲜产业的进一步发展。
[1] 周荣, 钟震洪. 薄荷在我国的研究进展[J]. 广东农业科学, 2010, 37(9): 93-95.
[2] 施京敏. 薄荷的化学成分及采收加工的研究概况[J]. 中国当代医药, 2011, 18(33): 15-16.
[3] 彭蕴茹, 钱士辉, 石磊, 等. 薄荷非挥发性提取部位的药理活性研究[J]. 中药材, 2008(1): 104-107.
[4] PAILLART M J M, J M B M VAN DER VOSSEN, LEVIN E, et al. Bacterial population dynamics and sensorial quality loss in modified atmosphere packed fresh-cut iceberg lettuce[J]. Postharvest Biology and Technology, 2017, 124: 91-99.
[5] HOREV B, SELA S, VVINOKUR Y, et al. The effects of active and passive modified atmosphere packaging on the survival of Salmonella enterica serotype Typhimurium on washed romaine lettuce leaves[J]. Food Research International, 2012, 45(2): 1 129-1 132.
[6] KAKIOMENOU K, TASSOU C, NYCHAS G J. Survival of Salmonella enteritidis and Listeria monocytogenes on salad vegetables[J]. World Journal of Microbiology and Biotechnology, 1998, 14(3): 383-387.
[7] DAVID K, DANIEL C, ZION A, et al. The effect of CO2and 1-methylcyclo-propene on the regulation of postharvest senescence of mint, Mentha longifolia L[J]. Postharvest Biology and Technology, 2007, 43: 165-173.
[8] YOUSEFIZAD L, TIL R F, GHANBARI F. Effectiveness of CaCl2, Peppermint Oil and Salicylic Acid Treatments on Shelf Life Extension of Fresh Mint during Cold Storage[J]. Journal of Food Processing and Preservation, 2015, 39(6): 2 639-2 646.
[9] ZHANG Chao, LI Yun-fei, WANG Yu-bin, et al. Effect of packaging on quality and flavor of fresh-cut mint[J]. International Conference on Information Technology in Medicine and Education, 2015: 460-463.
[10] MPHAHLELE R R, FAWOLE O A, OPARA U L. Influence of packaging system and long term storage on physiological attributes, biochemical quality, volatile composition and antioxidant properties of pomegranate fruit[J]. Scientia Horticul-turae, 2016, 211: 140-151.
[11] RIZZO V, MURATORE G. Effects of packaging on shelf life of fresh celery[J]. Journal of Food Engineering, 2009, 90(1): 124-128.
[12] FAN Hong-mei, WANG Xiao-wen, SUN Xia, et al. Effects of humic acid derived from sediments on growth, Photosynthesis and chloroplast ultrastructure in chrysanthemum[J]. Scientia Horticulturae, 2014, 177 : 118-123.
[13] AGUERO M V, PONCE A G, MOREIRA M R, et al. Lettuce quality loss under conditions that favor the wilting phenomenon[J]. Postharvest Biology and Technology, 2011, 59(2): 124-131.
[14] CHEN Xiang-ning, REN Lu-pei, LI Meng-lin, et al. Effects of clove essential oil and eugenol on quality and browning control of fresh-cut lettuce[J]. Food Chemistry, 2017, 214: 432-439.
[15] LUO Jiang, WANG Xin-xiao, XU Quan-ming, et al. Comprehensive evaluation of six summer stubble lettuce varieties in Beijing[J]. Journal of Beijing University of Agriculture, 2016, 31(2): 50-52.
[16] FERRANTE A, INCROCCI L, SERRA G. Quality changes during storage of fresh-cut or intact Swiss chard leafy vegetables[J]. Journal of Food Agriculture and Environment, 2008, 6(3/4): 60-62.
[17] CURUTCHET A, DELLACASSA E, RINGUELET J A, et al. Nutritional and sensory quality during refrigerated storage of fresh-cut mints (Mentha×piperita and M. spicata)[J]. Food Chemistry, 2014, 143: 231-238.
[18] CHARLES F, GUILLAUME C, GONTARD N. Effect of passive and active modified atmosphere packaging on quality changes of fresh endives[J]. Postharvest Biology and Technology, 2008, 48(1): 22-29.
[19] 高秀瑞, 刁春英, 张春锋, 等. 低温贮藏对3种蔬菜亚硝酸盐含量的影响[J]. 河北农业科学, 2011,15(8): 65-68.
[20] WANG Qing, DING Tian, ZUO Jin-hua, et al. Amelioration of postharvest chilling injury in sweet pepper by glycine betaine[J]. Postharvest Biology and Technology, 2016, 112: 114-120.
[21] LI Tie-hua, ZHANG Min. Effects of modified atmosphere package (MAP) with a silicon gum film window and storage temperature on the quality and antioxidant system of stored Agrocybe chaxingu[J]. LWT-Food Science and Technology, 2010, 43(7): 1 113-1 120.

