牡丹籽油乙醇辅助水酶法提取工艺优化及品质分析
宋媛媛杨瑞金张文斌赵 伟华 霄
(1. 江南大学食品学院,江苏 无锡 214122;2. 江南大学食品科学与工程国家重点实验室,江苏 无锡 214122)
牡丹(PaeoniasuffruticosaAndr.)属芍药科芍药属牡丹组,原产于中国西部秦岭和大巴山一带山区,为多年生落叶小灌木[1]。牡丹籽含油量29%~34%,含蛋白18%~22%,营养价值很高[2-3]。其中牡丹籽油富含不饱和脂肪酸,主要为亚麻酸和亚油酸。作为人体的必需脂肪酸,亚麻酸和亚油酸具有降低血脂、预防心脑血管疾病和动脉粥样硬化的效用[4-6],因此牡丹籽油作为一种富含亚麻酸的植物油,具有很高的开发价值。对牡丹籽油的毒理学研究[7]表明,牡丹籽油无急性毒性、遗传毒性和亚急性毒性,具有很高的食用安全性。2011年3月22日,卫生部《卫生部关于批准元宝枫籽油和牡丹籽油作为新资源食品的公告》(2011年第9号)批准牡丹籽油为新资源食品。牡丹籽油正式进入了食用油的行列。
目前牡丹籽油的提取方法主要有压榨法、溶剂浸出法、超临界CO2萃取法以及水酶法。压榨法提油的技术应用较早,不断改良后,目前已经非常成熟,但其出油率低、能耗高,饼粕残油量高。易军鹏等[8]比较了超声波提取和机械压榨法对牡丹籽油得率及其品质的影响,结果显示机械压榨法牡丹籽油得率仅为18.56%,且外观性状和稳定性较差。溶剂浸出法出油率高,工业应用也十分广泛,但存在试剂残留的安全性问题。孙明哲等[9]通过超声波辅助石油醚浸提牡丹籽油,在优化条件下牡丹籽油平均得率为26.76%,GC分析结果显示牡丹籽油含有丰富的多不饱和脂肪酸。超临界CO2萃取法虽然无毒无害无残留,但设备昂贵,生产成本高,工业化应用受到极大限制。史国安等[10]采用超临界CO2萃取牡丹籽油,结果表明牡丹籽出油率达28.86%,且牡丹籽油的抗氧化性优于压榨法。水酶法是一种安全无污染的提油方法,操作简单,条件温和,能较好地保护油的品质,具有良好的开发前景[11],而且在提油的同时可以得到蛋白和活性肽,对油料综合利用方面意义重大。目前,有较多研究采用水酶法提取牡丹籽油,如张正周等[12]研究了5种酶(纤维素酶、果胶酶、α-淀粉酶、中性蛋白酶和碱性蛋白酶)的酶解对牡丹籽出油率的影响,在最优条件下,牡丹籽出油率达19.08%;李静等[13]筛选出了碱性蛋白酶作为水酶法萃取牡丹籽油的最佳酶制剂,经过工艺优化,牡丹籽出油率达23.25%;彭瑶瑶等[14]采用三步酶解、二次破乳的方法,将水酶法提取的牡丹籽油得率提高到25.4%。然而,从现有研究中可以发现,水酶法发展至今仍存在瓶颈[15-16]。首先,获得的油脂是游离油和乳状液的混合物,所以需要对乳状液进行破乳,而这种乳状液是一种高度稳定的水包油状态,很难完全破碎[17]。其次,水解细胞壁需要很长时间。此外,大量酶的使用导致生产成本较高。
为解决传统水酶法提取时间长、生产成本高等问题,本试验拟应用乙醇水溶液辅助酶解提取牡丹籽油,研究确定该工艺下提取牡丹籽油的最佳酶用量、乙醇体积分数、粒径等条件,同时利用激光共聚焦显微镜分析预处理对牡丹籽的影响,旨在提高牡丹籽油得率的同时降低生产成本、缩短生产周期、保证油品质量,并且借助乙醇极强的破乳能力,解决破乳困难的问题,从而为牡丹籽的开发利用提供技术支持。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
牡丹籽:凤丹,产自甘肃;
商品油A:压榨油,A厂家生产;
商品油B:超临界萃取油,B厂家生产;
中温α-淀粉酶(480 L型)、葡糖淀粉酶(360 L型):诺维信有限公司;
其他常规试剂:AR级,国药集团化学试剂有限公司。
1.1.2 主要仪器设备
立式压力蒸汽灭菌锅:LDZX-50KBS型,上海申安医疗机械厂;
摇摆式高速中药粉碎机:DFY-500型,浙江林大机械公司;
低速离心机:LXJ-IIB型,上海安亭仪器厂;
自动脂肪测定仪:SZC-101型,上海纤检仪器公司;
激光粒度分析仪:S3500型,美国Microtrac公司;
旋转蒸发仪:RV 10型,德国IKA公司;
气相色谱仪:GC-2010PPLUS型,日本岛津公司;
激光共聚焦显微镜:LSM 710型,德国蔡司公司。
1.2 方法
1.2.1 牡丹籽油的提取工艺
牡丹籽→脱壳→酸热预处理→过滤→烘干→粉碎→酶解→乙醇水溶液提取→离心→冷冻破乳→清油
酸热预处理参考文献[18]修改如下:取700 g脱壳牡丹籽加入到5 L烧杯中,按料液比1∶5 (g/mL)加入0.05 mol/L的柠檬酸溶液,于灭菌锅110 ℃处理0~1 h后过滤,将过滤后的牡丹籽置于60 ℃烘箱烘干5 h。
对烘干的牡丹籽进行粗粉,15 s/次,粉碎4次,再进行精粉,通过控制粉碎次数得到不同粉碎程度的样品。粉碎后的牡丹籽经两步酶解、一步乙醇水溶液提取得到牡丹籽油。反应结束后于5 000 r/min离心15 min得到油相、乳状液相、水相和渣相。收集各相并称重。乳状液于-20 ℃冷冻破乳,合并清油,按式(1)计算清油得率。
(1)
式中:
c——清油得率,%;
m——清油质量,g;
w——原料重量,g;
F——原料中单位质量的脂肪含量,%。
水相含油量表征:采用Rose-Gottlieb法测定水相中单位质量的脂肪含量,按式(2)计算含油量。
(2)
式中:
c1——水相含油量,%;
w1——水相质量,g;
F1——水相中单位质量的脂肪含量,%;
w——原料重量,g;
F——原料中单位质量的脂肪含量,%。
渣相含油量表征:湿渣烘干后采用GB/T 5512—2008测定单位质量的脂肪含量,按式(3)计算含油量。
(3)
式中:
c2——渣相含油量,%;
w2——渣相质量,g;
F2——渣相中单位质量的脂肪含量,%;
w——原料重量,g;
F——原料中单位质量的脂肪含量,%。
1.2.2 牡丹籽油的简单精炼
脱酸→水洗→脱色→脱水→精炼油
脱酸:称取由式(4)计算得到的NaOH量,配制成20%的水溶液加入油中,在70 ℃下搅拌30 min,离心得到脱酸油。
(4)
式中:
M——加碱量,g;
VA——毛油的酸价(以KOH计),mg/g;
G——毛油质量,g。
脱色:向油中添加1%的活性白土,常温搅拌30 min,抽滤2次。
脱水:将脱色油在60 ℃下,转速30 r/min,真空旋转蒸发2 h,得到精炼油。
1.2.3 分析方法
(1) 牡丹籽成分分析:水分按GB 5009.3—2010执行;脂肪按GB/T 5539—2008执行;蛋白质按GB/T 5009.5—2010凯氏定氮法执行;淀粉按GB/T 5514—2008执行;粗纤维按GB/T 5515—2008执行;灰分按GB 5009.4—2016执行。
(2) 激光共聚焦显微镜分析:样品的固定方法参照Campbell等[19]的进行。尼罗红和FITC被选为荧光染料,使用10×和20×的物镜进行观察。
(3) 粒径分析:取不同粉碎程度的牡丹籽粉约0.1 g置于10 mL离心管中,加入8 mL去离子水,室温条件下,漩涡振荡1 min,混匀。滴加样品至激光粒径分析仪样品池中,测定其体积平均粒径。
(4) 牡丹籽油品质分析:根据牡丹籽油的粮食行业标准(LS/T 3242—2014)测定指标。其中溶剂残留量即乙醇残留量。取水酶法提取的牡丹籽毛油于旋蒸瓶中,于60 ℃以30 r/min 的转速旋转,0~150 min内每隔段时间取5.00 g于汽化瓶内,立即密封,于4 ℃备用。参照文献[20]采用顶空气相色谱测定乙醇残留量。
1.2.4 工艺优化方案 以牡丹籽油清油、水相和渣相含油量为评价指标,分别探究物料粒径、中温α-淀粉酶和葡糖淀粉酶加酶量以及乙醇体积分数对评价指标的影响。
(1) 物料粒径:取5份200 g牡丹籽粗粉,取4份牡丹籽细粉6~9次,测定不同粉碎程度的物料粒径。各取40.00 g不同粉碎程度的牡丹籽采用料液比1∶7 (g/mL),通过中温α-淀粉酶(70 ℃,pH 5.5,加酶量2 mL/100 g·原料,反应时间1 h)和葡糖淀粉酶(60 ℃,pH 4.5,加酶量2 mL/100 g·原料,反应时间1 h)酶解,再用体积分数为35%的乙醇水溶液提取(60 ℃,pH 9.0,反应时间1 h)得到清油。于5 000 r/min离心15 min。离心后测定脂肪含量,以换算到总油百分比。
(2) 中温α-淀粉酶加酶量和葡糖淀粉酶加酶量:在确定的粉碎粒径下,调整中温α-淀粉酶和葡糖淀粉酶的加酶量分别为1,2,3,4,5 mL/100 g·原料。其他条件同1.2.4(1)。
(3) 乙醇体积分数:在确定的粉碎粒径以及中温α-淀粉酶加酶量和葡糖淀粉酶加酶量条件下,调整乙醇体积分数为0%,15%,25%,35%,45% 5个水平。其他条件同1.2.4(1)。
1.2.5 数据分析 试验数据均表示为平均值±标准偏差(n=3)。采用Origin 8.6软件作图,通过SPSS 17.0进行ANOVA分析评估显著性差异。
2 结果与分析
2.1 牡丹籽主要成分
由表1可知,牡丹籽中粗脂肪含量最高为31.04%,是一种良好的油料作物。蛋白质和淀粉含量次之,分别为21.39% 和13.78%。其中淀粉含量较高,淀粉是一种大分子物质,水解成糊精后会包裹油分子,使其不能游离出来[21],对油的提取产生一定影响。

表1 牡丹籽的主要成分及含量
2.2 激光共聚焦显微镜分析
分别对110 ℃酸热处理10,30,60 min的牡丹籽样品进行激光共聚焦显微镜分析,其20×物镜下的观察图像见图1。10 min处理下的牡丹籽细胞结构饱满完整,细胞排列紧密,可以看出油仍被蛋白质包裹。30 min处理下的牡丹籽细胞由于失水出现明显皱缩,虽然细胞结构仍然完整,但可观察到油脂体聚合。经过60 min的酸热处理,部分细胞结构被破坏,油脂体冲出蛋白质的包裹范围,聚集成较大油滴,有利于油脂的提取。当对牡丹籽进行更长时间的酸热处理时,发现牡丹籽发生严重的软化,导致过滤时原料损失。因此,综合考虑成本、能耗等因素,选择110 ℃酸热处理1 h作为乙醇辅助水酶法提取牡丹籽油的预处理条件。
2.3 水酶法提取牡丹籽油的工艺优化
2.3.1 粉碎程度对牡丹籽油得率的影响 物料的粉碎粒径越小,油脂提取率越高[22-23]。原因是物料粉碎粒径小于本身细胞大小时,细胞壁被充分破坏,细胞内油脂易于溶出,同时细胞与提取介质的接触面积扩大。粉碎粒径过大时,则会有更多的油进入渣相中。
Figure 1 Microstructure of peony seeds under different time of acid-heat pretreatment
不同粉碎程度的牡丹籽平均粒径与三相油含量分布的关系见图2。仅经过粗粉的牡丹籽粉平均粒径为130.47 μm,清油得率仅为66.65%,渣相含油量高达20.46%。随着细粉次数增加,样品平均粒径越来越小,当细粉次数达到8次时,牡丹籽粉的平均粒径已经降低为33.62 μm,结合图1结果表明此时粒径已小于细胞大小,清油得率为90.01%,渣相含油量仅为3.09%。再增加细粉次数,清油得率不再显著变化(P>0.05),此时粉碎粒径不再是限制提油的关键因素。综合考虑选择细粉8次作为粉碎程度的较优条件。

不同字母表示差异显著(P<0.05)
2.3.2 中温α-淀粉酶和葡糖淀粉酶的加酶量对牡丹籽油得率的影响 预试验得知中温α-淀粉酶的最适作用条件为温度70 ℃,pH 5.5,且作用1 h后对提油率无显著变化;葡糖淀粉酶的最适作用条件为温度60 ℃,pH 4.5,反应时间1 h。
表1表明牡丹籽淀粉含量较高,淀粉作为一种大分子物质,在溶液中部分水解成糊精,从而包裹油分子,抑制其游离释放。Mcglone等[24]研究水酶法提取椰子油时得出淀粉酶对油的提取有促进作用。同时,加入葡糖淀粉酶会将被淀粉酶水解后的小分子糖水解为葡萄糖,减小了对油的包裹作用,利于油脂提取。
由图3、4可以看出,牡丹籽清油得率均呈现先增高后降低的趋势。其原因在于加酶量较少时,酶解不完全,大部分油脂仍存在于物料中,或被大分子蛋白和淀粉包裹不易游离;而加酶量过多时,酶分子间会产生竞争作用,反而降低了酶的作用效率[25]。当加入2 mL/100 g·原料的中温α-淀粉酶和3 mL/100 g·原料的葡糖淀粉酶于体系中时,清油得率最高为91%左右,渣相油含量可降低至2.5%左右,对油脂的释放作用达到最优。因此确定中温α-淀粉酶和葡糖淀粉酶的加酶量分别为2 mL/100 g原料和3 mL/100 g·原料。
2.3.3 乙醇体积分数对牡丹籽油得率的影响 预试验得知乙醇水溶液提取牡丹籽油的最适温度为60 ℃,pH为9.0,反应时间为1 h。如图5所示,清油得率随乙醇体积分数的上升显著(P<0.05)提高,渣相含油量显著(P<0.05)减小,水相含油量变化趋于稳定。未使用乙醇水溶液时,清油得率仅为74.21%,渣相含油量6.93%;当乙醇体积分数为35%时,清油得率达到最大(90.08%),渣相含油量仅为2.78%。表明乙醇水溶液在提油过程中起到了极大的促进作用。这是因为乙醇易溶于水,加入后通过分子运动扩散到油水界面[26],其强亲水性导致蛋白质的界面性质改变,乙醇对形成界面膜的表面活性分子的亲水端形成吸附力[27],可以有效破坏界面膜的稳定性,促使小油滴聚集,从而提高清油得率;此外,乙醇属有机溶剂,相似相溶使油脂溶解度增大,促进极性物质的溶出[28],导致渣相含油量下降。但是高浓度乙醇溶液会从物料中提取出胶质和多糖,也会增加回收乙醇的能耗[29]。因此选择体积分数35%的乙醇辅助提取牡丹籽油。

不同字母表示差异显著(P<0.05)
Figure 3 Effects of the medium temperatureα-amylase dosage on oil distribution in three phases

不同字母表示差异显著(P<0.05)

不同字母表示差异显著(P<0.05)
2.4 牡丹籽油品质分析
2.4.1 牡丹籽油的乙醇残留 如图6所示,随旋转蒸发时间的延长,乙醇含量下降呈先快后慢的趋势。未旋蒸前毛油中的乙醇残留量较高,达329.7 mg/kg,当旋蒸时间延长至120 min 时,乙醇残留量下降到6.84 mg/kg,低于牡丹籽油的粮食行业标准。因此,在60 ℃下旋转蒸发120 min可除去油中的大部分乙醇。
2.4.2 牡丹籽油的品质指标 乙醇辅助水酶法制备的牡丹籽毛油和精炼油及商品油A、B的品质指标见表2、3。通过与牡丹籽油的粮食行业标准比较,可以看出,水酶法油与2种商品油的特征指标无显著差异,且均符合标准。其中脂肪酸组成相近,说明乙醇辅助水酶法及其精炼步骤对脂肪酸组成的影响非常小。

不同字母表示差异显著(P<0.05)
乙醇辅助水酶法制备的牡丹籽毛油和精炼油与商品油的色泽和透明度比较接近,但提取的牡丹籽油经过简单精炼后,酸价低于2种商品油,原因可能在于提取过程中经过了热处理,使牡丹籽中的脂肪酶钝化,减少了甘油三酯生成游离脂肪酸的含量。同时乙醇辅助水酶法制备的牡丹籽油的过氧化值显著低于商品油,可能是因为其工艺作用条件温和,得到的牡丹籽毛油质量较好,只需进行简单的精炼步骤,避免了过氧化值的快速升高。

表2 牡丹籽油的特征指标†
† 同列不同字母代表差异显著(P<0.05)。
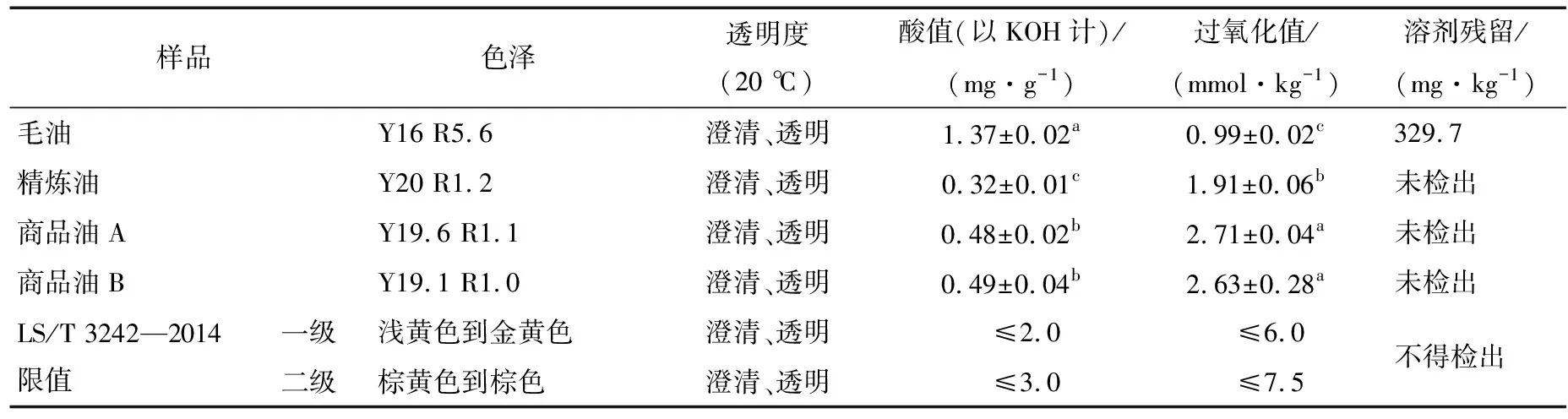
表3 牡丹籽油的质量指标†
† 同列不同字母代表差异显著(P<0.05)。
3 结论
水酶法是一种绿色环保的新型油脂提取方法,可用于提取牡丹籽油。采用激光共聚焦微观结构分析得出适当的酸热预处理有利于细胞结构的破坏、油脂的释放和提取过程的进行。乙醇辅助水酶法提取牡丹籽油的优化条件为:加入料液比1∶5 (g/mL)的0.05 mol/L的柠檬酸溶液110 ℃下处理1 h,物料粉碎8次(粒径为33.62 μm),分别用中温α-淀粉酶(温度70 ℃,pH 5.5,时间1 h,加酶量2 mL/100 g·原料)和葡糖淀粉酶(温度60 ℃,pH 4.5,时间1 h,加酶量3 mL/100 g·原料)酶解,再于60 ℃、pH 9.0的条件下用体积分数35%的乙醇提取1 h。在该条件下,牡丹籽清油得率为(90.08±0.04)%,水相含油量为(6.60±0.35)%,渣相含油量为(2.78±0.26)%。
乙醇辅助水酶法提取的牡丹籽毛油品质优良,经过简单精炼后的牡丹籽油各项指标均达到一级成品牡丹籽油的粮食行业标准,表明水酶法在牡丹籽油的提取和应用方面具有广阔的发展前景。但应注意到,在乙醇辅助水酶法的工艺中采用的料液比较高,因此水相重量大,下一步应注重对水相甚至渣相的利用,以期达到高效综合利用的目的。此外,近年来,研究者更多地将水酶法应用于低油料作物中,因此选择合适的预处理方法破坏细胞结构、使油脂释放,成为了提高油脂提取率的一个重要因素。
[1] 洪德元, 潘开玉. 芍药属牡丹组的分类历史和分类处理[J]. 植物分类学报, 1999, 37(4): 351-368.
[2] 周海梅, 马锦琦, 苗春雨, 等. 牡丹籽油的理化指标和脂肪酸成分分析[J]. 中国油脂, 2009, 34(7): 72-74.
[3] 易军鹏, 朱文学, 马海乐, 等. 牡丹籽油超声辅助提取工艺优化及其GC-MS分析[J]. 食品工业科技, 2009(8): 198-201.
[4] DE LORGERIL M, RENAUD S, SALEN P, et al. Mediterranean alpha-linolenic acid-rich diet in secondary prevention of coronary heart disease[J]. The Lancet, 1994, 343(8 911): 1 454-1 459.
[5] GOODNIGHT S H, HARRIS W S, CONNOR W E, et al. Polyunsaturated fatty acids, hyperlipidemia, and thrombosis[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 1982, 2(2): 87-113.
[6] COLLA L M, MUCCILLO-BAISCH A L, COSTAJ A V. Spirulina platensis effects on the levels of total cholesterol, HDL and triacylglycerols in rabbits fed with a hypercholesterolemic diet[J]. Brazilian Archives of Biology and Technology, 2008, 51(2): 405-411.
[7] 朱文学, 李欣, 刘少阳, 等. 牡丹籽油的毒理学研究[J]. 食品科学, 2010(11): 248-251.
[8] 易军鹏, 朱文学, 马海乐, 等. 牡丹籽油超声波辅助提取工艺的响应面法优化[J]. 农业机械学报, 2009, 40(6): 103-110.
[9] 孙明哲. 牡丹籽油超声波辅助浸提工艺优化及其脂肪酸组成[J]. 食品与机械, 2014, 30(4): 182-185.
[10] 史国安, 郭香凤, 金宝磊, 等. 牡丹籽油超临界CO2萃取工艺优化及抗氧化活性的研究[J]. 中国粮油学报, 2013, 28(4): 47-50.
[11] FANG Xue-zhi, FEI Xue-qian, SUN Hong, et al. Aqueous enzymatic extraction and demulsification of camellia seed oil (Camellia oleifera Abel.) and the oil’s physicochemical properties[J]. European Journal of Lipid Science and Technology, 2016, 118(2): 244-251.
[12] 张正周, 张驰松, 郑旗, 等. 油用牡丹籽油水酶法提取工艺的研究[J]. 农业与技术, 2016, 36(3): 30-32.
[13] 李静. 牡丹籽油制备工艺及其稳定性研究[D]. 吉首: 吉首大学, 2014: 27-36.
[14] 彭瑶瑶, 王千千, 王爱梅, 等. 水酶法提取牡丹籽油的研究[J]. 中国油脂, 2014(6): 12-17.
[15] 陈选, 周波, 汪周俊, 等. 水酶法制备牡丹籽油的研究进展[J]. 食品与机械, 2015, 31(6): 246-250.
[16] 杨瑞金, 倪双双, 张文斌, 等. 水媒法提取食用油技术研究进展[J]. 农业工程学报, 2016, 32(9): 308-314.
[17] CAMPBELL K A, GLATZ C E, JOHNSON L A, et al. Advances in Aqueous Extraction Processing of Soybeans[J]. Journal of the American Oil Chemists Society, 2011, 88(4): 449-465.
[18] 钱志娟, 王璋, 许时婴, 等. 玉米胚芽水酶法提油及蛋白质的回收[J]. 无锡轻工大学学报, 2004, 23(5): 58-62.
[19] CAMPBELL K A, GLATZ C E. Mechanisms of aqueous extraction of soybean oil[J]. Journal of Agricultural and Food Chemistry, 2009, 57(22): 10 904-10 912.
[20] 孙红. 水相法提取亚麻籽油与蛋白质的研究[D]. 无锡: 江南大学, 2015: 20-37.
[21] 彭瑶瑶. 牡丹籽油脂和蛋白的提取、精制和性能研究[D]. 无锡: 江南大学, 2014: 18-22.
[22] ROSENTHAL A, PYLE D L, NIRANJAN K. Simultaneous aqueous extraction of oil and protein from soybean: mechanisms for process design[J]. Food and Bioproducts Processing, 1998, 76(4): 224-230.
[23] YUSOFF M M, GORDON M H, NIRANJAN K. Aqueous enzyme assisted oil extraction from oilseeds and emulsion de-emulsifying methods: a review[J]. Trends in Food Science & Technology, 2015, 41(1): 60-82.
[24] MCGLONE O C, CANALES A L M, CARTER J V. Coconut oil extraction by a new enzymatic process[J]. Journal of Food Science, 1986, 51(3): 695-697.
[25] ZHANG Shao-bin, WANG Zhang, XU Shi-ying. Optimization of the aqueous enzymatic extraction of rapeseed oil and protein hydrolysates[J]. Journal of the American Oil Chemists’ Society, 2007, 84(1): 97-105.
[26] 迟延娜, 张文斌, 杨瑞金, 等. 顽固乳状液的破乳处理提高花生游离油提取率[J]. 农业工程学报, 2014, 30(8): 257-264.
[27] 倪双双. 蒸汽闪爆辅助乙醇水提法提取玉米胚芽油和蛋白质[D]. 无锡: 江南大学, 2016: 18-28.
[28] OOMAH B D. Processing of flaxseed fiber, oil, protein, and lignan[J]. Flaxseed in Human Nutrition, 2003, 2: 363-386.
[29] 刘大川, 余华峰. 乙醇浸提紫苏籽压榨饼中油脂的工艺[J]. 农业工程学报, 2008, 24(11): 242-246.

