大豆分离蛋白肽-硒螯合物的制备及结构、抗氧化活性研究
张馨元 徐梁棕 汪少芸
(福州大学生物科学与工程学院,福建 福州 350108)
大豆分离蛋白(SPI)由于其均衡的营养价值已被广泛应用于食品加工工业中[1]。硒是一种人体必需的微量元素,具有抑制肿瘤细胞增长、预防癌症、延缓衰老、提高机体免疫力、防止克山病以及大骨节病等多种生理功能[2]。由于人体无法自身合成硒元素,故对于缺硒人群,食物补硒非常重要,而亚硒酸盐或硒酸盐等无机硒因其毒性大、用量控制难无法直接添加至食品中,通常将其转化为安全性高的有机硒。
目前已有碱性蛋白酶酶解的大豆多肽-硒螯合物的制备工艺及抗氧化性的研究[3],但未对制备所得的肽-硒螯合物结构进行表征,也未对螯合物在油脂体系中的抗氧化活性进行探究。本研究拟在蛋白酶的选择及优化方法上加以改进,选择能够抑制苦味肽生成的复合风味蛋白酶对SPI进行酶解,改善酶解肽风味,并对多肽螯合物的结构进行表征,且进一步对其在脂质体系的过氧化能力进行研究,挖掘其在脂质体系的应用潜力,旨在为有机硒补充剂的制备及应用提供理论依据。
1 材料与方法
1.1 原料与试剂
大豆分离蛋白:纯度91.6%,福建圣农食品有限公司;
复合风味蛋白酶:2.0×105U/g,诺维信(中国)生物技术有限公司;
3,3′-二氨基联苯胺:分析纯,上海麦克林生化科技有限公司;
亚硒酸钠:分析纯,成都西亚化工股份有限公司;
其他试剂均为分析纯。
1.2 仪器与设备
电子天平:AG264型,瑞士Mettler公司;
数显PH计:FZ20型,梅特勒-托利多仪器上海有限公司;
电热水浴锅:DK-S28型,上海精密试验设备有限公司;
井式消化炉:KDN-16型,郑州长城科工贸公司;
紫外可见分光光度计:752型,上海光谱仪器有限公司;
冷冻干燥机:FD-1C-50型,北京博医康试验仪器有限公司;
荧光光谱仪:970CRT型,上海精密科学仪器有限公司。
1.3 试验方法
1.3.1 大豆分离蛋白肽-硒螯合物制备工艺流程
大豆分离蛋白粉→称量→加蒸馏水→90 ℃水浴预热→调节pH→加酶→一定温度水浴酶解→灭酶(沸水,10 min)→离心(8 000 r/min,15 min)→取多肽上清液与亚硒酸钠溶液混合→调节pH→水浴加热→冷却→离心(1 000 r/min,10 min)→取上清液→乙醇沉降(加9倍体积的无水乙醇)→离心(8 000 r/min,10min)→收集沉淀物→醇洗涤沉淀3次→去除沉淀物中酒精→复溶→冻干
1.3.2 指标测定
(1) 水解度的测定:采用甲醛滴定法[4]。
(2) 硒含量和螯合力的测定:采用3,3′-二氨基联苯胺比色法[5]。
(3) 吸收光谱测定:配置50 μg/mL的大豆分离蛋白肽和大豆分离蛋白肽-硒螯合物溶液,取体积为3 mL的样品溶液于石英比色皿中,将波长设置为190~500 nm,进行紫外光谱扫描。重复扫描3次。
(4) 荧光光谱测定:配置0.1 mg/mL的大豆分离蛋白肽和大豆分离蛋白肽-硒螯合物溶液,取3 mL置于比色皿中,进行荧光光谱扫描。仪器的扫描条件是激发波长290 nm,发射波长的扫描范围设置为300~500 nm,发射光与激发光缝宽均设为5 nm,灵敏度为3,采用高速扫描。
(5) 羟基自由基清除活力的测定:采用水杨酸法[6]。
(6) 还原力的测定:参照文献[7]。
(7) 金属螯合活力的测定:参照文献[8]。
(8) 脂质过氧化抑制活性的测定:参照Osawa等[9]方法,修改如下:取浓度为1 000 μg/mL不同待测液1 mL于具塞比色管中,加入2 mL 95%乙醇、26 μL亚油酸及2 mL磷酸盐缓冲液(50 mmol/L、pH 7.0),充分混匀后,密闭放在暗处并保持40 ℃恒温。空白组用1 mL蒸馏水代替样品。每24 h测定一次体系过氧化程度。
1.3.3 大豆分离蛋白酶解条件优化 选用复合风味蛋白酶,在预试验(以螯合力为主要指标,水解度为次要指标)基础上,选取对螯合力影响较显著的温度、底物浓度及酶/底物3个因素,采用Box-Behnken进行优化设计,试验因素水平编码见表1。
1.3.4 大豆分离蛋白肽-硒螯合物制备工艺优化 在预试验(以螯合力为指标)基础上,采用Box-Behnken进行优化设计,试验因素水平编码见表2。

表1 Box-Behnken 试验因素水平及其编码

表2 Box-Behnken 试验因素水平及其编码
2 结果与分析
2.1 响应面试验结果
2.1.1 大豆分离蛋白酶解条件优化 响应面中心组合试验结果见表3。采用Design expert 8.0.6软件对酶解响应面设计的试验结果进行多元回归拟合和显著性检验,结果见表4。以螯合力为Y值,得出温度、底物浓度和酶/底物的三元二次回归方程:
Y=39.82-2.47A-3.21B+2.53C-0.072AB-0.86AC+0.48BC-17.20A2-14.81B2-9.96C2。
(1)
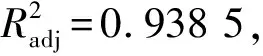

表3 中心组合试验设计及结果表

表4 中心组合试验设计方差分析表†
† *.差异显著(P<0.05);**.差异较显著(P<0.01);***.差异极显著(P<0.001)。
优化得到酶解的最优工艺为:温度49.62 ℃、底物浓度2.89%、酶/底物5.13 g/100 g,预测螯合力为40.25 mg/g。为方便试验操作调整螯合条件为温度50 ℃、底物浓度3%、酶/底物5 g/100 g,对试验预测结果进行验证得螯合力为(38.14±1.33) mg/g,且在此条件下制备所得多肽经测定水解度为(23.57±2.17)%。
2.1.2 大豆分离蛋白肽-硒螯合物制备条件优化 响应面中心组合试验结果见表5。采用Design expert 8.0.6软件对螯合物制备响应面设计的结果进行多元回归拟合和显著性检验,结果见表6。以螯合力为Y值,得出温度、时间和pH的三元二次回归方程:
Y=46.69-2.47A-0.39B+8.21C+1.48AB-0.58AC-2.78BC-8.44A2-21.81B2-7.34C2。
(2)

优化得到螯合的最优工艺为:pH 10.58、时间1.97 h、温度78.29 ℃,预测螯合力为49.27 mg/g。为方便试验操作调整螯合条件为pH 10、时间2 h、温度78 ℃,对试验预测结果进行验证得螯合力为(46.14 ±1.33) mg/g。
2.2 结构表征
2.2.1 吸收光谱 从图1可以看出,SPIP和SPIP-Se的吸收光谱有显著差异。SPIP的最强吸收峰在192 nm处,而SPIP-Se的最强吸收峰红移至194 nm,且其峰强明显增大,可能由于亚硒酸钠溶液的加入,使多肽结构中原本的生色团和助色团结构发生改变,造成电子跃迁,生成了新的大豆分离蛋白硒化多肽复合物。

表5 中心组合试验设计及结果表

表6 中心组合试验设计方差分析表†
† *.差异显著(P<0.05);**.差异较显著(P<0.01);***.差异极显著(P<0.001)。
2.2.2 荧光光谱 蛋白质中的色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)均可发射荧光,且由于其侧链生色基团的不同而有不同的荧光激发和发射光谱。故氨基酸含量丰富的SPIP也具有一定荧光性,但由于其他元素与肽的结合,可导致荧光特性的变化,故可由荧光光谱推断其结构的变化。从图2可以看出,SPIP和SPIP-Se的荧光强度和出峰位置都有明显差异。SPIP-Se的荧光强度显著变弱,说明亚硒酸根与SPIP结合,导致荧光猝灭作用。这种现象的产生可能与金属离子与蛋白肽反应导致荧光强度降低[10]类似。
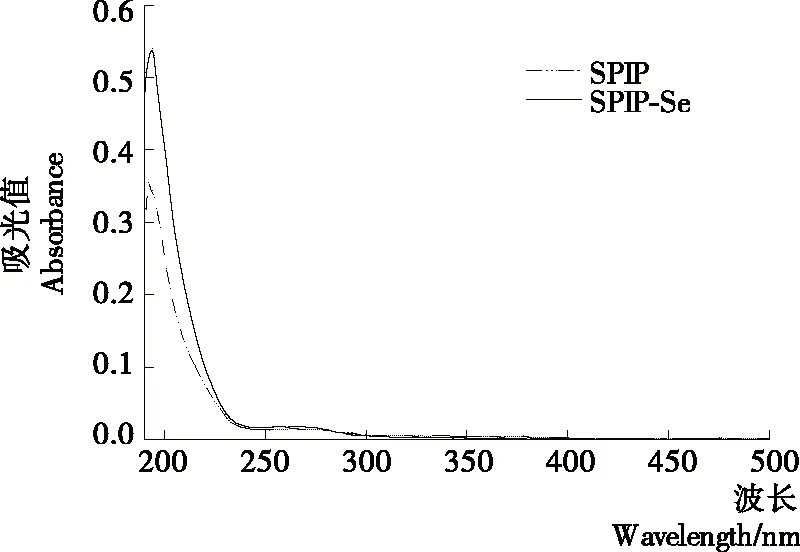
图1 大豆分离蛋白肽和大豆分离蛋白硒化多肽复合物的吸收光谱图

图2 大豆分离蛋白肽和大豆分离蛋白硒化多肽复合物的荧光光谱图
2.3 抗氧化活性
2.3.1 羟基自由基清除活力 如图3所示,SPIP和SPIP-Se均有一定的羟基自由基清除活力,且随多肽浓度的增加,两者的活力均有增强。在低蛋白浓度时,SPIP呈现比SPIP-Se更高的羟基自由基清除活力;但随着蛋白浓度的增加至400 μg/mL 时,SPIP-Se的羟基自由基清除活力开始显著增高,当蛋白浓度高于600 μg/mL时,其羟基自由基清除活力始终高于SPIP,在浓度为1 000 μg/mL时,SPIP-Se的羟基自由基清除活力达61.42%。

图3 大豆分离蛋白肽和大豆分离蛋白硒化多肽复合物的羟基自由基清除活性
2.3.2 还原力 如图4所示,SPIP和SPIP-Se均有一定的还原力,且两者还原力随浓度的增加而增强。同一浓度时,SPIP-Se具有更强的还原力。
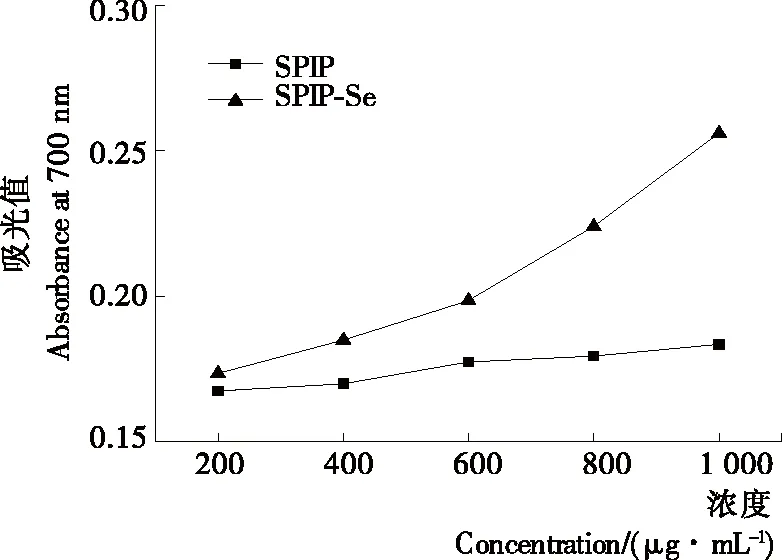
图4 大豆分离蛋白肽和大豆分离蛋白硒化多肽复合物的还原力
2.3.3 金属螯合活力 如图5所示,SPIP和SPIP-Se均有一定的金属螯合活力,且两者金属螯合活力随浓度的增加而增强。与SPIP相比,SPIP-Se有非常强的金属螯合活力,可能是由于肽链上接入了大量带负电荷的亚硒酸基团,静电相互作用使其有很强的金属螯合活力。

图5 大豆分离蛋白肽和大豆分离蛋白硒化多肽复合物的金属螯合活力
2.3.4 脂质过氧化抑制活性 亚油酸生成的过氧化物随自氧化程度增加而增多,抗氧化剂的抗氧化力越弱,吸光值越高。如图6所示,SPIP和SPIP-Se均对亚油酸自氧化有一定抑制作用,且SPIP-Se有较强的脂质过氧化抑制活性,可完全抑制亚油酸的自氧化反应。
3 结论
以硒螯合力为指标,通过响应面试验得出复合风味蛋白酶酶解SPI的最优工艺和SPIP-Se的最优制备工艺为:酶解温度50 ℃、底物浓度3%、酶/底物5 g/100 g;螯合反应pH 10、时间2 h、温度78 ℃,所得SPIP-Se螯合物的硒含量为46.143 mg/g。采用吸收光谱和荧光光谱进行结构表征,表明硒元素与SPIP有一定结合,并产生新的物质,使SPIP原本的结构发生变化。SPIP-Se有高于SPIP的羟基自由基清除活性、还原力、金属螯合活力,且脂质过氧化抑制活性试验表明浓度为1 000 μg/mL的SPIP-Se即可完全抑制亚油酸自氧化反应,证明SPIP-Se在脂质体系中有较强的抗氧化潜在应用价值。
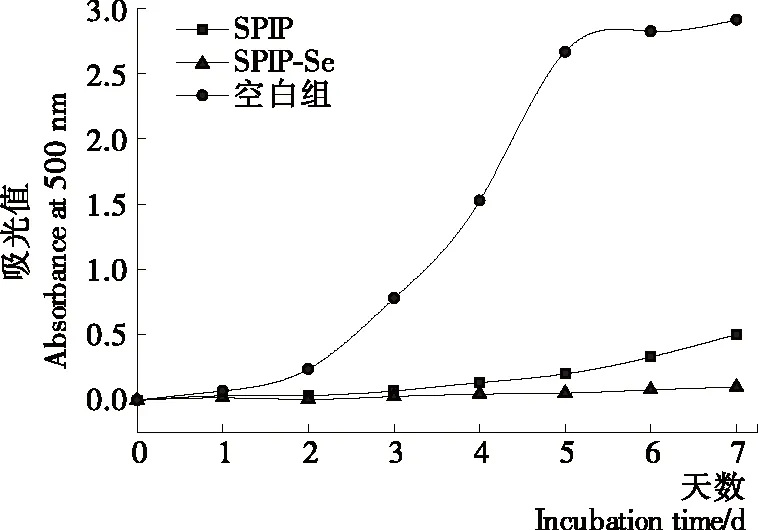
图6 大豆分离蛋白肽和大豆分离蛋白硒化多肽复合物的脂质过氧化抑制活性
[1] 王欣, 乔玲. 大豆分离蛋白的营养、功能特性及应用研究[J]. 农业科技与装备, 2013(5): 22-26.
[2] 孙茂成, 左丽丽, 富校轶, 等. 额外补硒与预防慢性疾病的关系[J]. 卫生研究, 2015(5): 23-27.
[3] 包怡红, 王芳, 王文琼. 大豆多肽硒螯合物的制备及抗氧化活性分析[J]. 食品科学, 2013, 34(16): 27-32.
[4] 赵新淮, 冯志彪. 蛋白质水解物水解度的测定[J]. 食品科学, 1994(11): 65-67.
[5] 贺立东. 分光度法测定富硒酵母中有机硒含量[J]. 食品工业科技, 2000, 21(5): 67-68.
[6] ZHANG Yu-feng, DUAN Xiu, ZHUANG Yong-liang. Purification and characterization of novel antioxidant peptides from enzymatic hydrolysates of tilapia (Oreochromisniloticus) skin gelatin[J]. Peptides, 2012, 38(1): 13-21.
[7] GÜLCIN I, ALICI H A, CESUR M. Determination ofinvitroantioxidant and radical scavenging activities of propofol[J]. Chemical & Pharmaceutical Bulletin, 2005, 53(3): 281-285.
[8] DINIS T C, MADEIRA V M, ALMEIDA L M. Action of phenolic derivatives (acetaminophen, salicylate, and 5-aminosalicylate) as inhibitors of membrane lipid peroxidation and as peroxyl radical scavengers[J]. Archives of Biochemistry and Biophysics, 1994, 315(1): 161-169.
[9] OSAWA T, NAMIKI M. A novel type of antioxidant isolated from leaf wax of Eucalyptus leaves[J]. Agricultural and Biological Chemistry, 1981, 45(3): 735-739.
[10] ZHAO Li-na, HUANG Qi-min, HUANG Shun-li, et al. Novel peptide with a specific calcium-binding capacity from whey protein hydrolysate and the possible chelating mode[J]. Journal of Agricultural and Food Chemistry, 2014, 42(62): 10 274-10 282.

