TIGAR基因过表达对低氧复氧损伤大鼠海马神经元的影响
(青岛大学附属医院麻醉科,山东 青岛 266021)
近年来,关于缺血再灌注损伤的研究越来越多,其中脑缺血再灌注损伤(CIRI)已逐渐成为研究热点,CIRI指各种原因致脑组织缺血后恢复血供,其缺血损伤未减轻反而加重的现象[1]。线粒体介导的凋亡途径在此过程中发挥重要作用,本课题组前期的研究发现,线粒体分裂可以促进细胞凋亡的发生,而抑制线粒体分裂可以减轻缺血再灌注引起的神经细胞损伤[2-5]。Tp53诱导的糖酵解和凋亡调节因子(TIGAR)是p53下游基因,其过表达可以抑制体内低氧状态下的糖酵解过程并活化磷酸戊糖途径,降低细胞内活性氧(ROS)水平,从而减轻氧化应激对细胞的损伤[6]。研究显示,在小鼠体内外CIRI模型中,过表达TIGAR可以升高神经细胞中还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)水平,降低神经元细胞内ROS水平,从而减少脑梗死面积和神经元凋亡情况[7-8]。目前关于TIGAR过表达是否是通过调控线粒体分裂来发挥缺血再灌注过程中的脑保护作用的研究较少。本实验拟探讨TIGAR基因表达在大鼠神经元低氧复氧损伤中对线粒体分裂的影响,为CIRI的临床治疗提供新的思路。
1 材料与方法
1.1 动物来源
出生24 h内SPF级Wistar大鼠300只,皮肤黏膜红润,运动活跃,体质量(8±3) g,无性别要求(购自青岛市药检所动物中心)。
1.2 仪器与试剂
流式细胞仪购自美国Beckman Coulter公司,酶标仪购自瑞士TECAN公司,激光共聚焦显微镜购自于日本JEOL公司;倒置光学显微镜购自日本Olympus公司。DMEM/F12培养基以及2.5 g/L胰蛋白消化酶、Earle平衡盐溶液购自Hyclone公司;胎牛血清、Neurobasal-A培养基、B27均购自美国Gibco公司;L-谷氨酰胺、丙酮酸钠、多聚赖氨酸购买自美国Sigma公司;TIGAR过表达的慢病毒(LV-TIGAR)及其对照组(LV-GFP),TIGAR沉默的慢病毒(LV_sh-TIGAR)及其对照组(LV_sh-scramble)购买自上海吉玛公司;小鼠抗大鼠Drpl、AIF、ROCK1单克隆抗体、兔抗大鼠Fis1、TIGAR单克隆抗体均购自美国Millipore公司;山羊抗鼠IgG/FITC、山羊抗兔IgG/RBITC购自北京博奥森生物技术有限公司。ROS荧光素探针(DCFH-DA)购于中国碧云天生物技术有限公司。
1.3 液体的配制
细胞种植液:DMEM/F12高糖培养基80 mL+体积分数0.20的胎牛血清20 mL,4 ℃环境下进行保存;Neurobasal-A培养液:Neurobasal-A基础培养液100 mL,其中含体积分数0.02的B27,体积分数0.01的1 mol/L谷氨酰胺,体积分数为0.01的0.1 mol/L丙酮酸钠,4 ℃环境下保存;L-多聚赖氨酸包被液:以高纯水配制多聚赖氨酸至1 g/L,并以直径0.22 μm无菌微孔过滤器过滤除菌(储存液),在-20 ℃环境下保存,稀释多聚赖氨酸储存液至50 mg/L(工作液)用于培养瓶及培养皿包被。
1.4 方法
1.4.1原代海马神经元培养 取新生的Wistar大鼠,以体积分数为0.75的乙醇表面消毒后冰上断头取脑,逐层分离皮肤及硬脑膜,剔除表面软脑膜及血管后获取海马组织,培养皿中将海马组织剪碎后加入2.5 g/L的胰酶,轻微吹打并置于37 ℃水浴锅中消化25 min。用含有体积分数为0.20的胎牛血清的DMEDM/F12培养基终止消化,过200目筛网,1 000 r/min离心5 min后用含有体积分数0.20胎牛血清的DMEDM/F12重悬,并在倒置显微镜下进行细胞计数。将25 mm×25 mm大小的培养瓶提前以0.1 g/L多聚赖氨酸包被过夜,使用前以PBS冲洗3次,将细胞以7×108/L的密度接种于培养瓶或者6孔板中,置于培养箱(37 ℃、含体积分数0.05 的CO2、相对湿度100%)中培养,根据神经元贴壁情况24 h内换为无血清的Neurobasal-A培养基。
1.4.2实验分组及处理 采用随机数字表法将提取的原代海马神经元细胞随机分为6组:正常组(A组)在首次换液后根据神经元生长情况及培养基颜色每2~3 d半量换液,培养至第8天,并继续正常培养,不做任何处理;低氧复氧损伤组(B组)培养至第8天的神经元采用氧糖剥夺法构建大鼠海马神经元低氧复氧损伤模型[9];过表达对照组(C组)将慢病毒空载体加入培养至第3天的原代海马神经元中共培养3~6 h后,换原培养基培养至第8天,进行低氧复氧;TIGAR过表达组(D组)将过表达TIGAR的慢病毒加入第3天的原代海马神经元中共培养3~6 h后,换原培养基培养至第8天,进行低氧复氧;沉默对照组(E组)将沉默随机片段的慢病毒加入第3天的原代海马神经元中共培养3~6 h,换原培养基,进行低氧复氧;TIGAR沉默组(F组)将沉默TIGAR的慢病毒加入第3天的原代海马神经元中共培养3~6 h,换原培养基培养至第8天,进行低氧复氧。
1.4.3Western blot方法检测线粒体分裂及细胞凋亡相关蛋白TIGAR、Drp1、Fis1、AIF及ROCK1的表达 提取各组海马神经元细胞的蛋白,BCA法测定蛋白浓度后调定。根据蛋白的相对分子质量分别配制丙烯酰胺体积分数为0.06、0.10、0.15的分离胶和丙烯酰胺体积分数为0.05的浓缩胶,依次将各组蛋白样品上样,电泳1.5 h后转膜1 h,以体积分数0.05的脱脂奶粉封闭2 h,分别加入兔抗大鼠单克隆一抗Fis1(1∶1 000)、兔抗大鼠单克隆一抗TIGAR(1∶1 000)、小鼠抗大鼠单克隆一抗Drp1(1∶2 000)、小鼠抗大鼠单克隆一抗AIF(1∶2 000)以及小鼠抗大鼠单克隆一抗ROCK1(1∶1 000)4 ℃孵育过夜,TBST洗膜3次(15 min/次)后,用辣根过氧化物酶标记的山羊抗小鼠、山羊抗兔、兔抗绵羊IgG二抗(1∶5 000)常温下孵育1 h,TBST洗膜3次(每次15 min)后显影,GADPH作为内参照,利用Image pro软件对蛋白质条带进行灰度分析,目的蛋白灰度值和GADPH蛋白灰度值的比值表示目的蛋白的相对表达水平。
1.4.4流式细胞仪检测细胞凋亡情况 收集各组的海马神经元细胞于1.5 mL的EP管中,以预冷的PBS冲洗1次,然后以1 000 r/min离心3 min,1×Binding buffer 100 μL重悬以后分别加入AV PI各5 μL,室温避光孵育15 min,1×Binding buffer补足至500 μL,即可上机检测。采用Flow Jo软件分析细胞凋亡率。
1.4.5激光共聚焦显微镜检测细胞内ROS荧光强度 Hank液冲洗各组海马神经元贴壁的细胞爬片后,向6孔板各孔内加入10 μmol/L的DCFH-DA约1 mL,37 ℃避光孵育45 min,以无血清培养基冲洗细胞3次后,以40 g/L的多聚甲醛固定45 min,甘油防止荧光猝灭,封片后,激光共聚焦显微镜观察ROS荧光强度,采用Image J软件对图片进行分析。
1.5 统计学分析
2 结 果
2.1 各组海马神经元ROS浓度及细胞凋亡率比较
A~F组ROS浓度分别为0.021±0.001、0.076±0.002、0.075±0.001、0.051±0.001、0.077±0.003、0.089±0.002,细胞的凋亡率分别为3.117±0.179、42.657±1.661、40.597±0.587、25.602±0.744、41.690±1.193、50.253±0.863。与A组相比,B~F组海马神经元的细胞凋亡率和ROS荧光强度均明显增高(F=900.89、1161.10,P<0.05)。与B组相比,D组海马神经元细胞凋亡率和ROS荧光强度均明显降低,F组海马神经元细胞凋亡率及ROS荧光强度明显升高(P<0.05),而C组和E组海马神经元的细胞凋亡率和ROS荧光强度比较差异无显著性(P>0.05)。
2.2 各组海马神经元线粒体分裂及细胞凋亡相关蛋白的表达水平比较
与A组相比,其他5组神经元TIGAR表达水平均明显升高(F=73.73,P<0.05);与B组相比,F组神经元的TIGAR表达水平明显下降,D组神经元的TIGAR表达水平明显上升(P<0.05),C组和E组神经元的TIGAR表达量差异无显著意义(P>0.05)。与A组相比较,其他5组神经元的Drp1、Fis1、AIF及ROCK1的表达水平均明显升高(F=96.756~667.63,P<0.05);与B组相比,F组的上述蛋白表达水平均明显升高,D组的上述蛋白表达水平均明显下降(P<0.05),C组和E组上述蛋白的表达水平差异无显著性(P>0.05)。见表1。
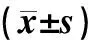
表1 各组海马神经元线粒体及凋亡相关蛋白表达水平的比较
3 讨 论
线粒体是真核细胞最为重要的细胞器之一,通过氧化磷酸化为机体的各种生命活动提供能量。过去认为线粒体的形态是一成不变的,但是近年来的研究表明线粒体在不断地进行着分裂融合并维持相对的动态平衡[10-11]。这种动态平衡一旦被破坏,则易引发疾病。线粒体动力学变化尤其是线粒体分裂在脑缺血再灌注过程中占据重要地位[11-12]。
线粒体呼吸链是ROS最主要的来源,缺血再灌注过程中,低氧使得线粒体氧化呼吸链解耦联,产生大量的ROS[13],直接损伤mtDNA和细胞内结构,引起细胞凋亡。一定浓度的ROS又可诱导内质网和肌浆网大量开放使得Ca2+的浓度升高,胞浆中的Ca2+作为第二信使又会启动多条信号转导途径进一步升高ROS水平[14-15]。我们课题组之前的研究显示,Ca2+水平的升高可激活胞浆内钙调神经磷酸酶,该酶的激活可以导致线粒体分裂动力蛋白Drp1-sr637位点的丝氨酸磷酸化,使得位于胞浆的Drp1向线粒体转移,并与位于线粒体外膜上的招募蛋白Fis1锚定,通过水解GTP改变分子间的距离和角度,微管重新分布最终引起线粒体分裂[16-18]。线粒体分裂使得线粒体完整性受到破坏,释放细胞色素C、AIF等促凋亡因子,激活caspase3并启动不可逆的程序化细胞凋亡途径[19]。
此外,有研究表明,ROS也可以通过Rho/Rho-Kinase信号通路调节心脏以及肾脏缺血再灌注损伤,并且参与调节线粒体的功能及动态变化[20-21]。NOMA等[22]的研究也证实,细胞内的ROS含量升高可以通过激活Rho-A提高下游的ROCK1活性,从而引起Drp1-ser600位点丝氨酸的磷酸化导致线粒体分裂。
TIGAR作为p53下游的调控因子,作用类似于PFKFB,可在低氧的环境下表达升高,同时减低2,6-二磷酸果糖水平,抑制糖酵解,并通过促进磷酸戊糖途径升高细胞内NADPH的水平,降低ROS的水平[6-8]。
本实验通过构建海马神经元低氧复氧损伤模型,通过外源性转染慢病毒提高海马神经元细胞内的TIGAR水平,可显著降低神经细胞内ROS水平,抑制ROCK1、Drp1和Fis1蛋白的表达水平,减轻线粒体损伤程度,减少AIF释放,进一步验证了TIGAR过表达可通过抑制线粒体分裂减轻细胞凋亡、保护神经元的作用。当然,本实验仍有一定的局限性,TIGAR过表达调控细胞内ROS的具体途径及表达方式,仍需要进一步的实验研究。
[参考文献]
[1] GRANGER D N, KVIETYS P R. Reperfusion injury and reactive oxygen species: The evolution of a concept[J]. Redox Biol, 2015,6(2):524-551.
[2] ZHANG N, WANG S, LI Y, et al. A selective inhibitor of Drp1, mdivi-1, acts against cerebral ischemia/reperfusion injury via an anti-apoptotic pathway in rats[J]. Neurosci Lett, 2013,535(2):104-109.
[3] DONG H, WANG S, ZHANG Z, et al. The effect of mitochondrial calcium uniporter opener spermine on diazoxide against focal cerebral ischemia-reperfusion injury in rats[J]. Stroke Cerebrovasc Dis, 2014,23 (2):303-309.
[4] WANG J, WANG P, LI S, et al. Mdivi-1 prevents apoptosis induced by ischemia-reperfusion injury in primary hippocampal cells via inhibition of reactive oxygen species-activated mitochondrial pathway[J]. J Stroke Cerebrovasc Dis, 2014,23 (6):1491-1499.
[5] ZHAO L, LI S, WANG S, et al. The effect of mitochondrial calcium uniporter on mitochondrial fission in hippocampus cells ischemia/reperfusion injury[J]. Biochem Biophys Res Commun, 2015,461(3):537-542.
[6] BENSAAD K, TSURUTA A, SELAK M A, et al. TIGAR, a p53-inducible regulator of glycolysis and apoptosis[J]. Cell, 2006,126 (1):107-120.
[7] LI M, SUN M, CAO L, et al. A TIGAR-regulated metabolic pathway is critical for protection of brain ischemia[J]. J Neurosci, 2014,34 (22):7458-7471.
[8] CAO L, CHEN J, LI M, et al. Endogenous level of TIGAR in brain is associated with vulnerability of neurons to ischemic injury[J]. Neurosci Bull, 2015,31 (5):527-540.
[9] 姜骏,符岳,方向,等. 大鼠海马神经元体外氧糖剥夺/复氧模型的构建[J]. 2010, 5(5):497-501.
[10] ANNE S R, LEAK R K, GAO Y, et al. The dynamics of the mitochondrial organelle as a potential therapeutic target[J]. J Cereb Blood Flow Metab, 2013,33 (1):22-32.
[11] NASRALLAH C M, HORVATH T L. Mitochondrial dyna-mics in the central regulation of metabolism[J]. Nat Rev Endocrinol, 2014,10 (11):650-658.
[12] SILACHEV D N, PLOTNIKOV E Y, PEVZNER I B, et al. The mitochondrion as a key regulator of ischaemic tolerance and injury[J]. Heart Lung Circ, 2014,23 (10):897-904.
[13] DROSE S, STEPANOVA A, GALKIN A. Ischemic A/D transition of mitochondrial complex I and its role in ROS ge-neration[J]. Biochim Biophys Acta, 2016,1857 (7):946-957.
[14] RAAT N J, SHIVA S, GLADWIN M T. Effects of nitrite on modulating ROS generation following ischemia and reperfusion[J]. Adv Drug Deliv Rev, 2009,61(4):339-350.
[15] AKBAR M, ESSA M M, DARADKEH G, et al. Mitochondrial dysfunction and cell death in neurodegenerative diseases through nitroxidative stress[J]. Brain Res, 2016,1637(3):34-55.
[16] WANG H, ZHENG S, LIU M, et al. The Effect of propofol on mitochondrial fission during oxygen-glucose deprivation and reperfusion injury in rat hippocampal neurons[J]. PLoS One, 2016,11(10): e0165052.
[17] BALOG J, MEHTA S L, VEMUGANTI R. Mitochondrial fission and fusion in secondary brain damage after CNS insults[J]. J Cereb Blood Flow Metab, 2016,36(12):2022-2033.
[18] SHARP W W. Dynamin-related protein 1 as a therapeutic target in cardiac arrest[J]. J Mol Med(Berl), 2015,93(3):243-252.
[19] RODRIGO R, FERNANDEZ-GAJARDO R, GUTIERREZ R, et al. Oxidative stress and pathophysiology of ischemic stroke: Novel therapeutic opportunities[J]. CNS Neurol Di-sord Drug Targets, 2013,12(5):698-714.
[20] KENTRUP D, REUTER S, SCHNOCKEL U, et al. Hydroxyfasudil-mediated inhibition of ROCK1 and ROCK2 improves kidney function in rat renal acute ischemia-reperfusion injury[J]. PLoS One, 2011,6(10): e26419.
[21] JIANG Z H, ZHANG T T, ZHANG J F. Protective effects of fasudil hydrochloride post-conditioning on acute myocardial ischemia/reperfusion injury in rats[J]. Cardiol J, 2013,20(2):197-202.
[22] NOMA K, OYAMA N, LIAO J K. Physiological role of ROCKs in the cardiovascular system[J]. Am J Physiol Cell Physiol, 2006,290(3): C661-668.

