MiR-27a-3p在肺腺癌中的表达及意义
(1 青岛大学附属医院胸外科,山东 青岛 266003; 2 青岛大学转化医学研究院; 3 滨州市滨城区市立医院检验科)
肺癌是中国乃至世界范围内发病率和死亡率最高的恶性肿瘤[1]。肺癌包括小细胞肺癌(SCLC)以及非小细胞肺癌(NSCLC),其中NSCLC是最为常见的肺癌病理类型,约占全部肺癌病人的85%[1-2]。NSCLC包括腺癌、鳞状细胞癌以及大细胞癌等,其中以腺癌最为多见[3]。由于肺癌早期缺乏有效的诊断方法,临床发现时往往已处于晚期阶段,总的5年生存率仅为15%[3]。微小RNA(miRNA)是一类小的(长度为19~24个核苷酸)且高度保守非编码RNA。miRNA通过与特异的靶mRNA结合调控其降解或者抑制其翻译,从而降低相关靶基因蛋白质的表达[4]。生物信息学数据表明,miRNA参与调控多种生物活动,包括发育、器官形成、细胞增殖和凋亡、脂肪代谢以及肿瘤的发生发展等[5]。不同的miRNA可以通过多种途径发挥促癌或抑癌作用,具体取决于其在细胞中的表达方式、靶基因或者细胞环境[6]。HUR等[7]研究发现,miRNA-200c在介导人结直肠癌转移中的上皮-间质转化(EMT)中发挥重要作用,并且miR-200c可以作为结直肠癌病人的潜在诊断标记和治疗靶标。SEOL等[8]研究显示,miR-373通过组蛋白修饰在肺癌细胞中表达下调,并通过下调IRAK2和LAMP1来抑制肿瘤的生长。ZHOU等[9]发现miR-27a-5p以及miR-27-3p两种亚型在胃癌组织和细胞系中均高表达,但miR-27a的主要亚型miR-27a-3p的表达水平显著地高于miR-27a-5p并可以促进胃癌细胞的增殖能力。目前关于miR-27a的主要亚型miR-27a-3p在肺腺癌病人中的表达以及对肺腺癌细胞生物学行为的影响未见相关研究报道。本研究旨在测定肺腺癌组织和细胞中miRNA-27a-3p的表达水平,以及miR-27a-3p过表达或沉默对肺腺癌细胞增殖和迁移能力的影响,从而为临床治疗该病提供依据。
1 材料与方法
1.1 材料来源
收集2017年5月—2017年9月于我院胸外科行根治性或姑息性切除术的21例肺腺癌病人原发病灶及癌旁组织(距离癌组织5 cm以上)标本。所有病人病历资料完整,均经过病理学检查确诊为肺浸润性腺癌,并且术前均未进行辅助放化疗。所有收集的临床标本均立即在液氮中冷冻,然后冻存于-80 ℃冰箱中。本研究获得了我院伦理委员会批准。试验参与者均知情同意参与本研究。
1.2 细胞培养及试剂
人肺腺癌细胞A549细胞系购自中国科学院上海细胞库。胎牛血清和RPMI-1640培养基均购自以色列Biological Industries。将A549细胞在含有体积分数0.10的胎牛血清,1×105U/L的青霉素,100 mg/L链霉素的RPMI-1640培养基中培养,并置于含体积分数0.05 CO2的37 ℃培养箱中孵育。miR-27a-3p模拟物(miR-27a-3p mimics)及其阴性对照物,miR-27a-3p抑制剂(miR-27a-3p inhibitor)及其阴性对照物均由上海吉玛制药技术有限公司设计并合成。RNA反转录试剂盒(PrimeScriptTMRT reagent Kit)以及RT-qPCR试剂盒(SYBR Green I kit)均购自日本TaKaRa公司,MTT试剂盒购自上海拜力生物科技有限公司,脂质体Lipofectamine 2000及RNA提取试剂(trizol)购自Life Technologies公司(Carlsbad,CA,USA)。
1.3 RNA提取及RT-qPCR
按照RNA提取试剂盒说明书用TRIzol提取癌组织和相应癌旁组织的细胞总RNA,以细胞总RNA为模板,应用miRNA逆转录试剂盒将RNA逆转录为cDNA,根据RT-qPCR试剂盒说明书对cDNA进行扩增,使用U6作为内参基因来检测miR-27a-3p的相对表达量。RT-qPCR总反应体系为25 μL。反应条件为:95 ℃预变性5 min;然后95 ℃ 30 s、58 ℃ 30 s、72 ℃ 30 s,共进行40个循环。miR-27a-3p逆转录引物5′-GTCGTATCCAG-TGCAGGGTCCGAGGTATTCGCACTGGATAC-GACGCGGAA-3′;miR-27a-3p上游引物5′-CGCC-GTTCACAGTGGCTAAG-3′,下游引物5′-GTGC-AGGGTCCGAGGT-3′;内参U6上游引物5′-CTC-GCTTCGGCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′。miR-27a-3p和U6表达水平根据阈值周期(Ct)定义。使用2-△△Ct方法评估相对表达水平。实验重复3次,取均值。
1.4 MTT检测细胞增殖情况
将A549细胞消化离心后,用含体积分数0.10胎牛血清1640培养基重悬细胞。按照5×106/L的密度接种于96孔板中,每孔200 μL,置于含体积分数0.05 CO2的37 ℃培养箱中培养。设置对照组、miR-27a-3p mimics组(A组)、miR-27a-3p mimics control组(B组)、miR-27a-3p inhibitor组(C组)和miR-27a-3p inhibitor control组(D组)。孵育6 h后,更换为无血清培养基,用miR-27a-3p mimics和miR-27a-3p inhibitor及其阴性对照物转染细胞,将转染后细胞置于含体积分数0.05 CO2的37 ℃培养箱中继续培养。将细胞继续培养24、48、72和96 h,每孔加入灭菌MTT溶液15 μL,继续孵育4 h,弃培养液,每孔加入二甲基亚砜150 μL,摇床缓慢振荡10 min,用酶标仪在492 nm波长下测定吸光度(A)值。每组设6个复孔,实验重复3次,取均值。
1.5 细胞划痕实验
将A549细胞以1×108/L的密度接种于6孔板内,每孔1 mL。设置对照组、A组、B组、C组和D组。将细胞进行转染24 h后,用规格为200 μL的Tip头对细胞进行划痕,用PBS洗涤去除悬浮的细胞。分别于划痕后0和24 h进行拍照,然后采用Image Pro Plus6分析图像,计算划痕愈合面积。实验重复3次,取均值。
1.6 统计学分析
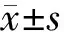
2 结 果
2.1 两种组织中miR-27a-3p的表达
RT-qPCR检测结果显示,与癌旁组织相比,21例肺腺癌组织中有13例组织中的miR-27a-3p表达水平上调,其中11例组织中miR-27a-3p呈现高表达;3例组织中miR-27a-3p表达水平无明显变化;5例组织中miR-27a-3p表达水平降低。癌旁组织与相应的肺腺癌组织中miR-27a-3p的平均表达水平分别为1.00±0.01、1.82±0.11,与癌旁组织相比,肺腺癌组织中的表达水平明显升高(t=12.912,P<0.01)。本研究选取了3组样本的PCR产物进行凝胶电泳实验。PCR产物凝胶电泳结果显示,与癌旁组织相比,肺腺癌组织中miR-27a-3p表达水平明显增高。见图1。
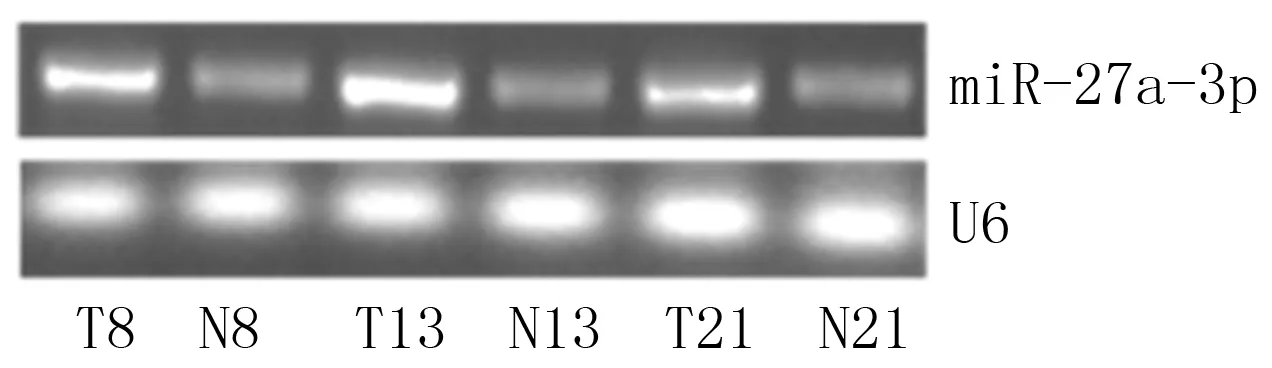
T:肺腺癌组织;N:癌旁组织。
2.2 A549细胞系中miR-27a-3p的表达
在A549细胞转染24 h后,设对照组细胞表达水平为1.00,A组和B组细胞的miR-27a-3p表达水平分别为27.96±1.69、1.51±0.53,与B组相比A组表达水平显著增高(t=25.866,P<0.01)。C组以及D组的表达水平明分别为0.10±0.019、1.47±0.32,与D组相比,C组表达水平明显降低,差异有统计学意义(t=7.441,P<0.05)。
2.3 A549细胞增殖能力检测结果
通过MTT增殖实验检测对照组、A组、B组、C组和D组细胞在转染后不同时间点细胞的增殖活性。与B组相比,在48、72、96 h时间点,A组细胞的增殖能力明显增强(t=5.459~6.793,P<0.05);与D组相比,C组细胞的增殖能力则显著降低(t=4.593~5.322,P<0.05)。见表1。
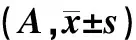
表1 组细胞增殖活力比较
2.4 A549细胞迁移能力检测结果
将相应转染后的不同组别细胞进行划痕实验。A组以及B组细胞划痕的愈合面积百分比分别为0.70±0.08、0.23±0.04。与B组相比,A组细胞愈合面积显著增加(t=9.102,P<0.01)。C组和D组细胞划痕的愈合面积百分比分别为0.14±0.03、0.39±0.05。与D组相比,C组细胞愈合面积明显降低(t=7.426,P<0.01)。
3 讨 论
近年来,大量研究证实miRNA的表达失调或功能异常可能导致包括肿瘤在内的多种疾病的发生。研究显示在人类肿瘤中存在miRNA表达的失调,miRNA通过发挥促癌或抑癌作用参与肿瘤细胞的增殖、凋亡以及分化调控[10,12]。例如HUANG等[13]研究显示,miR-10b在NSCLC组织中异常高表达,miR-10b的沉默通过阻滞G0/G1期中的细胞周期进程并且促进NSCLC细胞中的细胞凋亡来抑制癌细胞进展。而CAMPAYO等[14]发现miR-145在NSCLC组织中表达降低,提高其表达水平可抑制肺癌的发生发展。因此,了解miRNA在肿瘤中的表达及其对肿瘤细胞生物学功能的影响对于发现癌症治疗策略具有重要价值。
研究表明,miR-27a-3p在多种癌症组织中高表达,包括胰腺癌、卵巢癌等,并与癌细胞的生物学行为密切相关[9]。miR-27a在乳腺癌、胃癌、胰腺癌和结肠癌中作为致癌miRNA高度表达[15-16]。研究发现miR-27a在乳腺癌中异常高表达,并且表达水平与乳腺癌病人的临床分期和总体生存时间密切相关,其通过调节乳腺癌细胞的细胞凋亡、细胞周期和分化而起作用[15]。研究发现,在口腔鳞癌干细胞和肾癌细胞中miR-27a-3p的过表达与癌细胞转移和侵袭性有关[16-17]。miR-27a在急性白血病中表达下调,这表明miR-27a可能在急性白血病中发挥肿瘤抑制剂样作用[18]。也有研究表明miR-27a-3p表达水平在食管鳞状细胞癌中显著降低,miR-27a-3p在这些癌症中具有肿瘤抑制作用[19]。miR-27a-3p在肿瘤中的作用机制较复杂,目前已发现多个下游作用靶点。研究发现miR-27a-3p在胃癌细胞中过表达可以降低BTG2蛋白的表达,通过胃癌细胞中的Ras/MEK/ERK途径来促进C-myc的活化从而抑制胃癌细胞的凋亡[9]。LI等[20]研究证实miR-27a-3p在肝细胞癌组织中表达下调,细胞实验结果证实miR-27a-3p表达可以下调肝细胞癌中DUSP16的表达,从而通过DUSP16靶向抑制癌细胞生长、迁移和侵袭能力。以上研究表明目前miR-27a-3p在肿瘤中的表达及生物学作用还需要进一步研究,而其在肺腺癌中的表达和意义目前还没有证实。
本研究测定了肺腺癌组织和细胞中miR-27a的主要亚型miRNA-27a-3p的表达水平,同时构建miR-27a-3p过表达或沉默的A549细胞株来探究miR-27a-3p表达水平对肺腺癌细胞增殖和迁移能力的影响。为研究miR-27a-3p在肺腺癌中的表达水平,我们选取21例肺腺癌病人的肿瘤组织和癌旁组织进行检测。结果显示,与癌旁正常组织相比,miR-27a的主要亚型miR-27a-3p在肺腺癌组织中的表达水平明显升高。研究证实miR-27a-3p在肺腺癌中高表达,这提示miR-27a-3p的上调可能在肺腺癌的发生发展中起一定作用。进一步通过转染miR-27a-3p mimics或miR-27a-3p inhibitor来上调或沉默肺腺癌A549细胞中miR-27a-3p的表达水平,并观察转染后细胞增殖和迁移能力的变化。研究显示,miR-27a-3p的上调能够显著增强肿瘤细胞的增殖和迁移能力,这说明miR-27a-3p可以明显促进肺腺癌细胞的生长和侵袭能力。相反,miR-27a-3p的下调则明显降低了肺腺癌细胞的增殖和迁移能力。这提示miR-27a-3p在肺腺癌细胞侵袭和转移中扮演重要角色。肺癌细胞的增殖和侵袭能力是肺癌进展快恶性度高的重要因素,我们的数据首次证实miR-27a-3p在肺腺癌中表达上调,并能增强肺腺癌细胞的增殖和侵袭能力。因此,miR-27a主要亚型miR-27a-3p是肺腺癌发生发展中起重要作用的癌基因,可能为肺腺癌的治疗提供潜在的治疗靶点。本研究仅局限于临床样本和细胞功能的研究,今后还需要加大样本量再深入研究miR-27a-3p表达水平与肺腺癌病人分期等临床因素的关系以及在细胞中发挥作用的分子机制。
综上所述,miR-27a主要亚型miR-27a-3p在肺腺癌组织中显著异常高表达,其表达水平与肺腺癌细胞的增殖和迁移能力呈正相关。因此,miRNA-27a-3p的异常表达可能在肺腺癌发生发展中起一定的作用,其作用的机制我们还会进一步研究,期望能更好地应用于肺腺癌早期诊断和防治。
[参考文献]
[1] RECK M, LONGO D L, RABE K F, et al. Precision diagnosis and treatment for advanced non-small-cell lung cancer[J]. N Engl J Med, 2017,377(9):849-861.
[2] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017,67(1):7-30.
[3] 张其程, 徐克. 自噬在EGFR-TKI类肿瘤靶向药物对肺癌的治疗和耐药中作用的研究进展[J]. 中国肺癌杂志, 2016,19(9):607-614.
[4] SI L, TIAN H, YUE W, et al. Potential use of microRNA-200c as a prognostic marker in non-small cell lung cancer[J]. Oncol Lett, 2017,14(4):4325-4330.
[5] 沈月兰,蒋义国. microRNA与癌症发生相关性研究的现状[J]. 中华肿瘤防治杂志, 2008,15(1):68-71.
[6] FENG B, ZHANG K, WANG R, et al. Non-small-cell lung cancer and miRNAs: Novel biomarkers and promising tools for treatment[J]. Clin Sci, 2015,128(10):619-634.
[7] HUR K, TOIYAMA Y, TAKAHASHI M, et al. MicroRNA-200c modulates epithelial-to-mesenchymal transition (EMT) in human colorectal cancer metastasis[J]. Gut, 2013,62(9):1315-1326.
[8] SEOL H S, AKIYAMA Y, SHIMADA S, et al. Epigenetic silencing of microRNA-373 to epithelial-mesenchymal transition in non-small cell lung cancer through IRAK2 and LAMP1 axes[J]. Cancer Lett, 2014,353(2):232-241.
[9] ZHOU L, LIANG X, ZHANG L, et al. MiR-27a-3p functions as an oncogene in gastric cancer by targeting BTG2[J]. Oncotarget, 2016,7(32):51943-51954.
[10] SHEN K, MAO R, MA L, et al. Post-transcriptional regulation of the tumor suppressor miR-139-5p and a network of miR-139-5p-mediated mRNA interactions in colorectal cancer[J]. FEBS J, 2014,281(16):3609-3624.
[11] MA S, SUN J, GUO Y, et al. Combination of AAV-TRAIL with miR-221-Zip therapeutic strategy overcomes the resis-tance to TRAIL induced apoptosis in liver cancer[J]. Theranostics, 2017,7(13):3228-3242.
[12] LI J, TAN S, KOOGER R, et al. MicroRNAs as novel biological targets for detection and regulation[J]. Chem Soc Rev, 2014,43(2):506-517.
[13] HUANG J, SUN C, WANG S, et al. MicroRNA miR-10b inhibition reduces cell proliferation and promotes apoptosis in non-small cell lung cancer (NSCLC) cells[J]. MolBiosyst, 2015,11(7):2051-2059.
[14] CAMPAYO M, NAVARRO A, VINOLAS N, et al. Low miR-145 and high miR-367 are associated with unfavourable prognosis in resected nonsmall cell lung cancer[J]. Eur Respir J, 2013,41(5):1172-1178.
[15] ZHAO W, ZHANG X, ZHOU Z, et al. Liraglutide inhibits the proliferation and promotes the apoptosis of MCF-7 human breast cancer cells through downregulation of microRNA-27a expression[J]. Mol Med Rep, 2018,17(4):5202-5212.
[16] QIAO B, HE B X, CAI J H, et al. MicroRNA-27a-3p modulates the wnt/beta-catenin signaling pathway to promote epithelial-mesenchymaltransition in oral squamous carcinoma stem cells by targeting SFRP1[J]. Sci Rep, 2017,7:44688.
[17] NAKATA W, UEMURA M, SATO M, et al. Expression of miR-27a-3p is an independent predictive factor for recurrence in clear cell renal cell carcinoma[J]. Oncotarget, 2015,6(25):21645-21654.
[18] XU Q, HE C, LIU, J, et al. Pre-miR-27a rs895819A/G polymorphisms in cancer: Ameta-analysis[J]. PLoS One, 2013,8(6), e65208.
[19] JIANG Y, DUAN Y, ZHOU H. MicroRNA-27a directly targets KRAS to inhibit cell proliferation in esophageal squamous cell carcinoma[J]. Oncol Lett, 2015,9(1):471-477.
[20] LI J M, ZHOU J, XU Z, et al. MicroRNA-27a-3p inhibits cell viability and migration through down-regulating DUSP16 in hepatocellular carcinoma[J]. J Cell Biochem, 2018(1):1-10.

