认知行为疗法对改善癌症临终患者家属心理状态的研究*
吴倩倩 ,林晓骥 ,蔡丽梦 ,潘 军 ,郑雪儿 ,朱鑫浩 ,李长瑾 ,何牧卿 ,林海燕
(1温州医科大学精神医学学院,浙江 温州 325000,417355325@qq.com;2温州医科大学附属第二医院,浙江 温州 325000)
随着中国人口老龄化趋势的日益加剧,健康问题越来越突出,尤其是恶性肿瘤已成为中国最大的公共卫生问题。 众所周知,晚期癌症患者不仅要遭受生理上的痛苦,更要承受巨大的心理压力,生活质量严重下降。作为晚期癌症患者最主要的照顾者——家属同样面临巨大的身心压力, 在此期间不仅容易出现各种心理问题,且他们的负面情绪也在一定程度上会加重晚期癌症患者的心理问题。Song[1]等研究表明,36.3%癌症临终患者家属可以产生不同程度的抑郁症状,甚至严重影响生活质量。
随着医学模式的转变,医疗任务与范围在不断扩大,如何对临终患者家属进行健康教育,是医护人员不容忽视的职责之一。当朝夕相伴的亲人面临生命的最后驿站,家属的心理问题往往贯穿全过程,因此家属同样迫切需要医护人员的鼓励、支持和指导,以防止心身疾病的发生。 在国外,对癌症临终患者家属的心理干预已属于临终关怀服务的一部分,可是国内很少有人关注临终癌症患者家属的身心健康[2]。本项目通过分析癌症临终患者家属心理状态,并实施有针对性的认知行为疗法,以此减轻或消除患者家属的心理症状,改善其生活质量。现报道如下。
1 资料与方法
1.1 临床资料
选择2016年1月-2017年6月期间温州医科大学附属第二医院血液肿瘤科60例癌症临终患者家属作为研究对象,随机分为观察组和对照组。对观察组30例患者家属实施认知行为疗法,对照组30例则给予一般支持性心理护理。两组在年龄、性别、职业、生活状况、家族谱、教育程度等方面的差异无统计学意义(P>0.05)。所有列入研究的对象需满足以下入选标准:①癌症临终患者的预计生存时间为3~6个月; ②主要承担照顾和陪伴的任务;③能进行语言沟通,自愿参加;④年龄在18岁以上。
1.2 研究方法
由具体二级心理咨询师资质的临床医师或主管护师定期对观察组的患者家属进行认知行为疗法干预, 每周2~3次,每次30~60分钟,共12周。干预过程中,建立具体流程图,主要有四个部分:①采用汉密尔顿抑郁量表(HAMD)、汉密尔顿焦虑量表(HAMA)评估癌症临终患者家属现在的心理状态;②采用匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)评价患者家属的睡眠质量;③整合上述资料对患者家属进行认知行为疗法干预;④干预后再次采用上述量表进行评价。
认知行为疗法的具体措施:首先全面掌握患者家属的心理状况,帮助填写相关量表,做好医患沟通,提高患者家属信任感;采用讨论式为主的心理学方法引导患者家属识别自己在照顾患者过程中的自动化思维以及歪曲认知;开展换位思考法、教育引导法和医患互信法等引导患者家属以积极的心态面对临终患者的死亡;结合具体引发患者家属负性情绪的事件进行分析,通过心理暗示、换位思考、案例分析等方法改变不合理的认知,同时结合共情技术不断提供家属支持;及时肯定患者家属在整个干预过程中的进步以及努力,进一步强化合理思维,用放松疗法、情绪想象技术等认知行为疗法释放压力;指导学习独立生活,做好患者离去后的生活准备。
1.3 观察指标
①汉密顿抑郁量表(Hamilton Depression Scale,HAMD):由Hamilton于1960年编制,是评定抑郁状态时应用得最为广泛的量表,共有17个评定项目,采用0~4分的5级评分法,HAMD≥8分为抑郁症,得分越高表示抑郁症状越严重[3]。②汉密尔顿焦虑量表(Hamilton Anxiety Scale,HAMA):由Hamilton于1959年编制,是临床上评定焦虑症的重要诊断工具;共有14个评定项目,采用0~4分的5级评分法,HAMD≥8分为焦虑症,得分越高表示焦虑症状越严重[4]。③匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI):由Buysse于1989年编制的,该量表不仅适用于睡眠障碍患者、精神障碍患者,同时也适用于一般人睡眠质量的评估。PSQI由19个自评和5个他评项目构成,PSQI总分为21分,PSQI≥7分为睡眠障碍,得分越高,表示睡眠质量越差[5]。
1.4 统计学方法
采用SPSS19.0统计学软件分析处理数据,计量资料以C均数±标准差表示,计数资料以百分率(%)表示,样本比较采用t检验和χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组干预前后的抑郁、焦虑情况比较
在60例患者中,干预前经HAMD和HAMA测评,55%患者家属存在抑郁症状,56.7%患者家属存在焦虑。干预前抑郁、焦虑发生率和HAMD、HAMA评分在两组间差异无统计学意义(P>0.05)。干预后,观察组患者家属抑郁、焦虑发生率和HAMA、HAMD评分均较干预前明显下降。干预后观察组抑郁、焦虑情况也明显优于对照组 (P<0.05) ,见表。尽管对照组干预后家属HAMA、HAMD评分较干预前改善(P<0.05),但抑郁、焦虑率差异无统计学意义(P>0.05)。见表1、表2。
2.2 两组家属干预前后睡眠质量情况比较
干预前经测评显示, 60例患者家属中有91.7%存在不同程度的睡眠障碍,两组在干预前睡眠障碍发生率和PSQL评分情况均无显著性差异(P>0.05)。干预后,两组患者家属的睡眠障碍发生率和PSQL评分均较干预前明显下降(P<0.05),但观察组睡眠质量情况改善更加优于对照组 (P<0.05) 。见表1、表2。

表1 2组癌症临终患者家属抑郁、焦虑和睡眠障碍的发生率比较[n(%)]
注:与观察组干预前相比,▲P< 0.05;与对照组干预前比较,■P< 0.05;与对照组干预后比较,#P< 0.05。
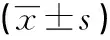
表2 2组癌症临终患者家属的抑郁、焦虑和睡眠障碍的评分比较
注:与观察组干预前相比,▲P< 0.05;与对照组干预前比较,■P< 0.05;与对照组干预后比较,#P< 0.05。
3 讨论
近年来我国癌症患病率不断升高,由于晚期癌症不可治愈,生存时间极短,不仅给患者带来极大的身心痛苦,同时对家属也是一个沉重的打击。在中国现有的社会保障体制下,照顾临终的癌症患者的重担均压在家属身上,家属面临着巨大的身心压力[6]。以往有研究显示,癌症临终患者的家属普遍存在较严重的心理应激反应和焦虑、抑郁情绪[7]。本研究也同样发现,在照顾癌症临终患者的过程中,55%的患者家属存在抑郁症状,56.7%的患者家属存在焦虑症状。本研究对患者家属的焦虑、抑郁情绪原因进行分析后发现,女性家属出现不良情绪的程度要高于男性,这可能与女性情感脆弱有关,加之超负荷的照顾任务,使女性更易出现心理障碍。另外,得知疾病无法治愈,目睹患者遭受生理上和心理上的病痛折磨,会导致患者家属对即将离去亲人的预期性悲伤逐渐加重;还有就是在照顾过程中家属与社会联系减少,当家属照顾者独自承受照顾任务而无人帮助时,会感到无助和绝望,极易产生负面情绪。因此,对癌症临终患者的家属实施心理干预具有相当重要的意义。
认知行为疗法是目前应用最广泛、疗效最明确的一种心理治疗方法,主要针对患者不良的认知问题,通过改变患者的思维和信念来改善心理问题[8]。有研究报道,认知行为治疗能明显改善癌症患者的负性情绪,提高患者的生活质量[9-11]。但有关认知行为治疗对癌症临终患者家属的心理状态影响的相关性报道甚少。Scott等研究表明在认知行为治疗明显改善癌症临终患者家属的负性情绪[12]。本研究通过认知行为疗法干预癌症临终患者家属,干预后患者家属的抑郁、焦虑情况较干预前明显改善,而且干预后的HAMD和HADA评分均低于对照组,这与文献报道的结果基本一致。说明了认知行为疗法能明显改善癌症临终患者家属的抑郁、焦虑的不良情绪。
本研究还显示癌症临终患者的家属普遍存在不同程度的睡眠障碍。这可能与患者家属超负荷的照顾任务、医疗费用沉重以及焦虑、抑郁症状等因素相关。更为严峻的是,睡眠障碍不仅会导致体能下降、记忆力减弱等,而且还极易导致不良情绪的发生。肖靖琼[13]等研究证实认知行为疗法能增加人体α脑电波的活动,改善睡眠质量。本研究结果发现干预后患者家属的PSQL评分较干预前明显下降。由此可见,认知行为疗法能明显改善癌症临终患者家属的睡眠质量。
由此可见,癌症临终患者家属普遍存在抑郁、焦虑和睡眠障碍等不良情绪,我们应给予家属更多的关怀,与家属保持连续性沟通,帮助家属积极面对患者即将到来的死亡,预防和减轻家属预感性悲伤,从而减轻患者家属的抑郁和焦虑情绪。本研究虽然证实认知行为疗法能够显著帮助患者家属摆脱消极观念,改善抑郁、焦虑的不良心理情绪,但与患者家属建立良好的信任关系却是认知行为疗法的前提。最重要的是,在临床工作中医护人员应该提高自身素质修养,更新观念,提高认识,有意识地加强对癌症临终患者家属的心理干预,促进其身心恢复。
综上所述,认知行为疗法能够明显改善癌症临终患者家属的不良心理问题,值得在医疗实践中推广和使用,但需要进一步深入研究。
〔参考文献〕
[1] Song JI, Shin DW, Choi JY, et al. Quality of life and mental health in family caregivers of patients with terminal cancer[J]. Support Care Cancer, 2011,19(10):1519-1526.
[2] Hwang D, Teno JM, Clark M, et al. Family perceptions of quality of hospice care in the nursing home[J]. J Pain Symptom Manage, 2014,48(6):1100-1107.
[3] Buysse DJ, Reynolds CF 3rd, Monk TH, et al. The Pittsburgh Sleep Quality Index: a new instrument for psychiatric practice and research[J]. Psychiatry Res, 1989,28(2):193-213.
[4] Beneke M. Methodological investigations of the Hamilton Anxiety Scale[J]. Pharmacopsychiatry, 1987,20(6):249-255.
[5] Worboys M. The Hamilton Rating Scale for Depression: The making of a “gold standard” and the unmaking of a chronic illness, 1960-1980[J]. Chronic Illn, 2013, 9(3):202-219.
[6] 郑家萍,孙伟,蒋中陶,等. 癌症临终患者家属死亡态度调查与分析[J]. 中国医学伦理学,2014, 27(6):820-822.
[7] Wan-Fei K, Hassan STS, Sann LM, et al. Depression, anxiety and quality of life in stroke survivors and their family caregivers: A pilot study using an actor/partner interdependence model[J]. Electron Physician, 2017, 9(8):4924-4933.
[8] Radu T. Cognitive behavioral therapy and Aaron Beck[J]. J Nerv Ment Dis, 2012, 200(10):840-842.
[9] Faraji J, Mahdavi A, Samkhaniyan E, et al. A review of the effectiveness of cognitive-behavioral group therapy on the reduction of body image concern in patients with breast cancer[J]. J Med Life, 2015,8(4):82-86.
[10] 陈良珠,谢忠,黄钢,等. 认知行为干预乳腺癌病人生存质量[J].中国临床康复,2002,6(18):2686-2687.
[11] 宋江艳,王维利,李惠萍. 肿瘤化疗伴发抑郁患者认知行为治疗的现状与展望[J]. 中国实用护理杂志,2009,25(8):51-53.
[12] Scott K, Beatty L. Feasibility study of a self-guided cognitive behaviour therapy internet intervention for cancer carers[J]. Aust J Prim Health, 2013, 19(4):270-274.
[13] 肖靖琼,周郁秋,张秀花,等. 认知行为疗法结合脑电生物反馈干预对护士亚健康失眠状态的影响[J]. 护理学杂志,2011,26(21):9-12.

