三种具有相同结构多肽的抗氧化功能构效关系的研究
李婉如,陈静,汪超,李阜烁,袁芳豪,占东升,梁世排,张少辉,2
(1.上海交通大学农业与生物学院,上海 200240;2.浙江辉肽生命健康科技有限公司,浙江 温州 325800;3.浙江熊猫乳业集团股份有限公司,浙江 温州 325800)
0 引 言
牛乳中最具营养价值的是蛋白质,而酪蛋白又是牛乳蛋白中的主要组成部分,约占80%,被称为牛乳体系中质量最高的蛋白。酪蛋白独特的氨基酸组成是婴幼儿成长所必需的,也是多种生物活性多肽的丰富来源,这些生物活性多肽在人体心血管、免疫系统和消化系统中均扮演着重要的角色[1]。
酪蛋白的水解产物被多次报道具有抗氧化能力。Suetsuna K等[2]从酪蛋白水解物中分离出一种生物活性多肽YFYPEL,该多肽被验证具有很强的体外[DPPH·]自由基清除能力和羟基自由基清除能力。Li Z等[3]对比检测了山羊奶酪蛋白和山羊奶酪蛋白水解物及从中鉴定得到的寡肽三者的抗氧化活性,发现山羊酪蛋白水解物的抗氧化活性相比未水解前提高了近300倍,五个抗氧化活性多肽其活性相比山羊酪蛋白也有不同程度的提高。
本课题组前期研究利用瑞士乳杆菌分解牛奶酪蛋白时,从水解产物中发现了三种具有相同氨基酸结构的多肽DELQ、DELQDKIH和DELQDKIHPF。为了探索这三种多肽是瑞士乳杆菌分解牛奶酪蛋白产生的中间产物还是最终发挥活性的功能性物质,本文从功能活性方面来探究这一现象的机理,利用DPPH法和ABTS法测定体外抗氧化能力,进而探究多肽的氨基酸种类、数量和排列顺序与其抗氧化能力之间的关系,为开发具有抗氧化功能、增强免疫活性的乳制品、保健品等奠定基础。
1 实 验
1.1 材料
1,1-二苯基-2-三硝基苯苦肼(DPPH自由基),总抗氧化能力检测试剂盒(ABTS自由基)包括:(1)1 mL ABTS溶液;(2)1 mL氧化剂溶液;(3)0.5 mL Trolox溶液(水溶性维生素E),人工合成多肽DELQ、DELQDKIH和DELQDKIHPF。
1.2 设备
分析天平,96孔培养板,Tecan infinite M200 pro酶标仪
1.3 方法
1.3.1 试剂的配制
0.1 mmol/L[DPPH·]甲醇溶液:称取19.72 mg DPPH晶体,溶解在500 mL甲醇中,可配得0.1 mmol/L[DPPH·]甲醇溶液,注意避光保存,现配现用。
ABTS工作液:按1∶1的比例混合ABTS溶液与ABTS氧化剂溶液配制成ABTS工作母液,于室温下避光静置12-16 h后方可使用,注意避光保存,可用2~3 d。实验前,用PBS把ABTS工作母液稀释成工作液,稀释条件是使ABTS工作液的在734 nm的波长下吸光值减去相应的PBS空白对照后为0.7±0.05,稀释完成后工作液避光保存,现配现用。
1.3.2 目标多肽的选择
在瑞士乳杆菌分解牛奶酪蛋白的基础研究结果中选择具有相同氨基酸结构的相似多肽,进行抗氧化活性测定。
1.3.3 DPPH法测定多肽的抗氧化能力
根据表1,将各组别合成多肽配制成3个浓度,按1∶1的比例加入0.1 mmol/L[DPPH·]甲醇溶液,于室温下避光静置反应30 min,取200 μL反应溶液于96孔板,设5个复孔。在517 nm波长下测定吸光值。
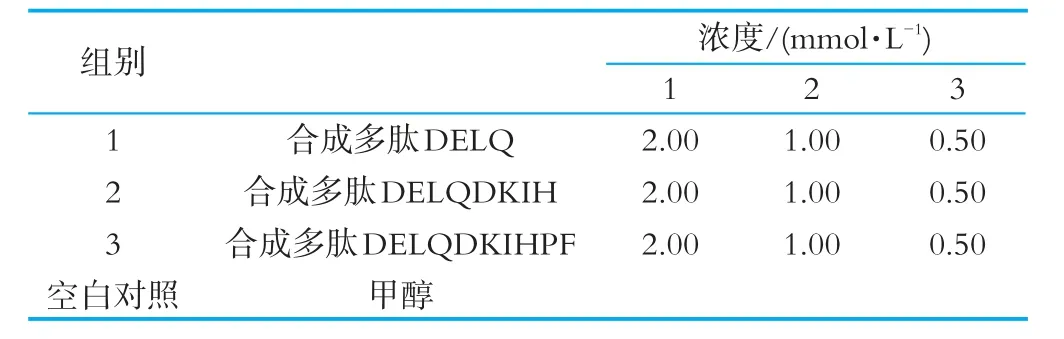
表1 测定合成多肽清除DPPH自由基的体外抗氧化能力
清除率的计算公式如下:

式中:A0——空白对照组的吸光值,As——样品组的吸光值
1.3.4 ABTS法测定多肽的体外总抗氧化能力
Trolox标准曲线的测定:根据表2,将10 mol/L的Trolox标准溶液稀释成8个浓度。取10 μL与200 μL ABTS工作液混合加入96孔板,设5个复孔,空白对照为10 μL PBS和200 μL ABTS工作液的混合。轻轻摇晃1 min,室温孵育4 min后,在734 nm波长下测定吸光值。

表2 Trolox标准曲线溶液的配制
合成多肽ABTS体外总抗氧化能力的测定:根据表3,将各组别合成多肽配制成5 mg/mL溶液。取10 μL与200 μL ABTS工作液混合加入96孔板,设5个复孔,空白对照为10 μL PBS和200 μL ABTS工作液的混合。轻轻摇晃1 min,室温孵育4 min后,在734 nm波长下测定吸光值。

表3 ABTS法测定合成多肽的总抗氧化能力
总抗氧化能力的计算公式如下:
总抗氧化能力(mmol/g)=CTrolox/Cs
式中:CTrolox——与样品吸光值相同的Trolox标准溶液浓度(mmol/L)
Cs——合成多肽样品的浓度(mg/mL)
2 结果与讨论
2.1 目标多肽的确定
本课题基础研究对瑞士乳杆菌发酵牛奶酪蛋白的粗分离物经消化处理后得到的产物进行了超高效液相色谱-质谱分析,最终选择三种具有相同氨基酸结构的多肽DELQ、DELQDKIH和DELQDKIHPF。图1、图2和图3分别是DELQ、DELQDKIH和DELQDKIHPF的质谱图结果。经Masslynx软件分析,多肽序列DELQ、DELQDKIH和DELQDKIHPF分别为β-casein的第43-46、43-50和43-52位的氨基酸残基,氨基酸序列分别为Asp-Glu-Leu-Gln、Asp-Glu-Leu-Gln-Asp-Lys-Ile-His和Asp-Glu-Leu-Gln-Asp-Lys-Ile-His-Pro-Phe,分子量大小分别为503.23 u、996.50 u和1241.38 u。发现这三种多肽均含有相同的氨基酸结构DELQ,且DELQDKIH和DELQDKIHPF包含了DELQ,DELQDKIHPF又包含了DELQDKIH。瑞士乳杆菌水解酪蛋白产生的多肽大多都是为生命活动所利用的有益物质,其中发现的这三种多肽是瑞士乳杆菌水解酪蛋白过程中的中间产物还是水解产生的最终发挥活性的功能性物质,值得进一步探索。
2.2 DPPH法测定多肽抗氧化能力实验结果

图1 质荷比为504.23的DELQ一级质谱图

图2 质荷比为449.21的DELQDKIH一级质谱图

图3 质荷比为621.31的DELQDKIHPF一级质谱图
分别测定合成多肽DELQ、DELQDKIH、DELQD⁃KIHPF体外清除[DPPH·]自由基的能力。结果如图4和图5所示,相对于空白组来说,三种多肽的吸光值均有一定程度的降低,均显示出一定的清除[DPPH·]自由基能力。并且对于每种多肽来说,多肽的清除[DPPH·]自由基能力都与浓度呈一定的正相关,在0.50-2.00 mg/mL范围内,随着多肽浓度的降低,其清除自由基的能力也有所减弱。图1所示,在一定浓度范围内,DELQDKIH清除[DPPH·]自由基的能力整体略高于DELQ和DELQDKIHPF,而图2更直观地从清除[DPPH·]自由基的IC50值显示了DELQDKIHPF较强的抗氧化能力。
这三种多肽DELQ、DELQDKIH、DELQDKIHPF清除[DPPH·]自由基的能力应该得益于末端的天冬氨酸(Asp)和亮氨酸(Leu)。Tsuge N[4]通过研究证明氨基酸本身的性质对组成多肽生物活性具有一定影响,Asp等极性氨基酸可以通过侧链的氨基或是羰基进行螯合作用进而抑制自由基的氧化。Giménez B等[5]研究亮氨酸(Leu)和羟脯氨酸(Hyp)残基对多肽序列的抗氧化活性影响时,用Leu和Hyp残基分别取代序列Gly-Pro-X-Gly-X-X-Gly-Phe-X-Gly-Pro-X-G ly-X-Ser中的X位置,以及Leu部分取代X位置后,测定三种多肽的抗氧化活性,发现Leu取代X位置的多肽其总抗氧化能力(ABTS法)远高于其它两种多肽。
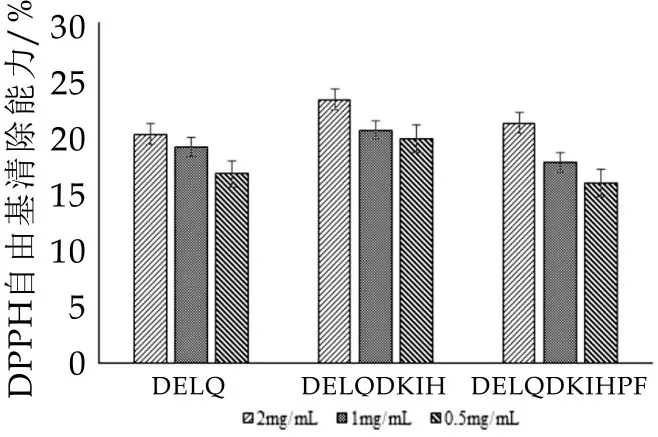
图4 合成多肽清除DPPH自由基的体外抗氧化能力
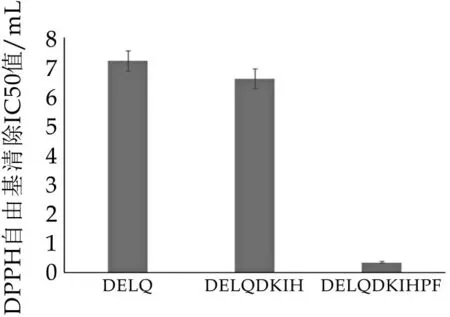
图5 合成多肽清除DPPH自由基的IC50值
而相对于DELQ,DELQDKIH和DELQDKIHPF两者体外清除[DPPH·]自由基的能力较高,这应该归功于他们的两端暴露的组氨酸(His)和芳香族氨基酸苯丙氨酸(Phe)。有研究从大豆水解物[6]和鸡蛋白的蛋白水解物[4]中分离提取得到抗氧化肽,其抗氧化活性被归功于His,因为His的咪唑基团具有提供质子的能力。研究表明,抗氧化活性不仅与His是否存在有关,还与His残基存在的数量和位置有很大的关系,如HDHPVC的抗氧化活性相比HEKVC强很多,可能与His残基在抗氧化活性多肽中的数量有关系[7]。Saiga A等[8]研究发现当His处于多肽序列的中间时,其抗氧化活性明显增强。Huaming Chen等[9]设计比较28种来源于大豆蛋白的多肽清除[DPPH·]自由基实验,结果发现组氨酸(His)和脯氨酸(Pro)在多肽的抗氧化生物活性中扮演着极其重要的角色,在所有的这些合成多肽中,清除[DPPH·]自由基能力最强的多肽序列为Pro-His-His。而芳香族氨基酸的暴露能显著地提高生物活性肽的抗氧化能力。Rojas-Ronquillo R等[10]从酸奶中分离得到了一个含有17个氨基酸的多肽YQEPVLGPVRGPFPIIV,研究发现经消化酶降解的酪氨酸(Tyr)、苯丙氨酸(Phe)等芳香族氨基酸暴露在两端的多肽比其他多肽表现出更好的抗氧化能力。Yamaguchi N[11]也在研究氨基酸对脂类抗氧化能力的实验中证明,在20种氨基酸中酪氨酸(Tyr)、色氨酸(Trp)和甲硫氨酸(Met)表现出了显著抑制亚油酸氧化的抗性,说明芳香族氨基酸本身就具有较好的抗氧化活性。
2.3 ABTS法测定多肽总抗氧化能力实验结果
2.3.1 Trolox标准曲线的测定
ABTS在活性氧、羟基自由基、过氧化氢和超氧自由基等氧化剂作用下会被氧化成绿色的ABTS+,而当有抗氧化活性的物质存在时便能够抑制这种氧化反应,阻止ABTS+的产生。在734 nm处测定反应液的吸光值,可以得到ABTS+生成量,并通过公式计算出多肽的总抗氧化能力。通常吸光值越小,证明生成的绿色的ABTS+越少,说明该物质的抗氧化能力越强。其中,Trolox(水溶性维生素E)为参考物质,其总抗氧化能力为1,在相同浓度下,被测物质的抗氧化能力可以其抗氧化能力和Trolox相比的倍数来表示。
Trolox标准曲线的结果如图6所示,通过Excel的线性拟合,可见Trolox标准曲线线性关系较好,相关系数达到了0.9973。说明Trolox标准曲线测定的精确度和准确度都符合检测要求,能被用于后续计算。

图6 Trolox标准曲线
2.3.2 合成多肽的ABTS体外总抗氧化能力测定
分别测定合成多肽DELQ、DELQDKIH、DELQDKIHPF体外总抗氧化能力,结果如图7所示。相对于空白组来说,三种多肽都表现出了一定的抗氧化能力,总抗氧化力大小为DELQ﹤DELQDKIH﹤DELQDKIHPF。

图7 合成多肽的体外总抗氧化能力
DELQDKIHPF的抗氧化活性相对于DELQD⁃KIH强一些,是因为含有脯氨酸(Pro)的一些多肽被认为具有很强的抗氧化能力,脯氨酸(Pro)通过其侧链的吡咯环阻止肽段的折叠缠绕,打断多肽的二级结构,而这些二级结构会抑制多肽发挥活性,从而使多肽暴露更多的位点或侧链用于抗氧化反应[12-13]。本研究中天冬氨酸(Asp)、亮氨酸(Leu)、组氨酸(His)、苯丙氨酸(Phe)和脯氨酸(Pro)这些氨基酸残基的存在会增强多肽序列的抗氧化能力,使多肽可作为抗氧化物质使用。此外,还有研究报道,被称为抗氧化剂氨基酸的色氨酸(Trp),酪氨酸(Tyr),甲硫氨酸(Met)和半胱氨酸(Cys)也都被认为是抗氧化活性多肽中的典型氨基酸[14]。疏水性残基包括缬氨酸(Val)、亮氨酸(Leu)和异亮氨酸(Ile)因其特殊的结构,能通过增强多肽在脂质中的溶解性,从而更好地与自由基发生反应,最终抑制脂质过氧化反应[15-16]。Lin S等[17]测定了QCHKP、QCHQP、KCHKP和KCHQP 4种多肽的抗氧化活性,结果显示QCHKP﹤QCHQP﹤KCHKP﹤KCHQP,发现K和Q的位置及数量变化对于抗氧化活性是有一定影响的,当K和Q处于肽段序列中间时,Q的多肽抗氧化活性强于K的;当K和Q位于肽段C端时,K的多肽抗氧化活性反而强于Q的。
综上,虽然DELQ、DELQDKIH和DELQDKIH⁃PF这三种多肽的氨基酸组成相似,具有包含与被包含的关系,分子量也依次增大,且都含有一些已经被证明具有抗氧化能力的氨基酸,但连接成肽段后所表现出的抗氧化活性却不相同,呈现依次增大的态势。卢珊珊等[18]利用瑞士乳杆菌发酵脱脂乳获得生物活性多肽QEPVL及其降解产物QEPV,经过体外抗氧化实验和体外免疫功能促进实验,验证QEPV相比QEPVL具有更强的抗氧化活性和促进细胞免疫的活性。Su⁃etsuna K[2]从酶解的酪蛋白产物中分离得到活性多肽YFYPEL,在研究其构效关系时,分别对EL,PEL,YPEL,FYPEL和YFYPEL这5种形式做抗氧化活性分析,结果表明PEL﹤YPEL﹤FYPEL﹤YFYPEL﹤EL。虽然由具有相似作用的氨基酸组成,但他们还是表现出一定的活性差异,说明氨基酸只有分布在肽段的合适位点才能有效地提高多肽的活性,EL的最高抗氧化能力则被解释为其作用核心片段的暴露。本文中DELQ肽段最短,抗氧化活性却不是最强;DELQDKI⁃HPF肽段最长,抗氧化活性却是最强的。由此可以推断,DELQ不是瑞士乳杆菌水解酪蛋白产生的最终发挥最强活性的功能性核心片段,DELQDKIH和DELQDKIHPF的可能性也不大,三者多数是瑞士乳杆菌水解过程中的中间产物。结果表明,多肽的抗氧化能力与氨基酸的种类、数量和排列顺序等都密切相关,通常抗氧化能力较高的氨基酸暴露在肽段两端会使其显示较好的抗氧化活性[19]。
此外,分子的抗氧化性质取决于许多因素,如直接清除活性氧的能力,提供氢原子或将电子转移到自由基化合物的能力以及螯合过渡金属如铜和铁的能力[20]。DPPH法和ABTS法这两种体外抗氧化能力的测定方法并没有直接一对一的对应关系,两者原理不同,前者是淬灭自由基以阻止氧化链式反应的发生,后者基于清除各种活性氧以抑制活性氧诱导产生的氧化应激反应。而且两者都属于体外的表观指标,真正的抗氧化活性确定还需要进一步体内实验的验证。
3 结论
本实验选择前期研究瑞士乳杆菌发酵牛奶酪蛋白产生的三种具有相同氨基酸结构的多肽DELQ、DELQDKIH和DELQDKIHPF,利用DPPH法和ABTS法测定了抗氧化活性,结果发现这三种多肽都表现出一定的抗氧化能力,活性大小顺序为DELQ<DELQDKIH<DELQDKIHPF,在一定浓度范围内,抗氧化活性随着浓度的增大而增大。且三者多数是瑞士乳杆菌分解牛奶酪蛋白产生的中间产物,而非最终功能性物质。在此基础上从抗氧化多肽的氨基酸种类、数量和排列顺序等方面探究了其与多肽抗氧化活性之间的关系,探索了抗氧化肽的抗氧化机理。不过这三种抗氧化肽的体内实验仍有待进一步开展和完善,为今后抗氧化肽保健品、化妆品以及药物的开发奠定基础。
[1]SILVA S V,MALCATA F X.Caseins as source of bioactive peptides[J].International Dairy Journal,2005,15(1):1-15.
[2]SUETSUNA K,UKEDA H,OCHI H.Isolation and characterization of free radical scavenging activities peptides derived from casein[J].Journal of Nutritional Biochemistry,2000,11(3):128-131.
[3]LI Z,JIANG A,YUE T,et al.Purification and identification of five novel antioxidant peptides from goat milk casein hydrolysates[J].Jour⁃nal of Dairy Science,2013,96(7):4242-4251.
[4]TSUGE N,EIKAWA Y,NOMURA Y,et al.Antioxidative Activity of Peptides Prepared by Enzymatic Hydrolysis of Egg-white Albumin[J].Nippon Nogeikagaku Kaishi,1991,65(11):1635-1641.
[5]GIMÉNEZ B,PÉREZ-SANTIN E,GÓMEZ-GUILLÉN M C,et al.Contribution of Leu and Hyp residues to antioxidant and ACE-in⁃hibitory activities of peptide sequences isolated from squid gelatin hy⁃drolysate[J].Food Chemistry,2011,125(2):334-341.
[6]CHEN H M,MURAMOTO K,YAMAUCHI F.Structural Analysis of Antioxidative Peptides from Soybean.beta.-Conglycinin[J].Jagric⁃food Chem,1995,43(3):574-578.
[7]JIANG H,TONG T,SUN J,et al.Purification and characterization of antioxidative peptides from round scad(Decapterus maruadsi)mus⁃cle protein hydrolysate[J].Food Chemistry,2014,154(2):158-163.
[8]SAIGA A,TANABE S,NISHIMURA T.Antioxidant Activity of Peptides Obtained from Porcine Myofibrillar Proteins by Protease Treatment[J].Journal of Agricultural&Food Chemistry,2003,51(12):3661-3667.
[9]HUAMING CHEN,KOJI MURAMOTO,FUMIO YAMAUCHI A,et al.Antioxidant Activity of Designed Peptides Based on the Anti⁃oxidative Peptide Isolated from Digests of a Soybean Protein[J].Jour⁃nal of Agricultural&Food Chemistry,2014,44(9):2619-2623.
[10]ROJAS-RONQUILLO R,CRUZ-GUERRERO A,FLORES-N JERA A,et al.Antithrombotic and angiotensin-converting enzyme inhibitory properties of peptides released from bovine casein by Lac⁃tobacillus casei Shirota[J].International Dairy Journal,2012,26(2):147-154.
[11]YAMAGUCHI N.Studies on Antioxidative Activities of Amino Compounds on Fats and Oils[J].Bulletin of the Farms-Tokyo University of Agriculture and Technology(Japan),1975,18(7):313-318.
[12]LI B,CHEN F,WANG X,et al.Isolation and identification of anti⁃oxidative peptides from porcine collagen hydrolysate by consecutive chromatography and electrospray ionization–mass spectrometry[J].Food Chemistry,2007,102(4):1135-1143.
[13]TSOPMO A,ROMANOWSKI A,BANDA L,et al.Novel an⁃ti-oxidative peptides from enzymatic digestion of human milk[J].Food Chemistry,2011,126(3):1138-1143.
[14]BABINI E,TAGLIAZUCCHI D,MARTINI S,et al.LC-ESI-QTOFMS identification of novel antioxidant peptides obtained by enzymat⁃ic and microbial hydrolysis of vegetable proteins[J].Food Chemistry,2017,228(186–196.
[15]PUCHALSKA P,MARINA M L,GARCÍA M C.Isolation and identificationofantioxidantpeptidesfromcommercialsoy⁃bean-based infant formulas[J].Food Chemistry,2014,148(2):147-154.
[16]SAMPATH KUMAR N S,NAZEER R A,JAIGANESH R.Purifi⁃cation and biochemical characterization of antioxidant peptide from horse mackerel(Magalaspis cordyla)viscera protein[J].Peptides,2011,32(7):1496-1501.
[17]LIN S,LIANG R,XUE P,et al.Antioxidant activity improvement of identified pine nut peptides by pulsed electric field(PEF)and the mechanism exploration[J].LWT-Food Science and Technology,2017,75(366-372.
[18]卢姗姗,郭海滨,付丽娜.瑞士乳杆菌发酵乳中多肽的分离对小鼠体外淋巴细胞增殖的影响[J].食品科技,2011,36(2):61-64.
[19]徐力,李相鲁,吴晓霞.一种新的玉米抗氧化肽的制备与结构表征[J].高等学校化学学报,2004,25(3):466-469.
[20]LU J M,LIN P Q,CHEN C.Chemical and molecular mechanisms of antioxidants:experimental approaches and model systems[J].Jour⁃nal of Cellular&Molecular Medicine,2010,14(4):840-860.

