血管与斑块内出血同时成像序列对Willis环完整性的评价
陈亚伦,何乐,陈慧军,赵锡海,陈振森,唐玲*
1.重庆医科大学附属大学城医院,重庆 401331;2.清华大学生物医学影像研究中心,北京 100084;
卒中严重危害人类健康,居疾病死亡原因的第2位[1]。良好的侧支循环可以减少梗死灶容积、改善卒中预后,降低复发风险[2-4]。而Willis环作为主要的颅内侧支循环途径,其完整性与脑卒中的预后相关[2,4]。因此,评价Willis环的健康状况对于选择脑卒中治疗方案十分重要。
非造影增强血管与斑块内出血同时成像(simultaneous non-contrast angiography and intra-plaque hemorrhage,SNAP)是一种黑血成像技术,不仅能评估血管壁的动脉粥样硬化斑块和识别斑块内出血,还能作为一种非对比增强的磁共振血管造影(MRA)技术[5]。目前,三维时间飞跃法磁共振血管成像(three-dimensional time of flight,TOF)作为一种非对比增强MRA技术,常用于评估颅内血管的狭窄程度[6],其与 DSA具有良好的一致性[7],也用于评价大脑Willis环的完整性[8-9]。与TOF技术相比,SNAP技术可以更好地显示颅内小血管[10],在Willis环评估中具有很大潜力,且目前国内外相关研究鲜有报道。此外,颅内血管管壁斑块的评估已成为学术界的研究热点,目前常用黑血 T1WI的各向同性的高分辨率快速自旋回波(volumetric isotropic turbo spin echo acquisition,VISTA)[11]技术进行评估,而SNAP技术还有可能对 Willis环血管上的斑块进行评估。因此,本研究通过比较SNAP和TOF对Willis环完整性的评估能力及 SNAP和 VISTA技术对Willis环血管斑块的评估能力,探讨SNAP在脑卒中的临床应用价值。
1 资料与方法
1.1 研究对象 患者资料来源于清华大学生物医学影像研究中心,收集于2014年3月至2016年10月,并经诊治考虑为脑血管病患者。本研究为前瞻性研究。入组标准:①年龄>18岁;②首发缺血性脑卒中的症状性患者;③经超声检查排除颈动脉斑块导致的卒中;④经颅多普勒超声检查发现大脑中动脉狭窄;⑤在脑卒中发作2周到3个月内可进行MRI检查;⑥患者一般情况良好。排除标准:①幽闭恐惧症;②存在MRI检查的禁忌证(血管支架、心脏起搏器、体内存在金属或磁性植入物);③心房颤动、瓣膜疾病等有可能产生心源性血栓的疾病;④有心脏、呼吸或肝肾功能衰竭者。本研究通过伦理委员会审核(项目编号20140009),且所有受试者知情同意。共纳入62例患者,男38例,女24例;年龄40~73岁,平均(58.2±8.9)岁;40例患有高血压,29例患有糖尿病。
1.2 仪器与方法 患者均行头部 MRI扫描,采用Philips Achieva 3.0T MR扫描仪和32通道头部接收线圈,针对Willis环进行以下成像:①3D TOF成像序列产生MRA;②3D SNAP序列黑血血管壁成像。TOF成像扫描参数:TR 25.0 ms,TE 3.5 ms,反转角20°,视野180 mm×180 mm×83 mm,矩阵256 mm×256 mm×120 mm。SNAP成像扫描参数:TR 10.0 ms,TE 5.5 ms,反转角11°,视野160 mm×160 mm×60 mm,矩阵200 mm×200 mm×150 mm。对其中15例患者进行3D T1 VISTA序列的扫描,扫描参数:TR 800.0 ms,TE 20.0 ms,反转角90°,视野200 mm×181 mm×40 mm,矩阵200 mm×200 mm×133 mm。
1.3 图像分析及完整性评价 由 1名有2年以上相关工作经验的神经内科医师对 MRI图像进行判读,采用盲法阅片。所有图像后处理和判读分析均在Philips图像处理工作站上进行。①使用3D TOF进行Willis环完整性评价:首先使用最大强度投影法对3D TOF图像进行处理,产生Willis环的MRA,进而评估Willis环的完整性。②使用3D SNAP黑血成像进行 Willis环评价:由于在 SNAP图像中存在相位信息,而且只有血是负值,因此可以使用最小强度投影法对3D SNAP图像进行处理,产生Willis环的MRA图像,进而判断Willis环的完整性。完整的Willis环包括双侧大脑前动脉交通前段 A1、双侧颈内动脉终端(the internal carotid artery,ICA)、大脑前交通动脉(anterior communicating artery,ACoA)、双侧大脑后动脉交通前段P1、基底动脉(basilar artery,BA)和双侧后交通动脉(posterior communicating artery,PCoA)。本研究中判断Willis环上各血管是否存在的标准是当血管的起始端和终端在相应MRA上均能够显示时,认为该血管存在[12]。研究血管主要包括双侧大脑前动脉A1、ACoA、双侧大脑后动脉P1和PCoA。进而,完整的Willis环定义为构成Willis环的上述所有血管均存在,否则定义Willis环不完整。同时,为了研究使用SNAP序列和TOF序列进行Willis环完整性评估的可重复性,在第一次判读2周后,再对所有患者的TOF和SNAP图像进行二次判读,判读标准同第一次相同。③在15例进行VISTA成像的患者中,使用SNAP及VISTA成像对Willis环血管壁斑块进行评价:判断组成Willis环血管管壁是否有增厚或高信号存在,如有增厚或高信号存在,则判定为有斑块。
1.4 统计学方法 采用SPSS 20.0软件,计量资料以±s表示,采用Kappa一致性检验比较SNAP和TOF的一致性。在可重复性研究中也使用Kappa一致性检验,Kappa值>0.7表示有较高的可重复性。P<0.05表示差异有统计学意义。
2 结果
2.1 使用SNAP和TOF进行Willis环完整性评估的可重复性 SNAP和TOF判断Willis环的完整性均有较高的可重复性(Kappa值=0.815、0.816);SNAP和 TOF对组成 Willis环的不同血管 LA1、RA1、LP1、RP1、LPCoA的可重复性均较高;对于RPCoA,SNAP图像判读的可重复性高于 TOF图像;而对AcoA的图像判读可重复性均处于中等水平(表1)。

表1 SNAP和TOF两次判读结果的一致性检验结果
2.2 用SNAP和TOF进行Willis环完整性评估的一致性比较 在两次判读的结果中(表2),使用SNAP对Willis环整体完整性的判读与使用TOF的判读结果均具有较高的一致性(Kappa值=0.701、0.742)。而在Willis各组成血管的判读中,用SNAP和用TOF判读完全一致的血管包括 LA1、RA1、LP1和 RP1(Kappa值=1.000)。而使用两种成像技术判读的结果一致性较高的血管包括LPCoA(Kappa值=0.852、0.848)和 RPCoA(Kappa值=0.796、0.796)。在 ACoA血管有无的判断上,使用SNAP和TOF的两次判读结果一致性均稍低(Kappa值=0.680、0.714)。图1~3展示了代表性的SNAP和TOF对Willis环完整性及各血管的成像进行判断的对比图,其中图 1显示Willis环的各血管均存在并在SNAP和TOF中均可看到的实例,而图2和图3显示使用两种成像在血管判断上出现不同的情况。

表2 SNAP和TOF对构成Willis环的各血管及完整性的一致性评估(支)
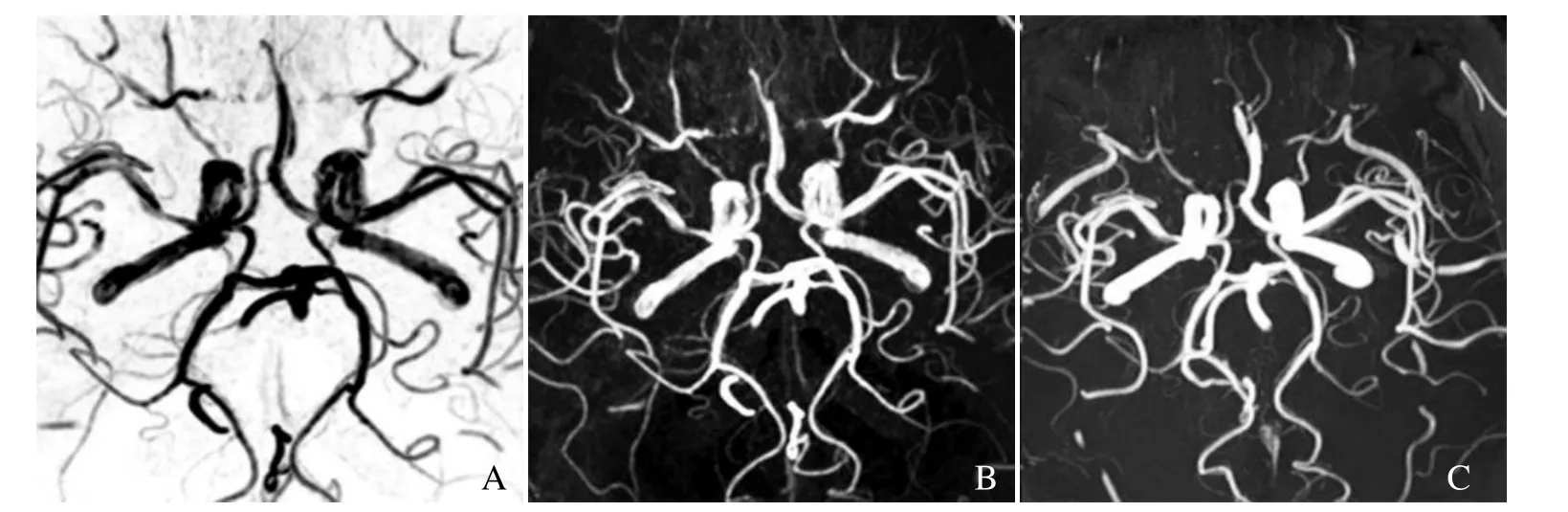
图1 SNAP和TOF Willis环血管成像结果一致的典型代表图。A为使用最小强度投影法对SNAP图像处理产生的MRA图像;B为A图的翻转图;C为使用最大强度投影法对TOF图像处理产生的MRA图像

图2 ACoA在TOF上可见,在SNAP上不可见的典型图。A为使用最小强度投影法对SNAP图像处理产生的MRA图像;B为A的反转图,A、B中箭示ACoA的位置,由于一端不清楚,被判定为ACoA不存在;C为使用最大强度投影法对TOF图像处理产生的MRA图像,箭示ACoA可见,被判定为存在;D、E为SNAP的原始图像,箭示ACoA确实不清
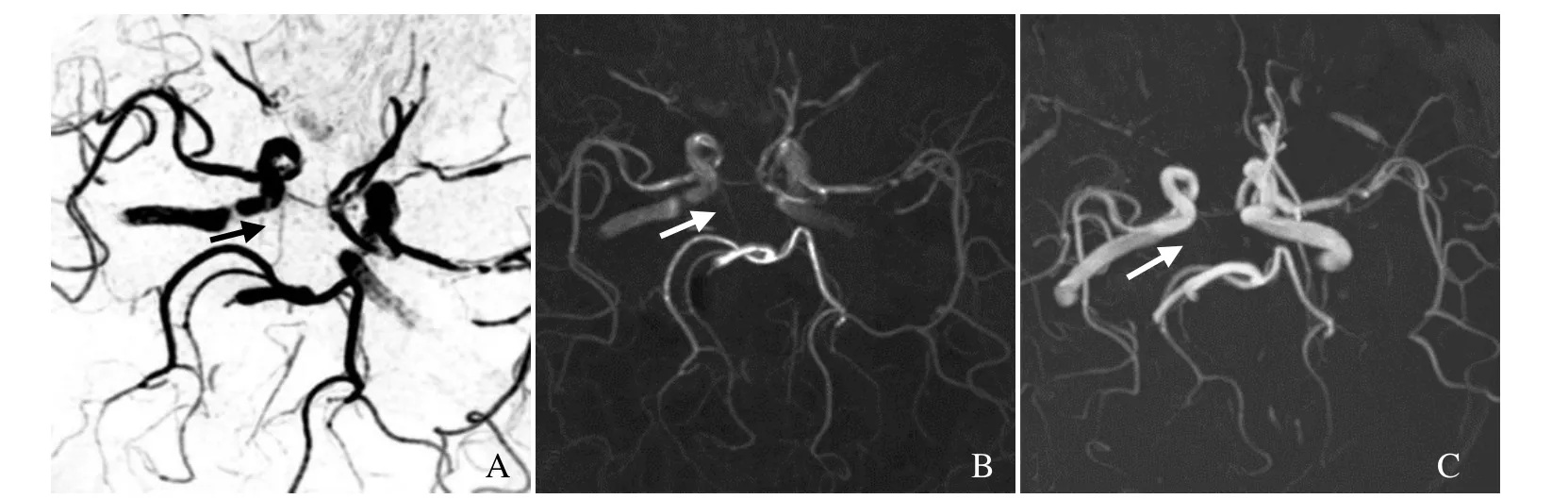
图3 PCoA在TOF上不可见,在SNAP上可见的典型图。A为使用最小强度投影法对SNAP图像处理产生的MRA图像;B为A的反转图,A、B中箭示PCoA的位置,由于显示清楚,被判定为PCoA存在;C为使用最大强度投影法对TOF图像处理产生的MRA图像,箭示PCoA不可见,被判定为不存在
2.3 三维SNAP黑血成像及三维VISTA序列对Willis环血管壁斑块的评价 SNAP和VISTA对Willis环血管壁斑块的评估结果一致。15例患者中,9例发现有斑块存在,共发现 16处斑块,9处(56.2%)分布于大脑后动脉P1段,7个(43.8%)斑块分布于大脑后动脉与基底动脉的交界处。图4为 SNAP和 VISTA成像显示 P1段及 P1段与基底动脉交界处斑块的典型图,尽管SNAP图像可以看到血管壁的增厚变化,但少于 VISTA图像所见。
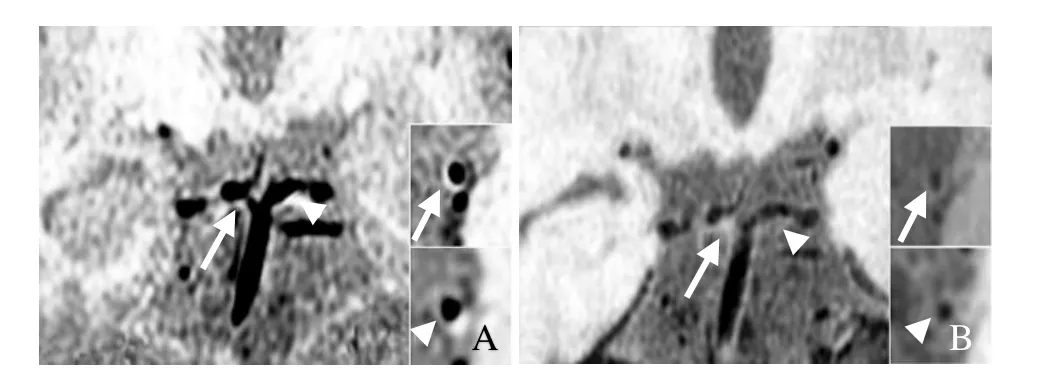
图4 SNAP(A)和VISTA(B)成像显示P1段及P1段与基底动脉交界处的斑块典型图。箭示斑块存在位置:A、B中的箭头显示P1段上的斑块位置,小图中箭头显示在血管的横截面图上对应位置可见血管壁增厚;箭示P1段与基底动脉交界处的斑块位置,小图中箭示在血管的横截面图上对应位置可见血管壁增厚
3 讨论
大脑Willis环作为主要的颅内侧支循环途径[13],其状态与卒中的发生、进展和结局有较强的相关性。新提出的SNAP MRA作为一种新的非对比增强MRA技术[5],具有广阔的临床应用前景,其在颅内动脉中的研究已有报道[10],但在评估Willis环完整性方面目前鲜有研究。本研究采用SNAP和TOF技术对62例患者的Willis环完整性情况进行评估比较,发现SNAP与TOF具有较高的一致性,并可评价各个Willis环上各血管的有无,并且重复性较好。
在显示Willis环的各血管方面,尤其是LPCoA、RPCoA、LA1、RA1、LP1和RP1血管,SNAP和TOF的成像结果一致性较好(Kappa值>0.79)。SNAP评价Willis环各血管可重复性也较好(除ACoA外,其他所有血管Kappa值>0.81)。既往研究发现,与TOF相比,SNAP能更好地显示较小的血管[10];本研究发现 SNAP在 Willis环的显示上与 TOF较为接近。SNAP技术显示部分小血管的性能较好,而在ACoA中,SNAP技术显示的血管不如TOF,其可能原因是由于SNAP是基于翻转恢复的成像技术,其血液的对比度理论上虽不易受到血流的影响,但是MR本身的不完美导致其成像效果会受到影响。首先,在靠近鼻腔、口腔等存在空洞的组织附近 B1场不均匀导致180º翻转不够,会降低其血管显示的对比度;其次,由于MR的B1场大小有限,会存在一部分在180º翻转区域外的血流流进成像区域,导致其血管显示问题;此外,血管中一部分较慢的血流无法流出成像区域,会受到多次翻转脉冲的激发,也会导致对比度降低,这种情况特别是在Willis环的小交通动脉中会存在。值得注意的是,在对ACoA血管的判断上,使用SNAP和TOF的判读结果一致性在所有Willis环的血管中最低,而且不管是SNAP还是TOF,使用其非对比增强图像评价 ACoA血管有无的可重复性在所有血管中最差。上述结果表明ACoA血管的评估对于SNAP和 TOF均存在一定的困难。这可能是由于ACoA血管本身直径较小,从而导致SNAP和TOF技术对ACoA的成像不清晰。进一步提高SNAP技术的分辨率有可能改善ACoA血管的成像质量,但这样需要更多的重复扫描来保持信噪比。
作为一种黑血MRI技术,SNAP技术较传统的影像学方法具有更多优势。它不需要平行采集即可以到达较高的分辨率水平,并且可以进一步优化。与对比增强MRA相比,不需要注射对比剂[14]。另外,通过相敏重建[15],SNAP技术能够最优化以实现血管腔内信号始终作为负信号呈现,而其他组织为正信号呈现。因此,SNAP技术不需要进行背景抑制,这也避免了额外的图像相减步骤以及其所可能带来的不匹配等问题[16]。本研究结果证明SNAP技术作为一种非对比增强MRA技术在Willis环评估中的有效性,进一步拓展了SNAP技术在颅内血管中的应用。
更重要的是,作为一种黑血成像技术,SNAP技术能够评价Willis环上血管的有无。本研究使用常用于评估颅内血管斑块的VISTA序列[11]作为对比,尽管SNAP技术优化的是低T1值组织的对比度,其对一般血管壁成像的对比度并不好,因此在SNAP图像上管壁的增厚情况小于在VISTA图像看见的增厚情况。但本研究结果表明,在评价Willis环有无血管斑块上,SNAP和 VISTA序列高度一致,初步证明了SNAP序列还能同时评估 Willis环血管管壁上的斑块。因此,该成像技术的多功能性使其有望成为评估颅内动脉粥样硬化患者危险因素的首要影像学工具。
本研究的局限性在于:未应用对比增强的MRA、CTA或 DSA进行比较分析,这是因为这些检查有创,而且对比剂会对肾功能有损害的患者造成不良影响,本研究中心不具备条件进行相关成像。另外,本研究样本量较小。针对上述不足,在后续研究中应增大样本量、运用多种技术手段及组织学或临床“金标准”进行比较分析,更加充分地探索SNAP技术的应用价值。
总之,本研究证实SNAP作为一项新的非对比增强黑血血管成像技术具有评估 Willis环完整性的能力,并表明SNAP技术有可能进行Willis环血管斑块的评价,进一步扩展了SNAP技术在颅内血管评估中的应用。
[1] Kotlega D, Golab-Janowska M, Masztalewicz MA, et al. The emotional stress and risk of ischemic stroke. Neurol Neurochir Pol, 2016, 50(4): 265-270.
[2] Chuang YM, Chan L, Lai YJ, et al. Configuration of the circle of Willis is associated with less symptomatic intracerebral hemorrhage in ischemic stroke patients treated with intravenous thrombolysis. J Crit Care, 2013, 28(2): 166-172.
[3] Christoforidis GA, Mohammad Y, Kehagias D, et al.Angiographic assessment of pial collaterals as a prognostic indicator following intra-arterial thrombolysis for acute ischemic stroke. Am J Neuroradiol, 2005, 26(7): 1789-1797.
[4] Van Seeters T, Hendrikse J, Biessels GJ, et al. Completeness of the circle of Willis and risk of ischemic stroke in patients without cerebrovascular disease. Neuroradiology, 2015,57(12): 1247-1251.
[5] Wang J, Bö rnert P, Zhao H, et al. Simultaneous noncontrast angiography and intraplaque hemorrhage (SNAP) imaging for carotid atherosclerotic disease evaluation. Magn Reson Med, 2013, 69(2): 337-345.
[6] Lan L, Leng X, Abrigo J, et al. Diminished signal intensities distal to intracranial arterial stenosis on time-of-flight MR angiography might indicate delayed cerebral perfusion.Cerebrovasc Dis, 2016, 42(3-4): 232-239.
[7] Van Amerongen MJ, Boogaarts HD, De Vries J, et al. MRA versus DSA for follow-up of coiled intracranial aneurysms:a Meta-Analysis. Am J Neuroradiol, 2014, 35(9): 1655-1661.
[8] Qiu C, Zhang Y, Xue C, et al. MRA study on variation of the circle of Willis in healthy Chinese male adults. Biomed Res Int, 2015: 976340.
[9] He J, Liu H, Huang B, et al. Investigation of morphology and anatomic variations of circle of Willis and measurement of diameter of cerebral arteries by 3D-TOF angiography. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi, 2007, 24(1): 39-44.
[10] Wang J, Guan M, Yamada K, et al. In vivo validation of simultaneous non-contrast angiography and intraplaque hemorrhage (SNAP) magnetic resonance angiography: an intracranial artery study. PLoS One, 2016, 11(2): e0149130.
[11] Qiao Y, Steinman DA, Qin Q, et al. Intracranial arterial wall imaging using three-dimensional high isotropic resolution black blood MRI at 3.0 Tesla. J Magn Reson Imaging, 2011,34(1): 22-30.
[12] Krabbe-Hartkamp MJ, Van Der Grond J, De Leeuw FE, et al.Circle of Willis: morphological variation on MR angiograms.Radiology, 1998, 207(1): 103-111.
[13] Krishnaswamy A, Klein JP, Kapadia SR. Clinical cerebrovascular anatomy. Catheter Cardiovasc Interv, 2010,75(4): 530-539.
[14] Lohan DG, Tomasian A, Saleh RS, et al. Ultra-low-dose,time resolved contrast-enhanced magnetic resonance angiography of the carotid arteries at 3.0 tesla. Invest Radiol,2009, 44(4): 207-217.
[15] Kellman P, Arai AE, Mcveigh E, et al. Phase-sensitive inversion recovery for detecting myocardial infarction using gadolinium-delayed hyperenhancement. Magn Reson Med,2002, 47(2): 372-383.
[16] Remonda L, Senn P, Barth A, et al. Contrast-enhanced 3D MR angiography of the carotid artery: comparison with conventional digital subtraction angiography. Am J Neuroradiol, 2002, 23(2): 213-219.

