三胶扶正合剂联合紫杉醇、奈达铂同步放化疗治疗局部晚期非小细胞肺癌的临床观察Δ
冉毅,夏冬梅,包中会,任洪波#,蒋义,杨吉帆,黄碧有,姚岚,倪燕侠,李少林(.重庆市巴南区第二人民医院肿瘤科,重庆 400054;.重庆医科大学放射肿瘤学教研室,重庆 40006)
肺癌是我国最常见的恶性肿瘤之一,其发病率和病死率均居第一位[1]。据国家癌症中心2015年发布的数据显示,我国肺癌的发病率为0.13%,其中男性/女性患病率之比为2∶1[2]。非小细胞肺癌(Non-small cell lung cancer,NSCLC)约占肺癌比例的85%[3]。40%以上的NSCLC患者在诊断时即为局部晚期或转移[4]。对于局部晚期(Ⅲ期)无法手术的患者,单纯放疗的5年生存率不足10%[5],而同步放化疗可提高5年生存率至17%,因此同步放化疗已成为局部晚期NSCLC患者的标准治疗模式[6]。随着中医药在肿瘤治疗领域研究的不断深入,有研究发现其对肿瘤放化疗具有增敏作用,同时还可改善患者的临床症状及生存质量[7]。补肾健脾类中药三胶扶正合剂由人参、黄芪、当归、茯苓、白术等18味中药制成,具有恢复骨髓造血功能、增强机体免疫功能等作用,与同步放化疗联合治疗局部晚期NSCLC能减轻放化疗引起的不良反应,提高远期疗效[8]。在本研究中笔者观察了三胶扶正合剂联合紫杉醇、奈达铂同步放化疗治疗局部晚期NSCLC的疗效和安全性,旨在为临床提供参考。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)NSCLC 初治患者;(2)功能状态(KPS)评分>80分;(3)预计生存期>6个月;(4)治疗前心电图、肝肾功能、血常规等均无异常;(5)预计可耐受同步放化疗;(6)无糖尿病或免疫系统疾病;(7)治疗前经胸部增强电子计算机断层扫描(CT)、头颅+上腹部CT、腹部B超检查明确肺癌分期。
排除标准:(1)昏迷者;(2)恶性胸腹腔积液患者;(3)依从性差者;(4)对本研究药物过敏者;(5)精神疾病患者;(6)妊娠期或哺乳期妇女。
1.2 研究对象
选择2015年1月-2017年1月我院收治的局部晚期NSCLC患者68例,按随机数字表法将所有患者分为对照组和观察组,各34例。两组患者性别、年龄、国际抗癌协会(UICC)分期、体质量指数(BMI)和欧洲营养风险筛查工具(NRS)2002评分等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。本研究方案经医院医学伦理委员会审核通过,所有患者均知情同意并签署了知情同意书。

表1 两组患者一般资料比较(例)Tab 1 Comparison of general information of patients between 2 groups(case)
1.3 治疗方法
对照组患者给予紫杉醇注射液(江苏奥赛康药业股份有限公司,批准文号:国药准字H20083848,规格:10 mL∶60 mg)135 mg/m2,静脉滴注 ,d1+注射用奈达铂(江苏奥赛康药业股份有限公司,批准文号:国药准字H20064294,规格:10 mg)75 mg/m2,静脉滴注,d3,21 d为1个周期,共2个周期;同步使用NMSR 600型6Mv-X直线加速器(沈阳东软医疗系统有限公司)行常规分割调强放疗,每次2 Gy,每周5次,共60~70 Gy(临床靶区包括原发病灶及淋巴结引流区,脊髓照射量<40 Gy);放疗结束后继续给予原方案化疗2个周期。观察组患者在对照组治疗的基础上给予三胶扶正合剂(重庆市巴南区第二人民医院制剂室,批准文号:渝药制字Z20051544,规格:250 mL)250 mL/d,分3次服用,至治疗结束。
1.4 观察指标
观察两组患者治疗前后营养指标[BMI、血清前白蛋白(PAB)、血清白蛋白(ALB)、血红蛋白(Hb)]、肿瘤标志物[鳞状细胞癌抗原(SCC-Ag)、癌胚抗原(CEA)、细胞质胸苷激酶1(TK1)、细胞角蛋白19片段(CYFRA21-10)]水平[9],并记录不良反应发生情况。采用AU5800型全自动生化分析仪(美国贝克曼库尔特有限公司)检测PAB、ALB水平。采用血液分析仪(日本Sysmex公司)检测Hb水平。采用微粒子酶免疫分析法(试剂盒由罗氏公司提供)检测SCC-Ag;采用酶联免疫吸附测定法(ELISA)(试剂盒由罗氏公司提供)检测CEA;采用免疫印记增强化学发光法(试剂盒由华瑞同康生物技术有限公司提供)检测TK1;采用免疫放射分析法(试剂盒由罗氏公司提供)检测CYFRA21-1;上述指标均以I2000sr型全自动电化学发光免疫分析仪(美国雅培公司)检测。
1.5 疗效判定标准
按实体瘤疗效评价标准(RECIST 1.0版)分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)[10]。总有效率=(CR 例数+PR 例数)/总例数×100%。
1.6 统计学方法
采用SPSS 19.0软件对数据进行统计分析。计量资料以±s表示,采用t检验;计数资料与等级资料均以率或例数表示,前者采用χ2检验,后者采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较
两者患者总有效率比较,差异无统计学意义(P>0.05),详见表2。

表2 两组患者临床疗效比较Tab 2 Comparison of clinical efficacies between 2 groups
2.2 两组患者治疗前后BMI、PAB、ALB、Hb水平比较
治疗前,两组患者BMI、PAB、ALB、Hb水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者BMI、PAB、ALB、Hb水平均显著低于同组治疗前,但观察组显著高于对照组,差异均有统计学意义(P<0.05),详见表3。
2.3 两组患者治疗前后SCC-Ag、CEA、TK1、CYFRA21-1水平比较
治疗前,两组患者SCC-Ag、CEA、TK1、CYFRA21-1水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者SCC-Ag、CEA、TK1、CYFRA21-1水平均显著低于同组治疗前,且观察组显著低于对照组,差异均有统计学意义(P<0.05),详见表4。
2.4 不良反应
观察组患者Ⅲ~Ⅳ度白细胞减少、Ⅰ~Ⅱ度Hb减少及血小板减少的发生率均显著低于对照组,差异均有统计学意义(P<0.05),详见表5。
表3 两组患者治疗前后BMI、PAB、ALB、Hb水平比较(±s)Tab 3 Comparison of BMI,PAB,ALB and Hb levels between 2 groups before and after treatment(±s)
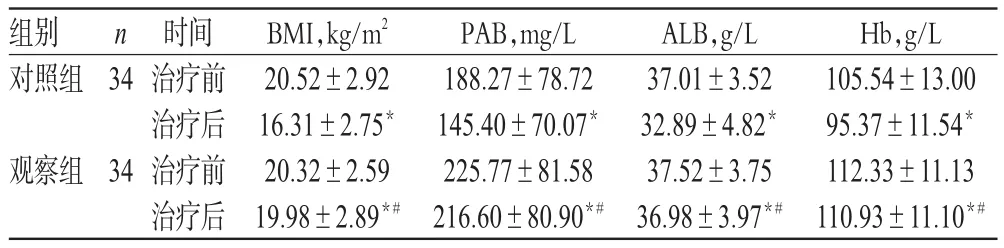
表3 两组患者治疗前后BMI、PAB、ALB、Hb水平比较(±s)Tab 3 Comparison of BMI,PAB,ALB and Hb levels between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P< 0.05
Hb,g/L 105.54±13.00 95.37±11.54*112.33±11.13 110.93±11.10*#组别对照组n 34观察组34时间治疗前治疗后治疗前治疗后BMI,kg/m2 20.52±2.92 16.31±2.75*20.32±2.59 19.98±2.89*#PAB,mg/L 188.27±78.72 145.40±70.07*225.77±81.58 216.60±80.90*#ALB,g/L 37.01±3.52 32.89±4.82*37.52±3.75 36.98±3.97*#
表4 两组患者治疗前后 SCC-Ag、CEA、TK1、CYFRA21-1水平比较(±s)Tab 4 Comparison of SCC-Ag,CEA,TK1 and CYFRA21-1 levels between 2 groups before and after treatment(±s)
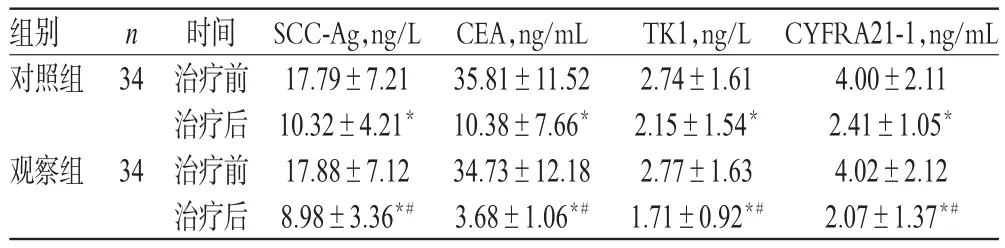
表4 两组患者治疗前后 SCC-Ag、CEA、TK1、CYFRA21-1水平比较(±s)Tab 4 Comparison of SCC-Ag,CEA,TK1 and CYFRA21-1 levels between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P< 0.05
组别对照组34 n观察组CYFRA21-1,ng/mL 4.00±2.11 2.41±1.05*4.02±2.12 2.07±1.37*#34时间治疗前治疗后治疗前治疗后SCC-Ag,ng/L 17.79±7.21 10.32±4.21*17.88±7.12 8.98±3.36*#CEA,ng/mL 35.81±11.52 10.38±7.66*34.73±12.18 3.68±1.06*#TK1,ng/L 2.74±1.61 2.15±1.54*2.77±1.63 1.71±0.92*#

表5 两组患者不良反应发生率比较(例)Tab 5 Comparison of the incidence ofADR between 2 groups(case)
3 讨论
因NSCLC缺乏早期特异性临床表现,故就诊时有35%~40%的患者已到局部晚期,若不积极治疗其中位生存率仅为7个月[11]。自Furuse K等[12]首次发现同步放化疗可明显提高局部晚期NSCLC患者的5年生存率以来,目前已有较多研究结果明确了同步放化疗在治疗局部晚期NSCLC的优势地位[8-12]。
奈达铂为一种新型铂类制剂,有文献报道应用奈达铂治疗肺癌后的毒性反应发生率较低,患者易接受[13]。紫杉醇为周期特异性广谱细胞毒性药物,具有放射增敏作用,联合奈达铂具有协同作用[14]。
三胶扶正合剂可增强垂体-肾上腺皮质功能,诱导机体分泌生物反应调节剂(BRM)或具有BRM样作用的因子[如肿瘤坏死因子、白细胞介素2(IL-2)等炎症因子],能明显增强正常机体及带瘤宿主体内的自然杀伤(NK)细胞活性,能提高IL-2、IL-6及免疫球蛋白水平,促进抗体产生,提高机体内干扰素水平[8];同时还可促进骨髓有核细胞数及脾集落形成单位(CFU-S),增强网状内皮系统的吞噬功能,拮抗放化疗所致骨髓抑制及免疫功能低下[15]。
本研究结果显示,两组患者总有效率比较,差异无统计学意义。这提示,三胶扶正合剂联合紫杉醇、奈达铂同步放化疗的疗效与紫杉醇联合奈达铂同步放化疗相当。治疗后,两组患者BMI、PAB、ALB、Hb水平均显著低于同组治疗前,但观察组显著高于对照组;两组患者SCC-Ag、CEA、TK1、CYFRA21-1水平均显著低于同组治疗前,且观察组显著低于对照组,差异均有统计学意义(P<0.05)。这提示,三胶扶正合剂联合紫杉醇、奈达铂同步放化疗能显著改善患者的营养状态,降低肿瘤标志物水平。观察组患者Ⅲ~Ⅳ度白细胞减少、Ⅰ~Ⅱ度Hb减少及血小板减少的不良反应发生率均显著低于对照组,差异均有统计学意义。这提示,三胶扶正合剂联合紫杉醇、奈达铂同步放化疗可减少不良反应的发生。
综上所述,三胶扶正合剂联合紫杉醇、奈达铂同步放化疗治疗局部晚期NSCLC的疗效与紫杉醇联合奈达铂同步放化疗相当,但前者可明显改善患者的营养状态、减少不良反应的发生。由于本研究纳入的样本量较小、中心单一,故本结论有待大样本、多中心研究进一步证实。
[1] CHEN W,ZHENG R,BAADE PD,et al.Cancer statistics in China:2015[J].CA Cancer J Clin,2016,66(2):115-132.
[2] 石远凯,孙燕,于金明,等.中国晚期原发性肺癌诊治专家共识:2016年版[J].中国肺癌杂志,2016,19(1):1-15.
[3] ZHENG R,ZENG H,ZHANG S,et al.National estimates of cancer prevalence in China:2011[J].Cancer Lett,2016,370(1):33-38.
[4] MORGENSZTERN D,NG SH,GAO F,et al.Trends in stage distribution for patients with non-small cell lung cancer:a national cancer database survey[J].J Thorac Oncol,2010,5(1):29-33.
[5] Chemotherapy in non-small cell lung cancer:a meta-analysis using updated data on individual patients from 52 randomised clinical trials:non-small Cell Lung Cancer Collaborative Group[J].BMJ,1995,311(7010):899-909.
[6] ETTINGER DS,WOOD DE,AKERLEY W,et al.Nonsmall cell lung cancer:version 6.2015[J].J Natl Compr Canc Netw,2015,13(5):515-524.
[7] 张代钊,于尔辛,余桂清,等.中医药对肿瘤放化疗的增敏减毒作用[J].中国中西医结合杂志,1992,12(3):135-138.
[8] 任洪波,缪剑华,袁经权,等.同步放化疗联合中药健脾补肾法治疗局部晚期非小细胞肺癌临床研究[J].重庆医学,2011,40(19):1894-1896.
[9] 殷蔚伯.肿瘤放射治疗手册[M].北京:中国协和医科大学出版社,2010:368-472.
[10] THERASSE P,ARBUCK SG,EISENHAUER EA,et al.New guidelines to evaluate the response to treatment in solid tumors:European Organization for Research and Treatment of Cancer,National Cancer Institute of the United States,National Cancer Institute of Canada[J].J Natl Cancer Inst,2000,92(3):205-216.
[11] CURRAN WJ JR,PAULUS R,LANGER CJ,et al.Sequential vs.concurrent chemoradiation for stageⅢnonsmall cell lung cancer:randomized phaseⅢ trial RTOG 9410[J].J Natl Cancer Inst,2011,103(19):1452-1460.
[12] FURUSE K,FUKUOKA M,KAWAHARA M,et al.PhaseⅢstudy of concurrent versus sequential thoracic radiotherapy in combination with mitomycin,vindesine,and cisplatin in unresectable stageⅢnon-small-cell lung cancer[J].J Clin Oncol,1999,17(9):2692-2699.
[13] 尚华,王艳美,张晕生.紫杉醇联合奈达铂同步放疗治疗局部晚期非小细胞肺癌的临床疗效及安全性观察[J].临床肺科杂志,2017,22(10):1870-1873.
[14] BELANI CP,CHOY H,BONOMI P,et al.Combined chemoradiotherapy regimens of paclitaxel and carboplatin for locally advanced non-small-cell lung cancer:a randomized phaseⅡlocally advanced multi-modality protocol[J].J Clin Oncol,2005,23(25):5883-5891.
[15] 蒋义,缪建华,袁经权,等.1号、2号三胶扶正合剂拮抗放化疗对小鼠毒副作用的实验研究[J].中国药房,2010,21(43):4051-4053.

