基于系统药理学的茵陈作用机制研究Δ
陈国铭,汤顺莉,邝梓君,黄雁,赵金龙,於菁雯,陈子茵,林洪荣,黄楚瑶,许华(.广州中医药大学第一临床医学院,广州 50405;.广州中医药大学第三临床医学院,广州 50405;.广州中医药大学针灸康复临床医学院,广州 50405;4.广州中医药大学第一附属医院儿科,广州 50405)
茵陈为菊科植物滨蒿(Artemisia scoparzaWaldst.et Kit.)或茵陈蒿(Artemisia capillarisThunb.)的干燥地上部分,味苦、辛,性微寒,归脾、胃、肝、胆经,具清热利湿、利胆退黄之功效,主治黄疸性疾病、小便不利、湿疮瘙痒、传染性黄疸型肝炎等症[1]。药理学研究证实,茵陈具有保肝利胆、镇痛消炎、抗病原微生物、调节免疫和心血管系统、抗肿瘤、调节血糖血脂等作用,被广泛应用于治疗急性黄疸型肝炎、胆汁性肝硬化、药物性肝损伤等多种临床疾病[1-4]。
中药药效的物质基础不是某一特定的有效化学成分,其起效机制也并非作用于某一特异性靶标,而是多成分、多靶标、多环节整体调节、共同作用的结果[5]。目前,关于茵陈有效化学成分及其作用的现代药理学研究较多,但有关其多成分、多靶标、多途径、多效应的药效作用机制研究则相对较少。作为新兴学科,系统药理学打破传统的“一个药物、一个靶标、一种疾病”的框架,融合系统生物学、多向药理学、计算生物学、网络拓扑学等多学科的技术和内容,进行“疾病-表型-基因-药物”多层次网络的构建,从整体角度去探索药物与疾病的关联性,具有整体性和系统性的特点,与中医学整体观和辨证论治的原则相对应[5-6]。鉴于此,本研究拟采用系统药理学方法对茵陈可能的作用机制进行分析和预测,为其进一步开发利用提供参考。
1 资料与方法
1.1 构建茵陈所含化合物数据库
利用中药系统药理学分析平台数据库(TCMSP,https://ibts.hkbu.edu.hk/LSP/tcmsp.php)检索茵陈所含的所有化学成分。根据TCMSP的推荐,通过口服利用度(OB)和类药性(DL)对所有化学成分进行筛选。OB是指药物被吸收进入全身循环系统的程度和速度,是客观评价药物口服生物利用度和内在质量的重要指标,也是判断生物活性分子是否具有药物潜质的关键指标;DL是药动学特性和安全性的总和(包括溶解度、通透性和稳定性等),与化合物理化性质和结构因素的相互作用有关,是评价成药性优劣的关键指标,可用于优选化合物、解释活性和类药性分析结果、挖掘活性和类药性的关系、分析化合物特性、预测体内药动学特征、指导分子结构修饰等。化合物的OB、DL越高,表明其越有可能被开发成为临床药物[7-8]。本研究以OB≥30%、DL≥0.18作为筛选条件[9],对茵陈有效化合物进行进一步筛选。
1.2 构建有效化合物-靶标蛋白网络
通过TCMSP导出所选茵陈有效化合物对应的所有相关靶标蛋白,将其输入Cytoscape 3.5.1软件中进行可视化处理,以构建茵陈有效化合物-靶标蛋白网络。网络构建采用布局算法,设置节点在视图中的几何位置,通过分层染色、图形、标注等方式直观显示出该网络的拓扑结构,使各个节点合理布局,产生清晰的视觉效果。其中,有效化合物与靶标蛋白以节点表示,两个节点间的相互作用以边表示。对该网络进行网络拓扑学分析,采用节点度值(Degree)和中介中心度(Betweenness cen-trality)对各节点的重要性进行评估,以评价茵陈有效化合物、靶标蛋白的重要程度。节点度值表示网络中与节点相连边的数量,节点大小与其度值成正比;中介中心度主要表示网络中最短路径经过该节点的数量占路径总和的比例,反映了该节点对整个网络的作用及影响力。各节点对应的参数值越大,则提示其在网络中的枢纽作用越重要[10]。
1.3 构建蛋白质-蛋白质相互作用(PPI)网络
由于蛋白质很少以独立个体的方式实现其生物功能,即在同一细胞的生化过程中,蛋白质一般是通过彼此之间的相互作用形成大分子复合物后,才能完成相应的生物学过程,因此PPI及其网络的研究与分析是理解生命活动中细胞组织结构和功能必不可少的基础[11]。为了从系统水平更好地理解靶标蛋白的作用,将有效化合物对应靶标蛋白的信息导入STRING数据库(https://string-db.org),从而获得PPI的相关信息。STRING是目前常用的检索或预测PPI的数据库,其结果来源于实验数据、文献挖掘、相关数据库以及生物信息学预测数据,通过系统自带评分机制对以上不同路径获得的结果进行评分,评分越高,表示PPI信息置信度越高。故为保证信息的高置信度、获取最佳的预测效果,本研究将评分条件(置信度)设定为大于0.9[12],利用STRING数据库构建PPI网络,并根据节点度值统计靶标蛋白的关联频次。
1.4 通路富集分析
KEGG数据库(www.kegg.jp)是由东京大学和日本京都大学共同研制并建立的,可提供通路查询,并与DAVID生物信息学资源数据库(https://david.ncifcrf.gov./)关联。本研究将通用蛋白编号[Uniprot ID,于UniGene数据库(https://www.ncbi.nlm.nih.gov/unigene/)中查询]导入DAVID生物信息学资源数据库中,对所有蛋白的编码基因进行通路富集分析,计算每条富集通路的P值,并采用Bonferroni法校正(P<0.01的结果被认为是“显著富集”),探索相关靶标蛋白参与表达的生物学通路。
2 结果
2.1 茵陈有效化合物筛选结果
从TCMSP中共获得化合物106个,根据其OB、DL值筛选出有效化合物13个:异鼠李素(Isorhamnetin)、β-谷甾醇(β-sitosterol)、茵陈黄酮(Arcapillin)、芫花素(Genkwanin)、玄参黄酮(Skrofulein)、异茵陈蒿黄酮(Isoarcapillin)、泽兰素(Eupalitin)、泽兰苷配基(Eupatolitin)、茵陈色原酮(Capillarisin)、4′-甲基茵陈色原酮(4′-methylcapillarisin)、去甲氧基茵陈色原酮(Demethoxycapillarisin)、Artepillin C、槲皮素(Quercetin),详见表1。
2.2 茵陈有效化合物-靶标蛋白网络分析
共导出靶标蛋白189个,见表2(表中,由于1个蛋白可能对应多个编码基因,故对应的Uniprot ID可能不止1个;同时,由于有的蛋白编码基因未收录在UniGene数据库中,故无对应的Uniprot ID)。将其信息导入Cytoscape 3.5.1软件后,得茵陈有效化合物-靶标蛋白网络,见图1。该网络共202个节点、368条边。其中,最内圈及中点13个节点代表茵陈有效化合物,中间圈51个节点和最外圈138个节点代表靶标蛋白。最外圈节点是度值为1的靶标蛋白,中间圈节点是度值≥2的靶标蛋白(为多个化合物共同作用的靶标蛋白)。网络拓扑学分析结果显示,其网络集中度为0.746、网络密度为0.018、网络异质性为3.184、最短路径为40 602。节点的平均度值为3.625,大于该平均度值的节点有38个;节点平均中介中心度为0.008,大于该平均中介中心度的节点有20个。根据网络节点度值和中介中心度等拓扑学性质筛选核心节点并进行分析。结果显示,槲皮素、β-谷甾醇、异鼠李素、Artepillin C、茵陈黄酮、泽兰素、茵陈色原酮、4′-甲基茵陈色原酮等有效化合物与前列腺素G/H合成酶2(PTGS2)、热休克蛋白90(HSP90)、二肽基肽酶Ⅳ、蛋白激酶A催化亚基Cα、PTGS1、胰蛋白酶原1(PRSS1)、钠通道蛋白5型α亚基(SCN5A)、雄激素受体(AR)、核受体共激活因子2(NCOA2)、凝血酶、醛糖还原酶等靶标蛋白在整个网络中具有重要的枢纽作用,可能是关键的化合物或者靶标蛋白,详见表3。

表1 茵陈有效化合物Tab1 Effective compounds ofA.capillaries
2.3 茵陈有效成分对应的靶标蛋白PPI网络分析结果
设置置信度大于0.9,剔除独立于网络之外的靶标蛋白,得茵陈有效成分对应的靶标蛋白PPI网络,见图2(由于可能与其余蛋白质联系紧密,故图中涉及到非茵陈有效化合物的靶标蛋白,如ARD1D)。该网络共包含129个节点、529条边,平均度值为8.3。其中,各节点表示靶标蛋白,每条边表示各靶标蛋白间的相互作用关系,边数越多表示该节点对应的靶标蛋白越重要,如JUN、TP53等。根据各节点的度值绘制大于平均度值的关键靶标蛋白(共22个)的信息条形图,见图3。结果显示,JUN的度值为44,远远超过其余靶标蛋白,表明其在网络中发挥了关键作用,成为连通网络中其他节点的桥梁。
2.4 KEGG通路富集分析结果
通过DAVID生物信息学资源数据库对茵陈靶标蛋白的编码基因进行KEGG通路富集,共得富集结果122条(包含非信号通路富集结果),其中通路富集结果有34条,有32条通路的P值小于0.01。利用P值和富集基因数进行交叉筛选,取两个参数均排前10位的通路进行分析,结果见表4。由表4可见,编码基因显著富集在TNF-α信号通路、HIF-1信号通路、Toll样受体信号通路、磷脂酰肌醇-3-激酶/丝苏氨酸蛋白激酶(P13K/Akt)信号通路、T细胞受体信号通路、甲状腺激素信号通路、凋亡信号通路等通路上。

表2 茵陈有效化合物的靶标蛋白Tab 2 Target proteins of effective compounds ofA.capillaries

续表1Continued tab 1
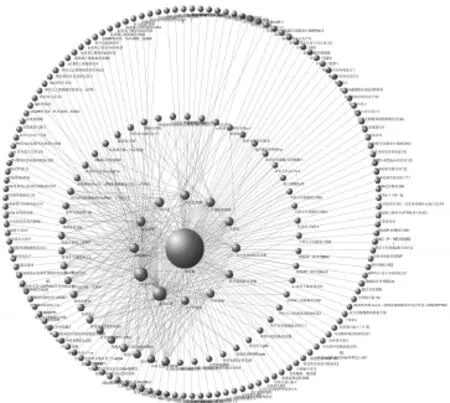
图1 茵陈有效化合物-靶标蛋白网络Fig 1 Effective compound-target protein network of A.capillaries
3 讨论
3.1 有效化合物
有效化合物-靶标蛋白网络拓扑学分析结果表明槲皮素、β-谷甾醇、异鼠李素等是茵陈的关键性有效成分。
槲皮素为黄酮类化合物,具有抗氧化、抗纤维化、抗炎、抑癌、抗病毒、抗衰老、抗抑郁和保护心血管、维持血糖稳定等作用[13]。体外试验表明,槲皮素可以通过多条信号通路影响多种肿瘤细胞的代谢,抑制其分裂增殖、迁移和侵袭,促进其凋亡;此外,槲皮素还能够增强肿瘤细胞对其他抗肿瘤药的敏感性,逆转肿瘤细胞耐药性[14-15]。这与茵陈的抗肿瘤作用相符。
β-谷甾醇为植物甾醇类化合物,具有抗炎、抑癌、调节免疫、防治前列腺肥大、抗氧化、降血脂、镇痛、促进伤口愈合、调节骨代谢平衡、保护胃黏膜、治疗癫痫等药理活性[16-17]。研究表明,β-谷甾醇可通过调节局部免疫、抑制环氧合酶与脂肪氧合酶通路、抑制前列腺素合成、增强巨噬细胞活性来发挥抗炎的作用[18]。这进一步印证了茵陈具有镇痛抗炎、调节免疫的功效。

表3 茵陈有效化合物-靶标蛋白网络关键节点及其拓扑学特征Tab 3 of effective compound-target protein network and its topology features of A.capillaries
异鼠李素为黄酮类化合物,具有保护内皮、抗动脉粥样硬化、抗心肌缺血、保护心肌细胞、抑制心肌纤维化、降血压、抗血栓、抑制血小板凝集、抗氧化等多种心脑血管保护作用,同时还具有抑制脂肪细胞分化、耐缺氧、抗肿瘤、降糖、抗炎、抗病毒等多种作用[19]。异鼠李素可抑制多种肿瘤细胞的增殖并诱导其凋亡,同时也具有保肝的作用[20]。这进一步佐证了茵陈具有保肝利胆、调节心血管系统的临床药用价值。
3.2 靶标蛋白
PTGS2、HSP90、二肽基肽酶Ⅳ等是茵陈的关键靶标蛋白。
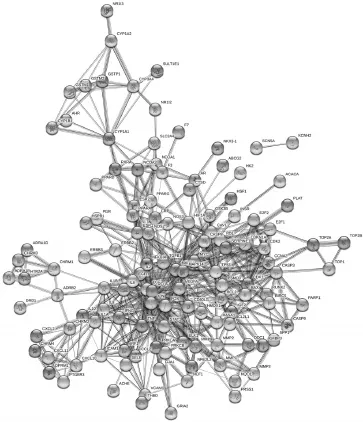
图2 靶标蛋白PPI网络Fig 2 PPI network of target proteins
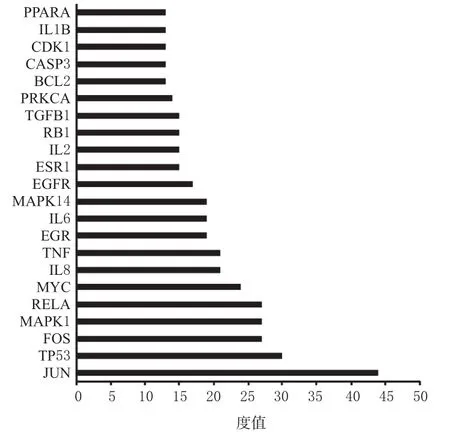
图3 关键靶标蛋白的信息条形图Fig 3 Information bar chart of key target proteins

表4 P值和富集基因数均排前10位的KEGG富集通路Tab 4 KEGG enrichment pathway in the top 10 list of P value and the number of enrichment gene
PTGS2也称环氧合酶2(COX-2),是花生四烯酸转化为前列腺素前体(前列腺素H2)的限速酶[21]。Fujita H等[22]研究发现,COX-2可以通过抑制前列腺癌细胞凋亡起到促进前列腺癌细胞增殖的作用,且COX-2与前列腺癌血管形成及癌细胞转移呈正相关。邓琳等[23]的研究表明,过表达COX-2后,卵巢癌细胞的增殖和迁移能力增强,而经COX-2抑制剂处理后则变弱。COX-2作为炎性因子,会导致机体出现红肿热痛,最终诱发炎症,而使用COX-2抑制剂则可减少这种反应的发生[24]。鉴于比,笔者认为茵陈有可能通过抑制该酶活性来发挥抗肿瘤、镇痛消炎的作用。
许多研究表明,HSP90是抗肿瘤药的作用靶标之一,抑制HSP90能够抑制肿瘤的增长和转移[25-26]。张杰等[27]采用狭缝杂交法定量证明了HSP90编码基因mRNA的表达水平在人肝癌细胞中最高,非癌肝组织中次之,正常肝中最少,提示HSP90可能是茵陈保肝抗癌的重要靶标蛋白之一。
二肽基肽酶Ⅳ对免疫、炎症、脂肪代谢及细胞生长凋亡等具有多方面的调节作用[28-29]。研究表明,非酒精性脂肪肝患者的肝细胞中二肽基肽酶Ⅳ的mRNA表达水平较健康人群高,且该物质在动物实验及临床研究中均表现出了一定的降压作用;在心肌缺血再灌注损伤过程中,二肽基肽酶Ⅳ抑制剂可激活P13K/Akt信号通路,保护心肌细胞,减少心梗面积[30]。这提示该靶标蛋白可能与茵陈保护心血管系统的作用密切相关。
3.3 靶标蛋白的相互作用
PPI网络分析表明,JUN、TP53的度值远高于其余靶标蛋白。编码JUN等原癌基因靶标蛋白的基因为即刻早期基因(因在外界因素刺激下能迅速表达而得名),包括c-fos、c-jun、c-myc等[31]。在外来因素刺激下,c-fos和c-jun可迅速表达,翻译成JUN,影响靶基因的转录[32]。编码TP53的基因是一种重要的抑癌基因。据报道,超过50%的肿瘤患者存在该基因突变,且未突变的患者也常伴有相关通路的部分失活[33]。Attallah AM等[34]通过研究发现,TP53编码基因突变越多,则肝癌组织中该蛋白的表达越多、肿瘤分化越低、患者预后越差。相关研究显示,该蛋白编码基因的表达是肝癌患者生存期的独立危险因素[35]。由此可见,TP53可能是治疗肿瘤的一个新靶标。茵陈在临床上单独或配伍用于治疗肿瘤并不少见,但关于其起效机制的研究尚浅,上述结果或许可为后续深入研究提供参考。
3.4 信号通路
KEGG通路富集结果显示,TNF-α信号通路、HIF-1信号通路、Toll样受体信号通路、PI3K/Akt信号通路、T细胞受体信号通路、甲状腺激素信号通路、凋亡信号通路等是茵陈发挥作用的重要通路。大多数靶标蛋白编码基因显著富集到PI3K/Akt信号通路、TNF-α信号通路和HIF-1信号通路上。相关研究表明,PI3K/Akt信号通路是肿瘤通路之一,通过调控该通路可抑制肿瘤细胞的增殖、迁移,促进其凋亡[35-37]。TNF-α信号通路通过TNF和肿瘤坏死因子受体1(TNFR1)结合而激活,激活的TNF-α信号通路可导致核转录因子κB核易位和c-Jun氨基末端激酶(JNK)、p38蛋白、JUN活化,促进促炎细胞因子、趋化因子、生长因子和TNF-α等的表达[38]。HIF-1作为一种氧敏感的转录激活因子,是由HIF-1A和HIF-1B两个亚基组成的异源二聚体,参与维持体内氧气和能量平衡[39]。研究表明,HIF-1信号通路与组织损伤时机体在短时间内调动大量间充质干细胞从骨髓进入循环池并迁移、归巢至损伤部位参与修复损伤有关[40];此外,低氧、HIF-1A的高表达与肿瘤血管的形成、转移以及患者的病死率和预后密切相关[41]。研究发现,当机体处于低氧状态时,HIF-1和核转
录因子κB的活化可促进成纤维母细胞中CAV1的自体吞噬与降解,而CAV1的降解能够抑制邻近癌细胞的凋亡[42]。Legendre C等[43]的研究结果显示,在肝癌细胞中,HIF-1A可通过下调药物代谢酶的表达来影响肝癌患者的化疗效果。亦有研究表明,微核糖核酸-338-3p(miR-338-3p)通过下调HIF-1A的表达来抑制肝癌细胞的生长,并以此提高患者对新型靶向抗肿瘤药索拉非尼的敏感性[44]。由此可见,上述通路可能与茵陈抗肿瘤作用有关,体现了茵陈多靶标、多通路、多途径、多效应的作用特点,也符合祖国医学“同病异治、异病同治”理论的物质基础。
4 结语
综上所述,本研究通过系统药理学的研究方法,对茵陈多成分、多靶标、多途径的复杂作用机制进行分析,结果表明茵陈有效化合物槲皮素、β-谷甾醇、异鼠李素等可能通过TNF-α信号通路、HIF-1信号通路、PI3K/Akt信号通路等作用于PTGS2、HSP90、二肽基肽酶Ⅳ、JUN等靶标蛋白进而发挥其抗炎、抗肿瘤等药理作用。上述分析结果可为茵陈的进一步开发利用提供参考。系统药理学结合系统生物学、网络拓扑学等多学科技术和内容,借助软件分析及预测中药基于信号通路的作用机制,为中药研究提供了新的思路。但由于数据库信息的不全面、化合物筛选的主观性、忽略了药物体内代谢过程等因素的影响,本研究结果可能存在一定的片面性和局限性,仍有待后续研究进一步验证。
[1] 章林平,孙倩,王威,等.茵陈有效成分的药理作用及其临床应用的研究进展[J].抗感染药学,2014,11(1):28-31.
[2] 覃晓雾,卢杰夫,田惠芳.茵陈蒿汤治疗急性黄疸型肝炎的Meta分析[J].湖南中医杂志,2016,32(7):162-164.
[3] 李保义,吕晓峰,安春棉,等.茵陈蒿汤加味治疗药物性肝损伤65例[J].中国实验方剂学杂志,2013,19(20):285-288.
[4] 刘亚杰,邵文革,王瑞强,等.茵陈蒿汤加味治疗原发性胆汁肝硬化[J].中医学报,2013,28(28):19-20.
[5] 吴钉红.网络药理学及其在中药领域的研究概述[J].广州化工,2017,45(11):216-218.
[6] 李泮霖,苏薇薇.网络药理学在中药研究中的最新应用进展[J].中草药,2016,47(16):2938-2942.
[7] 袁长胜,陈文.基于TCMSP对玫瑰花黄酮和挥发油防治心血管疾病的协同作用及其机制研究[J].石河子大学学报(自然科学版),2016,34(6):731-734.
[8] 石海英,王唯红,王金虎,等.新药研发中类药性概念应用现状的研究分析[J].医药卫生,2017,9(1):289.
[9] RU J,LI P,WANG J,et al.TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J].J Cheminform,2014.DOI:10.1186/1758-2946-6-13.
[10] LE DH,PHAM VH.HGPEC:a Cytoscape app for prediction of novel disease-gene and disease-disease associations and evidence collection based on a random walk on heterogeneous network[J].BMC Syst Biol,2017.DOI:10.1186/s12918-017-0437-x.
[11] 蒋永麟,姜正羽,尤启冬.蛋白-蛋白相互作用:抗肿瘤药物研发的新方向[J].中国新药杂志,2017,26(10):1119-1129.
[12] FRANCESCHINI A,SZKLARCZYK D,FRANKILD S,et al.STRING v 9.1:protein-protein interaction networks:with increased coverage and integration[J].Nucleic Acids Res,2013,41(Database issue):D808-D815.
[13] 张志琴,朱双雪.槲皮素的药理活性与临床应用研究进展[J].药学研究,2013,32(7):400-403.
[14] 王惠丽,胡子有,苑召虎,等.槲皮素抗肿瘤机制的研究进展[J].热带医学杂志,2013,13(1):126-130.
[15] 刘鹃,康刚劲.槲皮素对晶状体保护作用的研究进展[J].国际眼科杂志,2015,15(1):49-51.
[16] BIN SAYEED MS,AMEEN SS.Beta-sitosterol:a promising but orphan nutraceutical to fight against cancer[J].Nutr Cancer,2015,67(8):1214-1220.
[17] DIGHE SB,KUCHEKAR BS,WANKHEDE SB.Analgesic and anti-inflammatory activity of β-sitosterol isolated from leaves of Oxalis corniculata[J].Int J Pharmacol Res,2016,6(3):109-113.
[18] 肖志彬,刘小雷,成日青,等.β-谷甾醇对阿司匹林副作用抵抗及抗炎作用影响的实验研究[J].内蒙古医科大学学报,2015,37(4):350-354.
[19] 崔明超,陈少军,崔文,等.基于反向分子对接技术的异鼠李素靶标的预测[J].中国药房,2016,27(28):3921-3924.
[20] 李小芳.异鼠李素诱导人结肠癌细胞凋亡及其分子机制的初步研究[J].中国细胞生物学学报,2017,39(6):695-700.
[21] 刘芳,于廷和,王智彪.环氧合酶及其抑制剂在卵巢癌中的研究进展[J].重庆医科大学学报,2007,32(增刊):36-38.
[22] FUJITA H,KOSHIDA K,KELLER ET,et al.Cyclooxygenase-2 promotes prostate cancer progression[J].Prostate,2002,53(3):232-240.
[23] 邓琳,冯定庆,凌斌.COX2促进卵巢癌细胞迁移及相关机制的研究[J].现代妇产科进展,2016,25(8):561-565.
[24] 宋敬锋,刘昊,张岩,等.祛风通络利湿中药治疗湿热痹阻证痛风性关节炎疗效及对MMP-3、COX-2的影响[J].
现代中西医结合杂志,2017,26(16):1741-1744.
[25] WANG Y,KOAY YC,MCALPINE SR.How selective are HSP90 inhibitors for cancer cells over normal cells?[J].ChemMedChem,2017,12(5):353-357.
[26] TAS F,BILGIN E,ERTURK K,et al.Clinical significance of circulating serum cellular heat shock protein 90(HSP90)level in patients with cutaneous malignant melanoma[J].Asian Pac J Cancer Prev,2017,18(3):599-601.
[27] 张杰,张宁,芮静安,等.人肝细胞癌及其配对非癌肝组织、正常肝组织中热休克蛋白HSP90基因mRNA水平的分析[J].中国生物化学与分子生物学报,2001,17(3):386-390.
[28] 董洁,汤道权,肖冰心,等.二肽基肽酶4抑制剂药物相互作用的研究进展[J].中国药房,2017,28(32):4601-4604.
[29] GORRELL MD.Dipeptidyl peptidaseⅣand related enzymes in cell biology and liver disorders[J].Clin Sci:Lond,2005,108(4):277-292.
[30] 陆迪菲,马晓伟,郭晓蕙.二肽基肽酶-4心血管系统作用的研究进展[J].中国糖尿病杂志,2016,24(11):1049-1051.
[31] ISHII S,ABE T,SAITO T,et al.Effects of preconditioning on ischemia/reperfusion injury of hepatocytes determined by immediate early gene transcription[J].J Hepatobiliary Pancreat Surg,2001,8(5):461-468.
[32] WANG S,XU X,XU F,et al.Combined expression of cjun,c-fos,and p53 improves estimation of prognosis in oral squamous cell carcinoma[J].Cancer Invest,2016,34(8):393-400.
[33] CHEOK CF,VERMA CS,BASELGA J,et al.Translating p53 into the clinic[J].Nat Rev Clin Oncol,2011,8(1):25-37.
[34] ATTALLAH AM,SHIHA GE,ISMAIL H,et al.Expression of p53 protein in liver and sera of patients with liver fibrosis,liver cirrhosis or hepatocellular carcinoma associated with chronic HCV infection[J].Clin Biochem,2009,42(6):455-461.
[35] QIN LX,TANG ZY.The prognosic molecular markers in hepatocellular carcinoma[J].World J Gastroenterol,2002,8(3):385-392.
[36] CHENG HW,CHEN YF,WONG JM,et al.Cancer cells increase endothelial cell tube formation and survival by activating the PI3K/Akt signaling pathway[J].J Exp Clin Cancer Res,2017.DOI:10.1186/s13046-017-0495-3.
[37] CHEN H,HUANG Y,HUANG J,et al.Gigantol attenuates the proliferation of human liver cancer HepG2 cells through the PI3K/Akt/NF-κB signaling pathway[J].Oncol Rep,2017,37(2):865-870.
[38] VARFOLOMEEV E,GONCHAROV T,MAECKER H,et al.Cellular inhibitors of apoptosis are global regulators of NF-kappaB and MAPK activation by members of the TNF family of receptors[J].Sci Signal,2012.DOI:10.1126/scisignal.2001878.
[39] 蔡秀红,黄贻涛,张子平,等.缺氧诱导因子-1(HIF-1)及其在水生动物中的研究进展[J].农业生物技术学报,2014,22(1):119-132.
[40] 胡韶君,余勤,刘丽珍,等.HIF-1信号通路在介导DMOG动员MSCs中的作用[J].中国比较医学杂志,2015,25(1):9-14.
[41] 刘丽愉,杨力芳,曹亚.低氧诱导因子信号通路的研究新进展[J].国际病理科学与临床杂志,2011,31(3):218-222.
[42] MARTINEZ-OUTSCHOORN UE,TRIMMER C,LIN Z,et al.Autophagy in cancer associated fibroblasts promotes tumor cell survival:role of hypoxia,HIF1 induction and NF-κB activation in the tumor stromal microenvironment[J].Cell Cycle,2010,9(17):3515-3533.
[43] LEGENDRE C,HORI T,LOYER P,et al.Drug-metabolising enzymes are down-regulated by hypoxia in differentiated human hepatoma HepaRG cells:HIF-1α involvement in CYP3A4 repression[J].Eur J Cancer,2009,45(16):2882-2892.
[44] XU H,ZHAO L,FANG Q,et al.MiR-338-3p inhibits hepatocarcinoma cells and sensitizes these cells to sorafenib by targeting hypoxia-induced factor 1alpha[J].PLoS One,2014,9(12):e115565.

