盐酸维拉帕米缓释片微生物限度检查方法学的建立
余展旺 吴伟东 罗达敏
深圳技师学院应用生物系,广东深圳 518116
盐酸维拉帕米缓释片用于原发性高血压,化学名称:α-[3-][2-(3,4-二甲氧苯基)乙基]甲氨基]丙基] -3,4-二甲氧基-α-异丙基苯乙腈盐酸盐。分子式:C27H38N2O4·HCl。盐酸维拉帕米为钙离子拮抗剂,钙离子拮抗剂又称钙通道阻滞剂(CCB),通过调节心肌传导细胞、心肌收缩细胞以及动脉血管平滑肌细胞细胞膜上的钙离子内流,发挥其药理学作用,但不改变血清钙浓度。该药是我国高血压患者最常使用的一类降压药[1],《中国药典》2015年版二部收载有该品种[2]。根据《中国药典》2015年版四部相关规定,盐酸维拉帕米缓释片应进行需氧菌总数、霉菌和酵母菌总数的测定及大肠埃希菌的检查[3]。在建立药品的微生物限度检验方法应进行方法适用性试验,以确认所采用的方法适合该产品的微生物限度检查,从而保证所建立检验方法的科学性和检验结果的准确性。本品微生物限度检查方法学的建立如下。
1 材料与方法
1.1 试验仪器
生化培养箱(上海一恒科学仪器有限公司),湿热灭菌柜(山东新华医疗器械股份有限公司),生物安全柜(山东博科生物产业有限公司),干热灭菌柜(山东新华医疗器械股份有限公司),电子天平 (赛多利斯科学仪器北京有限公司);匀浆仪 (上海炳隆机电设备有限公司)。
1.2 试药
盐酸维拉帕米缓释片(批号20151201、20151202、20151203),硫氰酸铵。
1.3 培养基
胰酪大豆胨琼脂培养基;沙氏葡萄糖琼脂培养基;麦康凯液体培养基;胰酪大豆胨液体培养基;pH7.0无菌氯化钠蛋白胨缓冲液;麦康凯琼脂培养基。
1.4 验证用菌株
铜绿假单胞菌 [CMCC(B)10104]; 金黄色葡萄球菌 [CMCC(B)26003]; 枯草芽孢杆 菌 [CMCC(B)635011];白色念珠菌 [CMCC(B)98001]; 黑曲霉[CMCC(B)98003], 中国食品药品检定研究院提供。
1.5 试验菌悬液的制备[2]
取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、大肠埃希菌、白色念珠菌的新鲜培养物,用pH 7.0无菌氯化钠-蛋白胨缓冲液制成适宜浓度的菌悬液;取黑曲霉的新鲜培养物加入3~5mL含0.05%(mL/mL)聚山梨酯80的pH 7.0无菌氯化钠-蛋白胨缓冲液,将孢子洗脱。然后,采用适宜的方法吸出孢子悬液至无菌试管内,用含0.05%(mL/mL)聚山梨酯80的pH 7.0 无菌氯化钠-蛋白胨缓冲液制成适宜浓度的黑曲霉孢子悬液。
1.6 中和剂的制备
以硫氰酸铵(1g/100mL)作为中和剂,用pH 7.0缓冲液作为溶剂来溶解硫氰酸铵。采用过滤法除菌。
1.7 常规法菌落回收率试验
1.7.1 供试液的制备 称取供试品10g,置于研钵中研成细粉,转移至无菌三角瓶中,加入pH 7.0无菌氯化钠蛋白胨缓冲液400mL,置匀浆仪500转/min匀浆5min,既得1∶40供试液。
1.7.2 供试品试验组 取上述供试液,分装为50mL/瓶,分装5瓶,在分配好的供试液中加入0.5mL浓度为103~104cfu/mL的实验菌(实验菌分别为金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉菌)混匀,制成试验组样品溶液。采用平皿法,取上述试验组样品溶液1mL加入无菌平皿中,每种试验菌平行制备2个平皿。其中金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌倾注TSA,白色念珠菌及黑曲霉菌应同时倾注TSA及SDA。
1.7.3 菌液对照组 取pH7.0缓冲液,分装至5个三角瓶中,每瓶50mL,加入目标稀释级103~104cfu/mL的菌液各0.5mL,混匀,作为菌液对照组。取1mL加入无菌平皿中,每种试验菌平行制备2个平皿。
1.7.4 供试品对照组 取供试品1mL加入无菌平皿中,倾注已融化的TSA及SDA,每种培养基平行制备2个平皿。
1.7.5 阴性对照组 取pH7.0缓冲液1mL加入无菌平皿中,倾注已融化的TSA及SDA,每种培养基平行制备2个平皿。
1.7.6 需氧菌于30~35℃培养≤3d,霉菌及酵母菌于20~25℃培养≤5d。菌落回收率%=(试验组菌数-供试液对照组菌数)/菌液对照菌数×100%。
1.8 中和法菌落回收率试验
用不同类别的微生物考察供试液是否有抑菌性及检验程序的可靠性,将验证试验分成5组,并计算试验组和中和剂毒性组的菌回收率。
1.8.1 供试液制备 称取盐酸维拉帕米缓释片10g,置于无菌三角瓶中,加入含硫氰酸铵(1g/100mL)的pH 7.0缓冲液500mL充分混匀,让其反应完全,即得1∶50供试品溶液。
1.8.2 供试品试验组 取供试液100mL,分装5个三角瓶,每瓶20mL。在分装好供试液试的三角瓶中分别加入0.2mL的目标菌悬液(金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉,浓度为103~104cfu/mL)即得供试品试验组溶液。取上述溶液1mL加入无菌平皿中,每种试验菌平行制备2皿。其中金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌倾注培养基TSA,白色念珠菌、黑曲霉分别倾注培养基TSA及SDA。
1.8.3 中和剂毒性组 取含硫氰酸铵(1g/100mL)的pH 7.0缓冲液100mL,分装5个无菌三角瓶中,每瓶20mL。在分装好的中和剂三角瓶中分别加入0.2mL的目标菌悬液即得中和剂组溶液。取上述溶液1mL加入无菌平皿中,倾注对应培养基,待凝固后倒置培养,每种试验菌平行制备2皿进行微生物回收试验。
1.8.4 菌液对照组,供试品对照组,阴性对照组:方法同常规法。
1.8.5 培养及计数 TSA平皿于30~35℃培养不超过3d;SDA平皿于20~25℃培养不超过5d。结果观察和计数逐日点计平板菌落数,并记录结果,以最终的时间计数为准。
1.9 控制菌检查
1.9.1 供试液增菌培养
1.9.1.1 供试品试验组 采用中和法制备供试液,取含有103~104cfu/mL的大肠埃希菌菌悬液0.5mL分别加入含有50mL供试液的三角瓶中,摇匀。取10mL接种至100mL的胰酪大豆胨液体培养基中,混匀,30~35℃培养18~24h,必要时可延长至48h。
1.9.1.2 菌液对照组 取含有102~103cfu/mL的试验菌菌悬液0.5mL分别加入含有50mL pH7.0无菌氯化钠-蛋白胨缓冲液的三角瓶中,其余操作同供试品试验组。
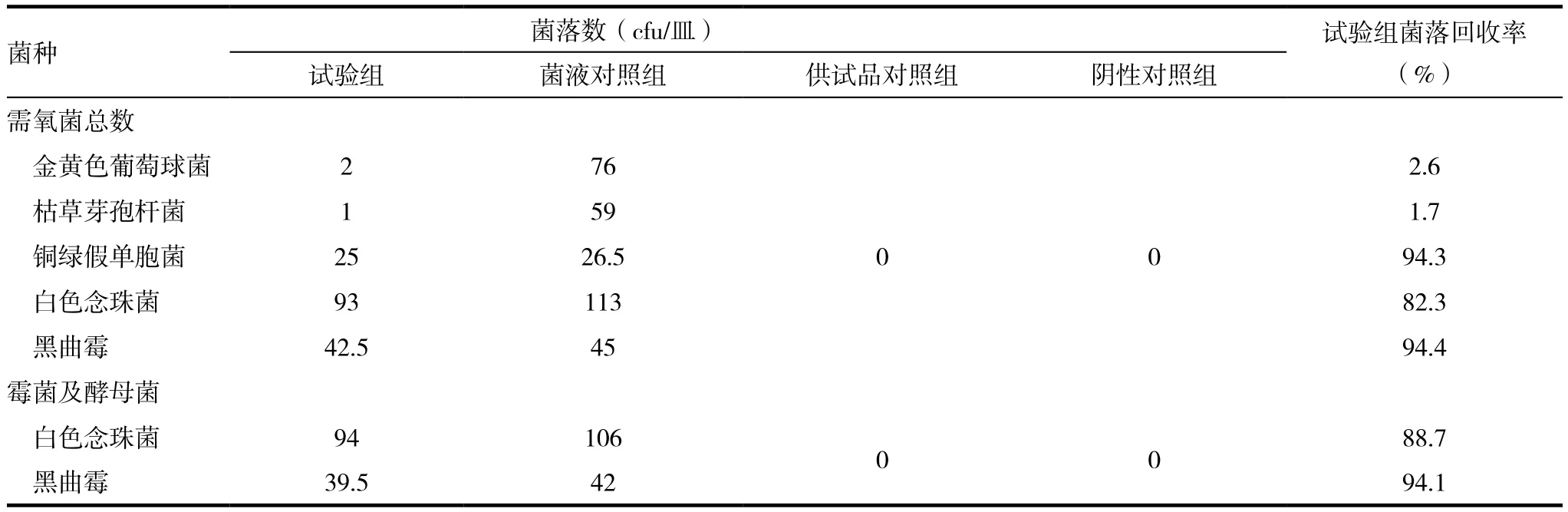
表1 常规法菌落回收率试验结果
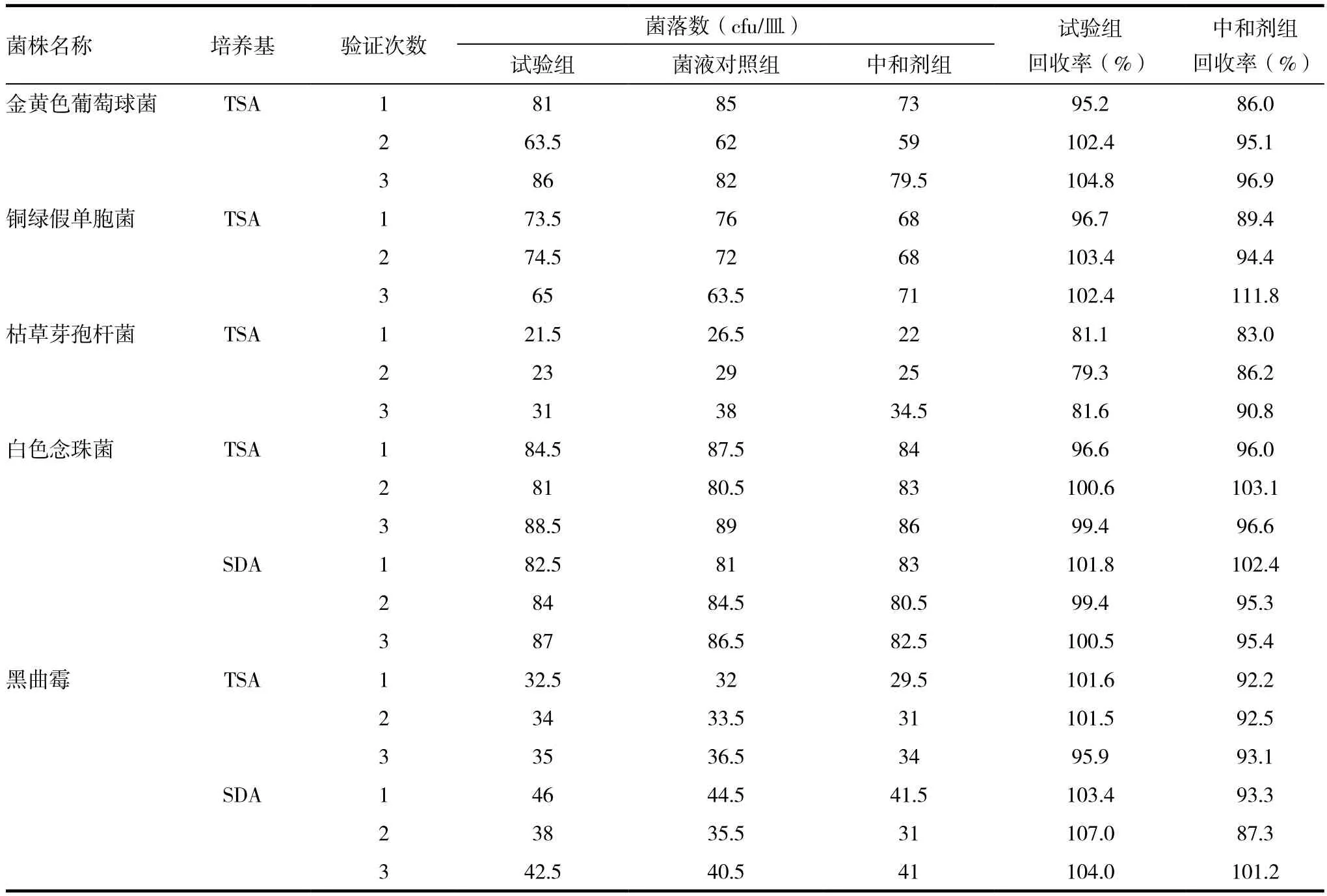
表2 中和法菌落回收率试验结果

表3 大肠埃希菌检查方法验证结果
1.9.1.3 供试品对照组 取供试品10mL直接接种至100mL的胰酪大豆胨液体培养基中,其余操作同供试品试验组。
1.9.1.4 阴性对照组 取10mL pH7.0无菌氯化钠-蛋白胨缓冲液接种至100mL的胰酪大豆胨液体培养基中,其余操作同供试品试验组。
1.9.2 选择和分离培养 取上述培养物各1mL,分别接种至100mL麦康凯液体培养基中,42~44℃培养24~48h,取麦康凯液体培养物划线接种于麦康凯琼脂培养基平板上,30~35℃培养18~72h。
2 结果
2.1 常规法菌落回收率试验结果
从常规法菌落回收率试验可看出该药品对微生物有抑菌性见表1,其中金黄色葡萄球菌的回收率为2.6%,枯草芽孢杆菌回收率为1.7%,两种菌的回收率均不在药典规定的50%~200%的范围内,可见盐酸维拉帕缓释片对金黄色葡萄球菌和枯草芽孢杆菌有较强的抑菌性,采用常规平皿法不能消除其干扰,应重新开发方法,找到适合的中和剂。
2.2 中和法菌落回收率试验和大肠埃希菌检查结果
采用硫氰酸铵(1g/100mL)作为中和剂,在3次独立平行试验中,五种菌的试验组回收率和中和剂组回收率均在50%~200%之间,符合药典要求,此中和剂能消除盐酸维拉帕米缓释片的抑菌性且对五种菌无抑制,可按此方法进行正式实验,见表2。大肠埃希菌检查结果:试验组、菌液对照组均检出实验菌,且菌落形态符合药典个要求,供试品组、阴性对照组均无菌生长。见表3。
微生物限度检查法方法验证工作十分繁琐,影响因素包括培养基、菌株、实验步骤和供试品的制备方式[4]。为尽量减小误差,实验结果点计时以两人交叉点计的方式进行计数,在进行实验之前进行菌种传代,传代结束后直接接种,以保持菌液中活菌数量,提高菌活性,减少菌液浓度计算误差。
3 讨论
《中国药典》2015年版以整合先进理念、借鉴吸收国外药典先进技术经验、兼顾国情为主要原则对微生物限度检查法在适用范围、检测环境、检测方法、培养体系及质量控制理念等方面都做了较大修订,并将微生物限度检查法完善成为更加科学并与国际接轨的检查方法[5-6]。
如果供试品对微生物生长的抑制作用无法以其他方法消除,供试液可经过中和、稀释或薄膜过滤处理后再加入试验菌悬液进行方法适应性试验。中和法在微生物限度检查的广泛应用,可明显降低抑菌性药物的抑菌能力,提高菌的回收率。张光华等[7]用 3%聚山梨酯 80和 0.3%蛋黄卵磷脂作为中和剂来进行化学药的微生物限度检查,可明显降低药品的抑菌性。 孙伟等[8]用β-环糊精作为中和剂来消除喹诺酮类抗生素药品抑菌活性, 解决该类药品微生物限度检查方法建立困难问题。《中国药典》2015年版从执行至今两年,对新版药典微生物限度检查方法的研究与应用的报道在不断增多,其中有不少研究报道是采用了中和法[9-15]。
用标准菌株评价盐酸维拉帕米缓释片微生物限度检查方法对检品中微生物的抑菌性。在中和法实验中试验组和中和剂对照组的回收率均大于50%,试验组回收率最低的一次是枯草芽孢杆菌为79.3%,最高的是用SDA培养的黑曲霉,结果为107.0%,之前对药品有抑菌性的金黄色葡萄球菌回收率也符合要求,最低为95.2%,最大为104.8%,可排除该药品对微生物的抑菌性,且在方法验证执行过程中无偏差、无变更。平行三次实验结果回收率均在50%~200%范围内。
综上所述,在当前实验检测条件下,盐酸维拉帕米缓释片微生物限度计数方法适用性实验可按此验证方法及检测操作程序进行日常检测。企业生产的同一个品种,在原药材产地、批次、炮制方法以及生产工艺发生改变的时候,也应该进行方法确认其检查方法的可行性[16]。本研究建立的方法可为不同企业生产的同类品种的微生物限度检查方法提供参考。
[1] 郭衍梅,袁建喜.盐酸维拉帕米缓释片含服治疗高血压病的临床观察[J].中外医学研究, 2015,12: 152-153.
[2] 国家药典委员会. 2015年版《中华人民共和国药典》二部[M].北京: 中国医药科技出版社,2015: 1080.
[3] 国家药典委员会. 2015年版《中华人民共和国药典》四部[M].北京: 中国医药科技出版社,2015:140-151.
[4] 陈健梅.微生物检查方法验证及其影响因素分析[J].中国医药导报,2008,12: 66-68.
[5] 杨晓莉,李辉,马英英,等. 中国药典2015年版非无菌产品微生物限度检查:微生物计数法解读[J]. 药物分析杂志,2016,36:1101-1107.
[6] 杨晓莉,李辉,马英英,等. 中国药典2015年版非无菌产品微生物限度检查:控制菌检查法解读与对策[J].中国药师, 2016,19:748-752.
[7] 张光华,余立.聚山梨酯 80 和卵磷脂在化学药微生物限度检查时的中和作用[J].药物分析杂志,2008,28(7):1127-1130.
[8] 孙伟,刘文杰,崔颖,等. β-环糊精在喹诺酮类抗生素药品微生物限度检查方法建立中的应用[J].药物分析杂志 ,2013,33(1):18-21.
[9] 陈希,肖钦钦,刘绪平,等. 诺氟沙星胶囊微生物限度检查方法研究 [J]. 今日药学,2016,13(5):322-322.
[10] 赵翠红,刘布鸣,黎瑞,等. 复方苯佐卡因凝胶微生物限度检查方法的验证[J]. 中国药师,2017,20(7):1328-1331.
[11] 万进,林蒙. 盐酸左氧氟沙星凝胶微生物限度检查方法验证 [J]. 医药导报,2015,34(11):1486-1489.
[12] 潘震宇,汤茜,李瑞莲. 硝酸布康唑栓微生物限度检查方法适用性试验研究[J]. 中国药事, 2017,31(1):43-48.
[13] 李立娜. 复方碘口服溶液微生物限度检查方法学验证 [J]. 内蒙古中医药,2016,35(13): 143-144.
[14] 汤茜,李瑞莲. 盐酸莫西沙星片微生物限度方法适用性研究[J]. 国外医药:抗生素分册, 2016,37(4):172-176.
[15] 罗静. 复方磺胺甲噁唑片《中国药典》2015版微生物限度检查法的建立[J]. 现代医药卫生, 2016,32(17):2652-2655.
[16] 朱荣峰,简敏骞,朱晓燕. 天麻丸新版药典微生物检验方法研究 [J]. 今日药学, 2016,8:568-570.

